RASSF1A基因对乳腺癌细胞恶性生物学特征的作用研究
郑 璐,汤 铜,杜 旺,贾文俊,张 磊,钱 波,李 佳, 黄 赞,丁一博
全球癌症数据显示,乳腺癌(breast cancer, BC)已跃居成为全球女性最常见恶性肿瘤,同时也成为女性癌症死亡的“头号杀手”。根据美国癌症协会估计,美国2014年确诊的乳腺浸润性癌约235 030例,新确诊的BC病例约62 980例,死于BC的患者约40 430例,在过去的几十年,BC的发病率逐年上升,而死亡率呈现下降趋势,这得益于对BC早期发现和更加有效的治疗[1]。随着人们对BC分子机制和相关发病基因认识地不断加深,许多抑制凋亡或引起细胞增殖的分子已经成为肿瘤治疗的新靶点[2-3]。
Ras相关区域家族1基因(RAS-association domain family tumor suppressor protein 1 A,RASSF1A)基因,是 2000年Dammann et al[4]在研究肺癌时通过酵母双杂交筛选法首次发现的,它位于人类3号染色体短棒2区第1条带第2亚带(3p21.3)上。自2000年作为一种候选抑癌基因被发现以来,RASSF1A基因已经被广泛研究。研究表明[5],RASSF1A几乎在全身正常组织器官中均表达,而在肺癌、肾癌、肝癌、乳腺癌、膀胱癌、鼻咽癌、前列腺癌等许多实体肿瘤中存在表达缺失。该研究利用脂质体介导细胞转染,将RASSF1A基因导入BC细胞MCF-7,研究其对BC细胞增殖、凋亡等恶性生物学特征的影响,探讨其在BC发生发展中的作用。
1 材料与方法
1.1 实验材料BC细胞株MCF-7购自北京北创生物技术研究院细胞库;DMEM培养基购自美国Hyclone公司;Opti-MEM培养基、胎牛血清、TRIzol试剂购自德国GIBCO公司;RIPA裂解液、胰酶裂解液、青-链霉素购自广州碧云天公司;RASSF1A表达质粒、实时荧光定量PCR(Real-time PCR,RT-PCR)(Cat# GMRS-001)购自上海吉玛公司;Lipofectamine® 2000 Transfection Reagent(Cat# 11668027 )购自上海Invitrogen公司;RASSF1A单克隆抗体(Cat# ab23950)购自英国Abcam公司;Oligo dT购自上海生工公司;四甲基偶氮唑盐法(3-4,5-dimethylthiazol-2-yl-2,5-dipheyl tetrazolium romide, MTT)细胞增殖及细胞毒性检测试剂盒(Cat# KGA311)购自北京凯基生物公司;Annexin V-FITH/PI双染细胞凋亡检测试剂盒(BB-4101-1)、吉姆萨染液购自上海贝博生物公司;生物安全柜购自北京AIRTECH公司;细胞培养箱购自德国Thermo公司;荧光倒置显微镜购自日本Nikon公司;MX3000P实时荧光定量PCR仪购自美国Stratagene公司;流式细胞仪购自美国Beckman公司。
1.2 细胞培养BC细胞株MCF-7用含10% FBS、1%青霉素-链霉素合剂(青霉素100 U/ml,链霉素0.1 mg/ml)的DMEM完全培养基,在5% CO2、37 ℃条件,一定湿度培养箱中培养。
1.3 细胞转染① 转染前1天在24孔板中以0.5×105~2×105每孔处于对数期、生长状态稳定的细胞接种于500 μl的不含抗生素的培养基中。转染时细胞可长至60%~70%融合。② 按照Invitrogen公司的LipofectmaineTM2000转染步骤,按照DNA 500 ng,将带荧光的质粒的Lipo2000设置三个梯度为1、1.5、2 μl转染MCF-7细胞,转染后继续在温度37 ℃、含5% CO2的孵箱中培养。③ 48 h后在荧光显微镜下观察转染效率并确定优转染条件。④ 按照最优条件调整转染规模,分3组通过脂质体转染将质粒空载pEX-4和重组质粒pEX-4-RASSF1A分别转染MCF-7细胞,空白对照组仅加入相同浓度的脂质体。根据后续实验要求,于转染后24~72 h显示/分析转染的细胞。
1.4 RT-PCR检测转染后细胞RASSF1A基因mRNA水平表达情况按照1.3中实验步骤转染MCF-7细胞,取转染后48 h 3组细胞,用TRIzol试剂分别提取3组细胞总RNA,应用逆转录试剂盒合成cDNA,反应条件为:42 ℃、30 min;85 ℃、10 min。合成cDNA后进行RT-PCR实验,反应条件为:95 ℃、3 min变性;95 ℃、12 s;62℃、40 s 40循环。最后绘制熔解曲线。实验结果按照2-ΔΔCt方法计算,重复3次,取平均值。
1.5 Western blot检测转染后细胞RASSF1A蛋白表达情况按1.3中实验步骤转染MCF-7细胞,取转染后48 h 3组细胞,分别提取各组细胞总蛋白,测定各组细胞所提取蛋白含量后进行SDS-PAGE电泳及转膜、封闭及免疫反应、ECL发光检测、采集图像,分析3组细胞中RASSF1A表达情况。
1.6 MTT法检测转染后MCF-7细胞增殖水平变化按1.3中实验步骤转染MCF-7细胞,转染后48 h将3组细胞分别接种至4块96孔板中,每组细胞设置5个复孔,每孔2 000个细胞,另取一孔为校准孔。接种后将96孔板置于温箱(37 ℃,5% CO2,一定湿度)内培养,分别在0、24、48、72 h取出一块96孔板,每样品孔加入50 μl 1×MTT,继续温箱内孵育4 h后终止培养,各孔加150 μl DMSO后置于平板摇床上摇晃10 min ,酶标仪测定各孔光吸收值,记录结果。实验重复3次,取平均值。以时间为横轴,光吸收值为纵轴绘制细胞生长曲线。
1.7 平板克隆按1.3中细胞转染步骤转染MCF-7细胞,取转染后48 h 3组细胞,胰酶消化,并把细胞悬浮在10%胎牛血清的DMEM培养液中备用。每组细胞分别以每皿200个细胞接种于含10 ml 37 ℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。置37 ℃、5% CO2及饱和湿度的细胞培养箱中培养。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃培养液,用PBS小心浸洗2次,加4%多聚甲醛固定细胞5 ml固定15 min。然后去固定液,加适量GIMSA应用染色液染10~30 min,然后用流水缓慢洗去染色液,空气干燥。计数细胞克隆数目,计算克隆形成率。克隆形成率(%) =(克隆数/接种细胞数)×100%。实验重复3次,取平均值。
1.8 流式细胞术检测细胞凋亡按1.3中细胞转染步骤转染MCF-7细胞,转染后48 h分别取3组细胞,用不含EDTA胰酶消化后离心,收集细胞。用冷PBS洗涤细胞2次(4 ℃、300 r/min离心5 min,收集1×105~5×105个细胞)。加入400 μl的1×Annexin V结合液悬浮细胞,将混合液转入流式管(用锡箔纸包住)中。加入5 μl Annexin V-FITC 染色液混匀后,于2~8 ℃环境,避光孵育15 min。加入10 μl PI染色液,混匀后于2~8 ℃环境避光孵育5 min后进行流式细胞仪的观察和检测。记录3组细胞凋亡细胞百分率,实验重复3次,取平均值。
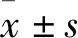
2 结果
2.1 荧光显微镜下观察细胞转染效率转染细胞株于荧光倒置显微镜观察生长状态及转染效率,见细胞生长状态良好,转染后细胞荧光强度高,见图1。
2.2 RT-PCR检测RASSF1A基因mRNA水平表达情况RT-PCR表达水平检测表明:相对于空白细胞组及空载体对照组,实验组细胞中RASSF1A表达水平显著增加,差异有统计学意义(P<0.05),见表1。
2.3 Western blot检测转染后各组细胞RASSF1A基因蛋白质水平表达情况Western blot法主要是从蛋白水平上进行检测分析。分别提取3组细胞总蛋白,分析3组细胞中RASSF1A表达情况,结果显示,转染的RASSF1A的实验组RASSF1A蛋白表达量相对于空载体组以及空白细胞组明显提升。见图2。
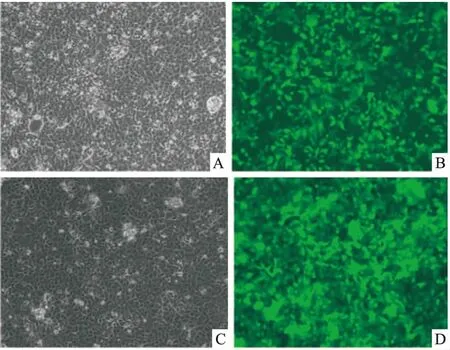
图1 细胞转染后48 h ×100
A:细胞照片;B:含目的基因RASSF1A组;C:细胞照片;D:空载体对照组
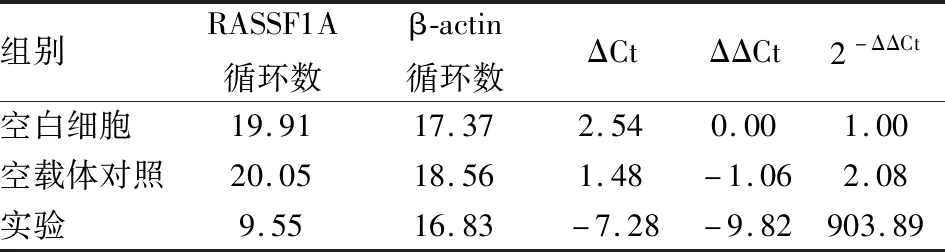
表1 RT-PCR检测mRNA表达水平结果
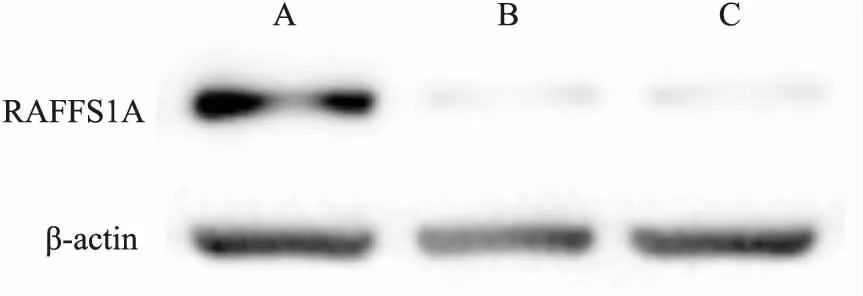
图2 三组细胞中RASSF1A基因蛋白质表达水平改变
2.4 RASSF1A表达量上调后MCF-7细胞增殖水平改变MTT比色实验是一种通过测定细胞能量代谢水平用以间接反映细胞增殖情况的检测方法,在本研究中用于检测细胞转染后实验组与对照组的细胞增殖能力是否改变。MTT实验结果发现,24 h后转染了RASSF1A基因的实验组相比于转染了空白细胞对照组增殖速率明显下降(P<0.05),48及72 h后转染了RASSF1A基因的实验组相比于转染了空载体的对照组以及空白细胞对照组增殖速率明显下降,实验重复3次,各时间段实验组与对照组比较差异均有统计学意义(P<0.05)。见图3。
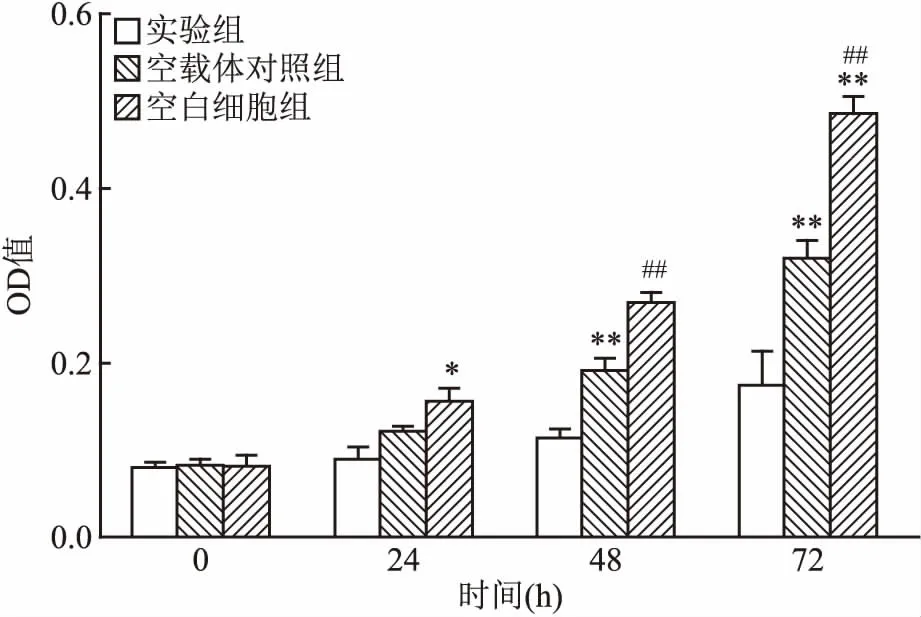
图3 MTT结果分析三组细胞增殖速率差异
与实验组比较:*P<0.05,**P<0.01;与空载体对照组比较:##P<0.01
2.5 RASSF1A表达量上调后MCF-7细胞凋亡水平改变流式细胞术检测结果显示相对于空载体对照组(平均凋亡率为16.88%)及空白细胞组(平均凋亡率为10.13%)实验组凋亡率明显增加(平均凋亡率为39.82%),差异有统计学意义(P<0.05)。见图4。
2.6 RASSF1A表达量上调后MCF-7细胞克隆形成能力改变平板细胞克隆形成实验检测细胞克隆形成率,反映细胞群体依赖性和增殖能力两个重要性状。实验结果显示,转染了RASSF1A基因的乳腺癌细胞MCF-7平均克隆形成率为12.5%,而转染了空载体的乳腺癌细胞MCF-7平均克隆形成率为38.5%,空白细胞对照组平均克隆形成率为54%,实验组与空载组及空白细胞组相比,平均克隆形成率明显降低,差异有统计学意义(P<0.05),见图5。
3 讨论
RASSF家族即Ras相关区域,包含RASSF1-10十个成员[6]。其中RASSF1-6拥有C端Ras相关区域,而RASSF7-10则包含了N端Ras相关区域[7]。其中RASSF1基因包含8个外显子(1α、1β、2αβ、2γ、3、4、5和6),通过不同启动子利用和可变剪接,RASSF1基因在人体中可以产生7种转录本目前研究最多的是RASSF1A和RASSF1C[8]。RASSF1A由外显子1α、2αβ、3、4、5、6编码,其中外显子3、4、5、6编码Ras相关区域[9]。RASSF1A的cDNA全长1 873 bp,其包含的开放阅读框架编码一个分子量为38.8 ku含有340个氨基酸的蛋白多肽。RASSF1A蛋白含有多个重要的区域,从N端到C端分别为SH3结合区域、C1/定向非循环结合域即蛋白激酶C保守区毛细血管共济失调突变激酶磷酸化位点、Ras相关区域[10]。
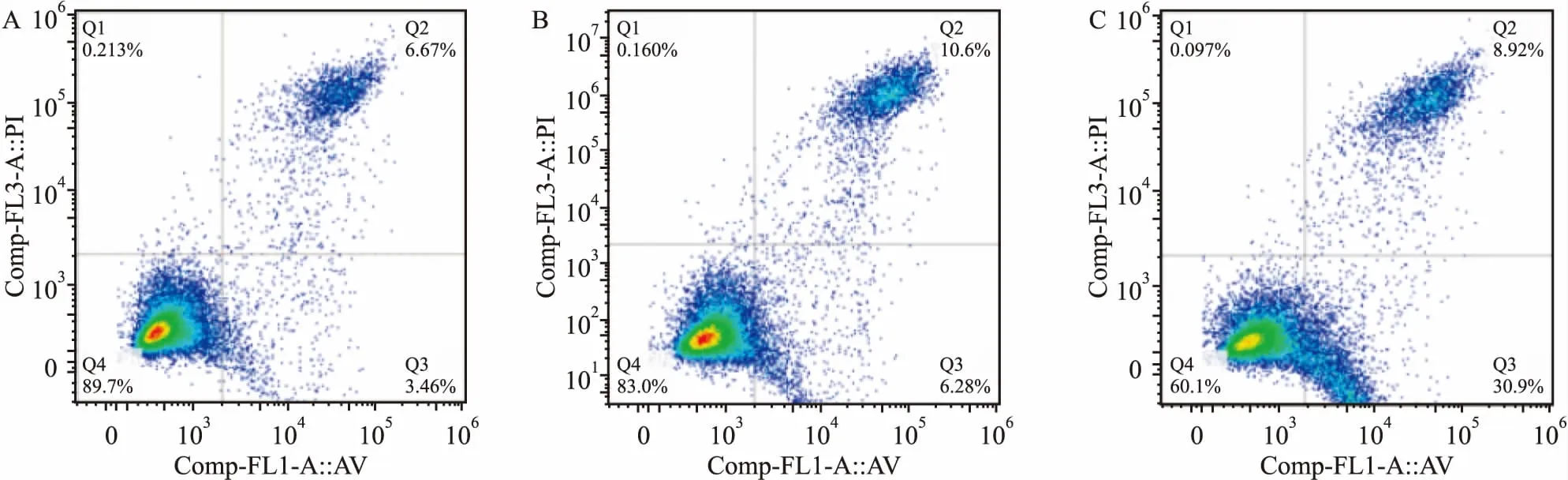
图4 PI/AnnexinV双染法分析三组细胞凋亡率差异
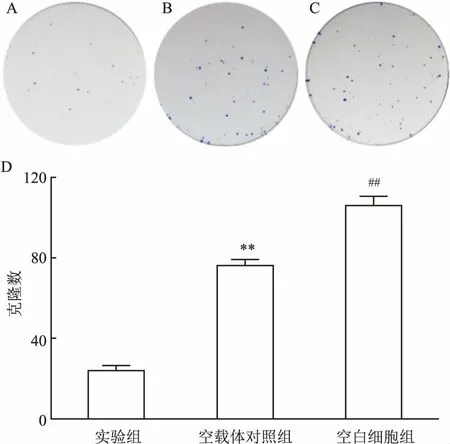
图5 RASSF1A表达量上调后MCF-7细胞克隆形成能力改变
A:实验组;B:空载体对照组;C:空白细胞组;D:统计图;与空载组比较:*P<0.05;与空白组比较:#P<0.05
研究[11]表明作为一种抑癌基因,RASSF1A的过表达能够导致细胞周期停滞、促进细胞凋亡和降低肿瘤细胞的致瘤性。而其表达的缺失与肿瘤发生、发展联系密切[12]。RASSF1A在多种实体肿瘤中存在表达缺失,其表达缺失的与启动子CPG岛甲基化相关[13]。Dammann et al[4]首次发现RASSF1A时,便指出使肺癌细胞重新表达RASSF1A基因可抑制其集落形成、非锚定生长以及裸鼠成瘤的能力。Zhou et al[14]研究表明,通过慢病毒介导使胃癌细胞重新表达RASSF1A可在体内外抑制其侵袭性表型。Vos et al研究显示[15],通过RNA干扰下调RASSF1A基因表达可导致细胞周期调控失调,增加遗传不稳定性。Dammann et al[4]研究发现在五种BC细胞系(MCF7、 MDAMB157、 MDAMB231、 T47D和ZR75-1)中RASSF1A启动子全部甲基化,而其转录本则缺失。Tommasi et al[16]研究表明RASSF1A基因敲除的小鼠相对于对照组表现出较高的肿瘤多形性,并且肿瘤体积更大。
目前,国内外对RASSF1A在BC中的研究主要集中于启动子甲基化,而有关将RASSF1A基因转染入BC细胞,对其恶性生物学特征的影响及其与临床预后的关系报道较少。本研究在前期研究的基础上,通过脂质体细胞转染将RASSF1A基因导入BC细胞MCF-7中,研究RASSF1A基因高表达对乳腺癌MCF-7细胞的增殖、凋亡的影响,MTT、平板克隆及流式细胞术检测结果显示:与对照组相比,RASSF1A基因过表达的MCF-7细胞株增殖、克隆形成能力受到抑制,而细胞凋亡率增加。其影响具体机制将在接下来的课题中进一步研究。

