手术联合细胞治疗皮肤型黑色素瘤的疗效观察
张启婷,赵 华,李文明,曹晓卉,贾绍昌
黑色素瘤(malignant melanoma,MM)是一种因黑色素细胞病理性增生导致的恶性肿瘤,早期便可发生转移,具有恶性程度高,术后复发率高,死亡率高等特点[1]。局部增生或原位癌等早期MM患者,通过手术治疗可得到痊愈,但许多患者早期未予重视,常发展到中晚期,特别是发生转移的患者,则很难治愈,术后复发率极高。其中位生存期仅8~9月,三年生存率仅10%~15%,5年生存率少于10%[2]。MM常规治疗方案首选手术治疗,辅助放化疗,但MM对放化疗敏感性极低[3]。近年来随着人类对肿瘤免疫认识的提高,肿瘤的免疫治疗有了迅速的发展,同时免疫治疗也成为肿瘤治疗领域的热门领域,成为人类攻克恶性肿瘤的新希望。MM为目前研究的对免疫治疗敏感性较强的一种,因而成为国内外学者在免疫治疗方面的主要研究对象[4]。课题组之前针对树突状细胞(dendritic cell,DC)联合细胞因子诱导的杀伤(cytokine-induced killer,CIK)细胞对MM患者的免疫疗效已有报道[5]。该研究收集手术治疗联合DC-CIK细胞疗法的患者及单独使用手术治疗的患者,回顾性分析两者产生临床收益的差别。
1 材料与方法
1.1 病例资料选取于2008年6月~2018年6月在中国人民解放军第八一医院住院治疗的59例皮肤型MM患者。患者年龄24~88岁,中位年龄60岁,其中32例接受手术联合DC-CIK细胞治疗,27例接受手术治疗。两组患者病例资料差异无统计学意义(P>0.05),见表1。病例纳入标准:① 经病理学确诊为黑色素细胞瘤,并且原发灶位于皮肤;② 治疗组患者经过至少2次及以上的DC-CIK细胞治疗,并且未接受其他辅助治疗;③ 对照组患者经过手术治疗仅辅以姑息治疗;④ 卡氏(karnofsky,KPS)功能状态评分标准评分≥60分,预计生存期不少于3个月;⑤ 心、肝、肾等主要脏器无明显功能异常。治疗组病例排除标准:① 怀孕或哺乳期女性;② 年龄≤18周岁;③ 有严重感染性疾病、自身免疫病或器官衰竭者;④ 对生物制剂过敏者。患者不同病情、性别及年龄比例差异无统计学意义(P>0.05),比较具有合理性。本研究经本院伦理委员会审核同意,由患者或其家属知情并签署同意书。
1.2 方法
1.2.1主要仪器与试剂 COM.TE血细胞分离机购自德国Fresenius公司;Beckman Coulter XL流式细胞仪购自美国Beckman 公司;eppendorf Centrifuge 5810 R离心机购自德国eppendorf公司;Ficoll淋巴细胞分离液购自天津灏洋生物制品科技有限公司;抗CD3单克隆抗体购自北京宝日医生物技术有限公司;KBM-581、KBM-551培养基、临床使用标准品rhG-CSF均购自康宁生命科学有限公司;临床使用标准品重组人白介素-2(recombinant human interleukin-2,rhIL-2)购自北京四环生物制药有限公司;重组人干扰素(recombinant human interferon,rhIFN-γ)购自上海生物医药有限公司;重组人白介素-4(recombinant human interleukin-4,rhIL-4)、重组人肿瘤坏死因子(recombinant human tumor necrosis factor-α,rhTNF-α)均购自美国Peprotech 公司;流式抗体CD3-ECD、CD4-PC5、CD8-FITC、CD86-PC5、CD11c-PE、HLA-DR-ECD、CD83-FITC、CD80-FITC、CD54-PC5、CD4-FITC、CD3-PC5、CD8-PE、CD25-PE、CD16+CD56-PE均购自美国Beckman公司。
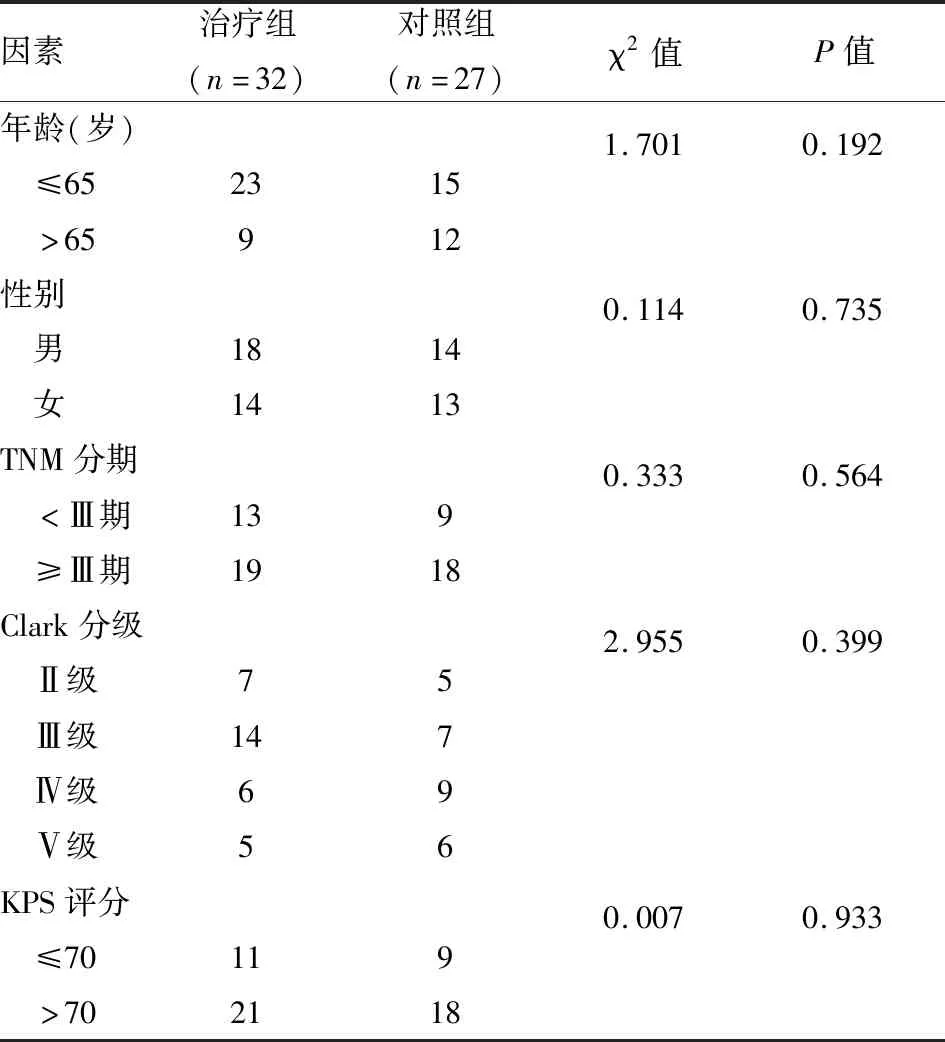
表1 两组患者临床资料比较(n=59)
1.2.2治疗 按照《中国黑色素瘤诊疗指南》[3],手术视原发灶部位选择麻醉方式,沿原发病灶边缘1~3 cm范围完整切除病灶,切除深度至深筋膜深面,伴有淋巴结转移者做区域淋巴结清扫,伴转移灶者可做转移灶切除术。术后对照组辅以对症姑息治疗,治疗组予以DC-CIK细胞治疗,DC疫苗于第7天开始每隔一周分4次于皮下六点注射(双侧锁骨下、双侧腋窝下、双侧腹股沟淋巴结引流区),回输量约1.0×107~4×107/次,CIK细胞于9~21 d内视情况分3次输完,回输量约1.0×109~3×109/次。每个疗程间隔3个月。
1.2.3DC-CIK细胞及DC疫苗的制备 运用血细胞分离机采取患者自体血60 ml,置于50 ml离心管,离心分离出血浆,56 ℃水浴灭活用于后期细胞培养。血细胞用生理盐水稀释,加入淋巴细胞分离液,密度梯度离心,吸取白膜层即外周血单个核细胞层,用KBM-551培养基调整细胞密度为(2×106~3×106) /ml,铺于细胞培养瓶中,孵育1~2 h,移出上层培养液留于CIK细胞的培养。向培养瓶中加入含rhIL-4 10 ng/ml和重组人粒细胞刺激因子注射液(recombinant human granulocyte colony-stimulating factor,rhG-CSF)500 U/ml的KBM-581培养基,放置于37 ℃、5% CO2培养箱中培养,隔天换液,第5天加入抗原致敏,第6天加入rhTNF-α 500 U/ml,第7天回收DC细胞,制成细胞悬液,回输前进行细菌、真菌、内毒素检测,并用流式细胞仪检测DC细胞表型(HLA-DR+、CD11c+、CD54+、CD80+、CD83+、CD86+)。CIK细胞的制备:将之前收集的悬浮细胞用KBM-551培养基,调整细胞数目为1×106/ml,添加rhIFN-γ 1 000 U/ml,24 h后rhIL-2 500 U/ml、antiCD3 mAb 50 ng/ml,隔天补液,并添加400 U/ml rhIL-2,视细胞状态及数量于细胞培养第9~21天内将细胞分3次回收输入患者体内,回输前进行细菌、真菌、内毒素检测,流式检测CIK细胞表型(CD3+CD4+、CD3+CD8+、CD3-CD56+,主要为CD3+CD56+)。
1.3 评价方法
1.3.1随访 对每位患者进行随访,最长随访时间为89个月。从治疗开始到死亡或至随访截至日期计算总生存期(overall survival,OS),从治疗开始至疾病进展计算无进展生存期(progression-free survival,PFS)。
1.3.2免疫功能 分别于治疗前及治疗后两个月内抽取患者外周血,流式细胞术检测患者外周血T淋巴细胞亚群的分布情况,主要指标为CD3+、CD3+CD4+、CD3+CD8+、CD3-CD56+、CD4+CD25+。
1.3.3疗效观察 ① 治疗期间密切观察患者症状、体征,注意是否发生不良反应,并记录其表现、发生时间、处理方法及转归(不良反应评级按照美国国立癌症研究所《常见不良反应标准》进行评估。② 治疗后1个月复查血常规、肝功能,3个月复查胸腹部X线计算机断层摄影(computed tomography, CT),了解有无复发,病情稳定可延长至3~6个月复查。③ 密切观察患者治疗前后精神状态、睡眠及进食情况;观察治疗前后生活质量变化,采用KPS功能状态评分标准,以治疗后KPS增加≥10分为生活质量改善,变化<10分为生活质量稳定,减少≥10分为生活质量降低,以生活质量改善为有效,稳定及降低为无效。
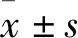
2 结果
2.1 DC-CIK细胞鉴定DC细胞培养后伸出突触,并随培养时间的增长,触角增多增长,第7天流式检测成熟DC细胞表面标志,HLA-DR、CD54、CD80、CD83、CD86大于90%;CIK细胞培养后细胞变大,聚集成团,第10天流式检测CIK细胞,效应型细胞CD3+CD8+、CD3+CD56+数量明显增多。见图1。
图1 DC-CIK细胞培养前后变化 ×400
A:DC细胞培养前后照片;B:CIK细胞培养前后照片;1:培养前;2:培养后
2.2 两组OS及PFS比较治疗组32例,死亡15例,中位OS为49个月,中位PFS为19.5个月,1年生存率84.4%,3年生存率62.5%,5年生存率37.5%;对照组27例,死亡17例,中位OS为27个月,中位PFS为13个月;1年生存率77.8%,3年生存率29.6%,5年生存率14.8%;χ2检验结果显示,治疗组生存率优于对照组,其中3年生存率差异有统计意义(P=0.012),见表2;Kaplan-Meier生存曲线和Log-rank test检验结果显示,两组患者OS比较,治疗组患者OS优于对照组患者,差异有统计学意义(P=0.028 7),两组患者PFS比较,差异无统计学意义(P=0.165 0)。见图2。
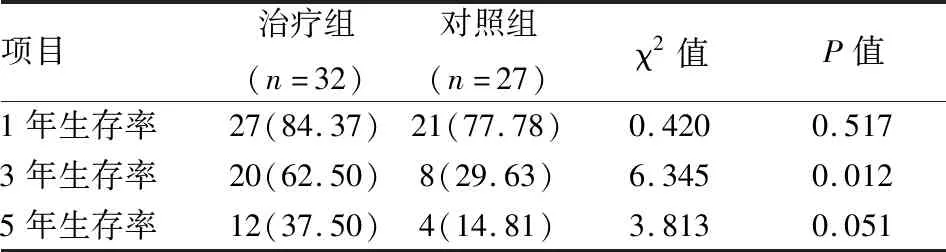
表2 两组患者生存率比较[n(%)]
2.3 两组患者治疗前后免疫功能变化比较对两组患者治疗前后进行淋巴细胞亚群检测,结果显示:对照组CD3+、CD3+CD4+、CD3+CD8+、CD4+CD25+、CD3-CD56+细胞亚群比例无明显变化(P>0.05);治疗组总T淋巴细胞比例较治疗前增高,差异有统计意义(P=0.0316),细胞毒性T淋巴细胞较治疗前明显上升(P=0.0088),抑制性T淋巴细胞较治疗前下降,差异有统计学意义(P=0.0040),余无明显变化。见表3。举1例治疗组患者淋巴细胞亚群为例,可见CD3+、CD3+CD4+、CD3-CD56+增高,CD4+CD25+、CD3+CD8+明显降低。见图3。
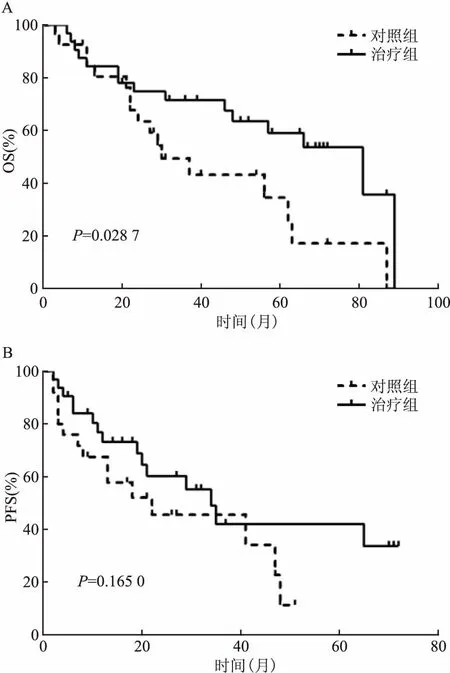
图2 两组患者OS及PFS曲线
A:两组患者OS曲线比较;B:两组患者PFS曲线比较
表3 两组患者治疗前后外周血T淋巴细胞亚群变化情况比较
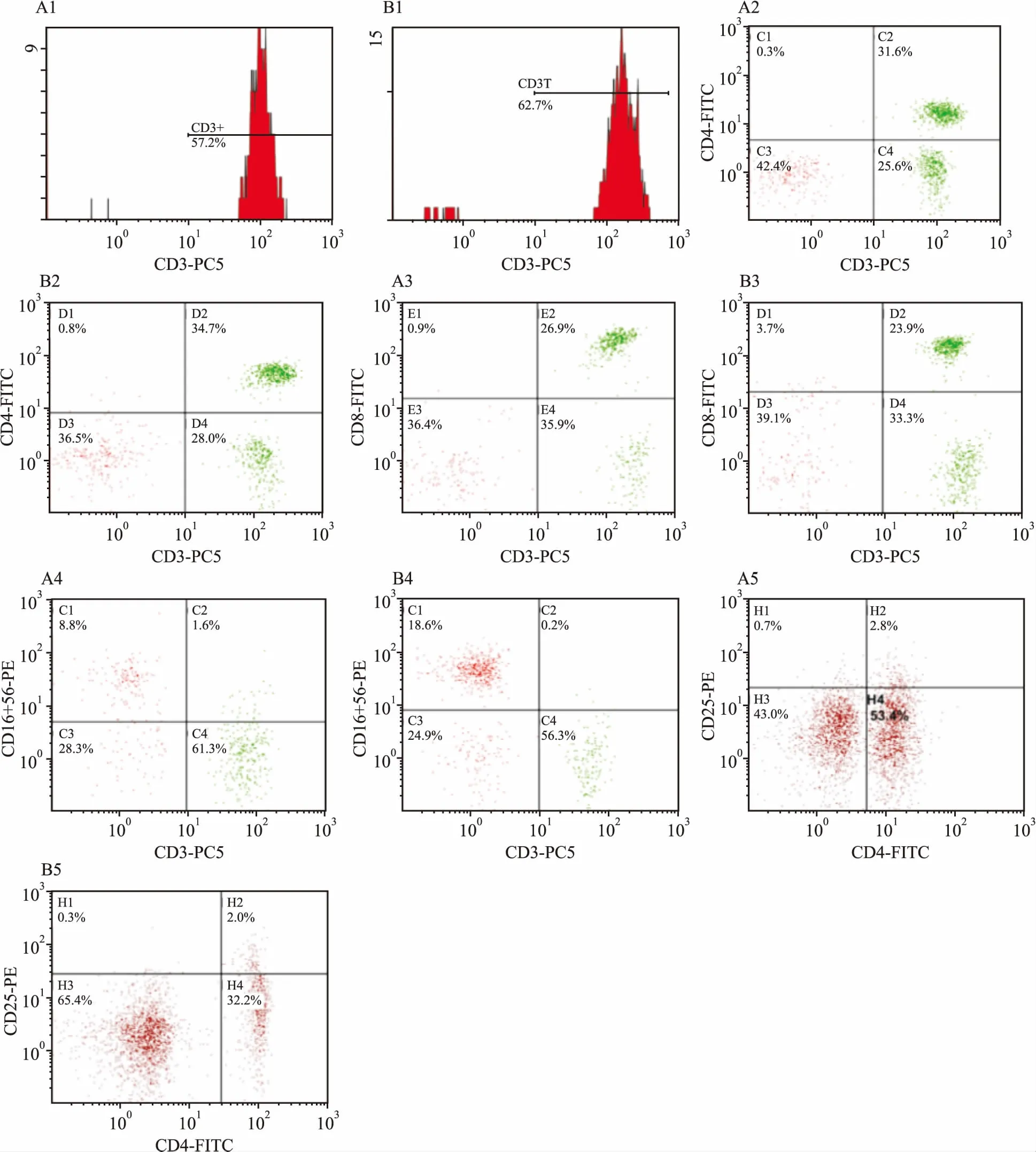
图3 治疗组1例患者治疗前后的淋巴细胞亚群图
A:细胞治疗前;B:细胞治疗后;1:CD3+流式图;2:CD3+CD4+流式图;3:CD3+CD8+流式图;4:CD4+CD25+流式图;5:CD3-CD56+流式图
2.4 两组患者治疗前后生活质量改变比较治疗组中有效22例,无效10例;对照组中有效11例,无效16例,Kruskal-Wallis H检验显示治疗组的生活质量改善情况优于对照组,差异有统计意义(P=0.025)。见表4。

表4 两组患者治疗前后生活质量改变情况比较(n)
3 讨论
MM是皮肤癌中最常见的类型,近年来已成为增长最快的肿瘤之一,数据显示2012年MM新增病例数为232 000,死亡例数为55 000,严重影响全球居民健康[6]。研究[7]表明,当肿瘤负荷<1×106时,免疫治疗可能取得较好的疗效。因此先用手术方式减轻肿瘤负荷,再辅以免疫治疗清除微小病灶,并提高自身免疫力以增强机体抗肿瘤免疫,是一种很有希望的联合治疗方式。
DC细胞是目前已知最强的抗原提呈细胞,未成熟DC在抗原刺激后发育成成熟DC,成熟DC可将抗原呈递给T细胞并能分泌细胞因子进一步促进免疫应答。临床上利用DC治疗肿瘤,主要通过体外用特异性肿瘤抗原刺激未成熟DC细胞,DC细胞识别并摄取抗原,发育成具有特异性抗原提呈功能的成熟DC细胞[8]。CIK细胞是由外周血单个核细胞经有序的细胞因子体系诱导后获得的新型的具有免疫效应的细胞群,其兼具自然杀伤细胞的非限制性杀伤特点和T细胞的强抗肿瘤活性[9]。DC和CIK细胞均为肿瘤免疫方面重要的成员,两者具有协同作用,负载特异性肿瘤抗原的DC细胞可介导CIK细胞产生特异性抗肿瘤免疫反应[10]。许多研究[11]表明DC疫苗联合CIK治疗比单独使用DC或CIK更有效果。
本研究用特异性多肽组合负载DC细胞制备MM特异性DC疫苗,采用淋巴结区皮下注射(培养后第7天开始回输第1次,每次隔1周,分4次输完),CIK细胞于静脉回输(培养后第9~21天分3次回输完),以保证CIK细胞对MM的特异性杀伤。治疗时机选择上,治疗组均在手术切除原发灶后进行,细胞治疗疗程不小于2个疗程,对照组为单纯行手术治疗,术后予对症治疗。比较两组患者在生存期、生活质量及免疫功能等方面的变化。
结果显示,治疗组和对照组中位OS分别为49个月及27个月,中位PFS分别为19.5个月及13个月,1年生存率分别为84.4%及77.8%,3年生存率62.5%及29.6%,5年生存率37.5%及14.8%;统计学分析显示治疗组OS及3年生存率优于对照组,差异有统计学意义,其余指标差异无统计学意义;该结果提示DC-CIK细胞治疗虽未延长患者术后PFS,但可延长MM患者术后OS,可能提高患者的远期生存率,这与Zhang et al[10]关于DC-CIK细胞运用于肝动脉灌注化疗栓塞术后肝癌患者的研究结果一致。两组患者淋巴细胞亚群比较,治疗后治疗组患者T细胞比例有明显升高,抑制性T细胞较前下降,CD8+T细胞较前上升,而对照组患者仅CD8+T细胞上升,余无明显变化;抗肿瘤免疫中T细胞介导的细胞免疫是最重要的成员,其数量一定程度反映机体的免疫功能,其中调节性T细胞(regulatory cells, Treg)是一类免疫调节细胞,其可通过抑制机体免疫反应促进肿瘤发生、发展,与肿瘤患者预后紧密相关[12]。CD8+T细胞为效应型细胞,一般认为其为抑制性T细胞,含量越高,抑制性越强,免疫功能越弱[13]。但也有文献[14]报道效应型CD8+T与多种肿瘤的预后成正相关。治疗组患者治疗后总T淋巴细胞上升、Treg细胞比例下降,CD8+T淋巴细胞上升,而对照组仅CD8+T细胞较前上升,提示DC-CIK可以提高患者的免疫功能,这可能是DC-CIK延长患者生存期的原因之一。此外DC-CIK细胞治疗还可提高患者质量,其较单纯行手术治疗的患者有明显优势,差异有统计学意义。这与刘洋 等[15]关于DC-CIK联合化疗治疗MM的研究结果一致。
综上所述,DC-CIK细胞免疫治疗是一种安全有效的肿瘤治疗方式,本研究为进一步探讨免疫治疗提供了可靠的评估依据,但本研究并未探索其作用机制,后期可检测样本细胞因子、凋亡相关蛋白等的变化,进一步深入验证。

