CT影像组学对甲状腺腺瘤及乳头状癌的诊断价值
杜丹丹,李小虎,刘 斌,周 勇,张学喜,吴兴旺
甲状腺腺瘤(thyroid adenoma,TA)是甲状腺病变中最常见的良性肿瘤,部分患者因治疗无效或延误病情致甲亢发生。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的甲状腺恶性肿瘤,恶性程度最低,当早期发现肿瘤局限于腺体内无转移时,手术切除后5年治愈率达90%[1],因此早期诊断TA和PTC对患者的预后具有特别大的价值。目前临床中影像学检查主要为超声和计算机断层扫描(computed tomography,CT)检查,但对上述两种疾病鉴别有一定的困难。影像组学通过医工相结合的方式更加深入的揭示肿瘤内部信息,该技术已被广泛应用于全身各部位肿瘤的评估[2-3],但其在TA的定性诊断方面的应用报道并不多,该文研究影像组学技术在甲状腺良性结节中TA及恶性结节中PTC的诊断中的价值,并与传统超声及CT检查做对比,以期对两种常见甲状腺结节定性诊断提供帮助。
1 材料与方法
1.1 病例资料回顾性收集2016年1月~2018年3月在安徽医科大学第一附属医院术前行甲状腺CT及超声检查甲状腺结节患者269例,所有病例均经外科手术病理或细胞学穿刺证实,其中TA 110例,男26例,女84例,年龄19 ~77(47.7±15.5)岁;PTC 159例,男49例,女110例,年龄13 ~75(42.8±14.05)岁。纳入标准:① 单纯TA或PTC结节;② 同时有CT、超声检查及病理或细胞学穿刺结果;③ 所有患者有原始数据(digital imaging and communications in medicine,DICOM);排除标准:① 病灶小于1 cm;② 非同一台CT扫描的病例;③ 伪影较多及噪声太大影响图像质量的病例。
1.2 扫描方法采用TOSHIBA Aquilion16排CT扫描仪器。所有患者均行CT平扫检查,扫描范围从耳下至主动脉弓上。螺旋CT扫描条件为:管电压:120 kV,管电流:300 mAs,层厚:5 mm,螺距:0.984 ∶1,FOV:32.0 cm。
1.3 纹理特征提取、统计学习及建模分析将所有患者CT平扫DICOM数据导入影像组学智能分析软件 (artificial intelligent kit,AK),此软件购自上海通用电器医疗公司,由2名从事影像诊断10年的医师对图像进行处理,其中一名医师对甲状腺结节感兴趣区(region of interest, ROI)进行手动勾画,另一名医师验证。在勾画ROI前仔细观察图像是否存在伪影,根据病灶图像质量及大小勾画,尽量与病灶边缘保持一致,每个病灶选取ROI约1~3个,总共获得541个ROI,通过AK软件分析,每个ROI获取396个影像组学特征,包括直方图参数,灰度共生矩阵,游程矩阵等六类参数见表1。

表1 影像组学特征
2 结果
2.1 TA及PTC的患者基本信息两组病例之间性别、年龄的差异无统计学意义(F=0.974,P=0.325;χ2=1.668,P=0.197),见表2。
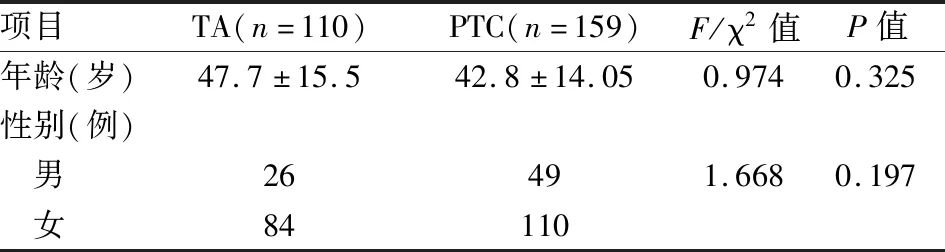
表2 患者的基本信息
2.2 TA及PTC的超声及CT平扫诊断结果269例甲状腺结节患者用超声检查正确诊断恶性结节132例,良性结节76例,其中假良性27例,假恶性34例,诊断准确度、特异度及敏感度分别为77.3%、73.8%及79.5%。CT平扫检查正确诊断恶性结节102例,良性结节91例,其中假良性57例,假恶性19例,诊断准确度、特异度及敏感度分别为71.7%、61.5%及84.3%。见表3、图1。图1中两例甲状腺占位术前超声及CT平扫均诊断为良性肿瘤,两例均表现为类圆形低密度占位,边界清楚,内见囊变坏死。
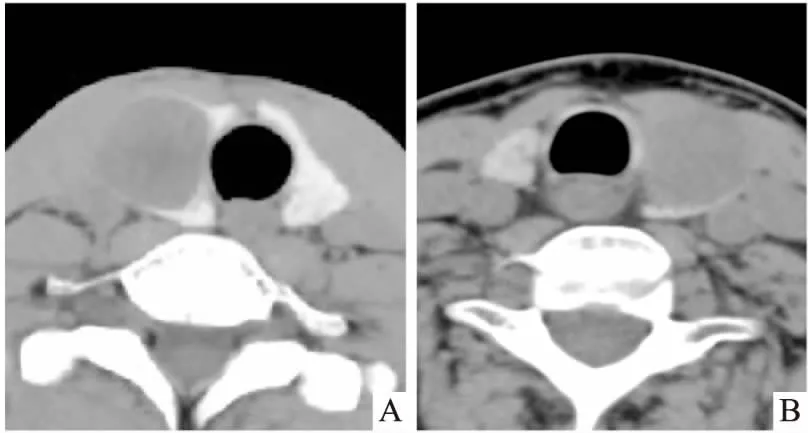
图1 TA、PTC的CT平扫图像
A:甲状腺右侧叶占位,术后病理为TA;B:甲状腺左侧叶占位,术后病理为PTC
2.3 影像组学模型对TA及PTC的分析结果影像组学方法获取其特征的流程图见图2,将所有患者CT平扫DICOM数据导入AK软件,对甲状腺结节边缘勾画,通过AK软件获取影像组学特征参数,包括直方图参数,灰度共生矩阵,游程矩阵等六类参数。
分别随机选择70%病例为训练组,30%病例为验证组,并获取不同模型对于两类甲状腺疾病鉴别诊断的准确度、特异度及灵敏度见表4。
采用统计学方法为缺失值中位数差补和数据标准化,通过特征降维获得179个关键特征参数,并用这些特征组合成三种鉴别TA和PTC的影像组学模型,分别为支持向量机模型(support vector machine,SVM)、 逻辑斯谛回归模型(logistic regression, LR)及贝叶斯方法。
CT平扫影像组学SVM模型得到训练集的准确度、特异度及敏感度分别:100%、100%、100%,测试集分别为:91.4%、95.5%、82.7%,LR模型得到的训练集准确度、特异度及敏感度分别为:92.1%、88.5%、93.6,测试集分别为:82.8%、73.1%、87.4%,贝叶斯方法模型得到的训练集准确度、特异度及敏感度分别为:82.5%,93.7及88%,测试集分别为74.8%、76.9%、73.9%,其中SVM诊断效能最佳。见表5。
3 讨论
TA是临床常见病,在一般人群中的发病率为33%~68%,其中5%~15%的结节是恶性肿瘤[4]。实际检查工作中,由于人眼对图像信息识别能力有限,不同层次和经验的医师对影像特征的把握存在一定差异性,判别能力各不相同,人为因素影响大,影像特征特异性不足,影响临床图像判读的准确性。并且认为穿刺活检取材受限,穿刺病理结果常难以发现整体病灶性质,且为有创检查,存在着一定的操作风险和结果的不确定性。
TA的术前检查常采用影像科医生对传统影像图像的判读,多依据结节的边界(有无突破包膜、有无晕环)、形态(圆形、椭圆形、不规则形)、内部特征(出血、粗细钙化)、有无侵犯及转移来判断病灶的良恶性,对于本组269例甲状腺单纯结节病例中,有57例CT平扫误判为良性,可能的原因有以下几点:① 病灶边界显示较光整;② 病灶内细微钙化肉眼观察不清;③ 病灶内坏死彻底;④ 病灶内有较多粗钙化。以上几点认为是CT平扫检查对甲状腺恶性结节诊断的局限性。研究[5-6]表明微钙化对甲状腺良恶性结节的定性诊断具有重要意义,当超声发现微钙化时往往提示为恶性结节,发现粗钙化时则提示为良性结节可能性较大。本实验观察到在159例乳头状癌中有42例在CT平扫上能看到细点状钙化,部分微钙化在CT上显示不如超声,造成CT平扫恶性诊断率低于超声诊断率。

表3 超声诊断及CT平扫对269例甲状腺良、恶性结节鉴别诊断情况
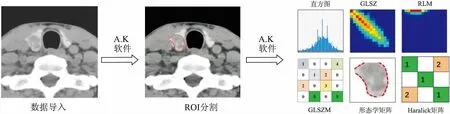
图2 影像组学特征参数获取流程

表4 影像组学训练组和验证组样本分布
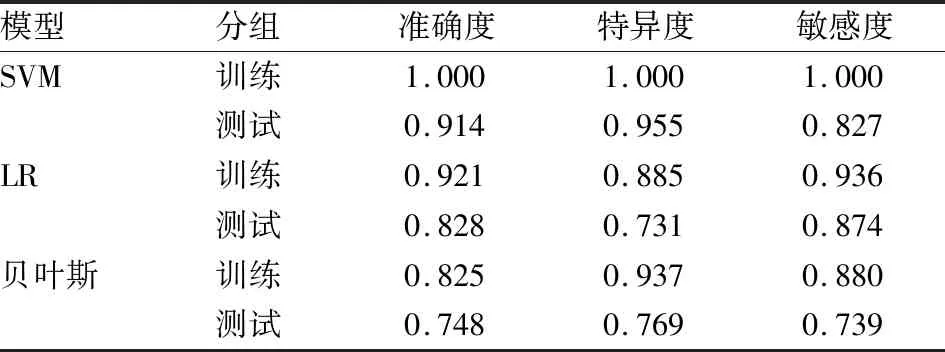
表5 CT影像组学分析鉴别诊断结果
影像组学的概念最早由荷兰学者Lambin et al[7]在2012年提出,主要应用于医学图像并进行定量处理,是指从影像(超声,CT、核磁共振、正电子发射计算机断层显像等)中提取大量影像信息,实现肿瘤分割、特征提取与模型建立,用来预测和分析病变,已经广泛用于影像诊断中,尤其在肿瘤良恶性鉴别中运用较多,例如肺癌、肾癌及神经系统等中[8-9]。目前影像组学对甲状腺结节良恶性的诊断及鉴别诊断国内外应用不多,主要集中在以超声图像为载体的影像组学对甲状腺良恶性结节的鉴别以及预测是否有淋巴结转移。Kim et al[10]使用计算机辅助技术(computer assistant diagnosing, CAD)软件对甲状腺结节的超声图像进行纹理分析,鉴别其良恶性,结果显示超声灰阶成像诊断效能远远超过纹理分析,认为超声纹理分析对鉴别甲状腺恶性没有意义。Abbasian et al[11]应用超声CAD辅助技术来进行纹理分析,对甲状腺结节良恶性进行鉴别,结果显示纹理分析的准确性较高,认为纹理分析能够对鉴别甲状腺结节良恶性有较高的应用价值。吴宇强 等[12]探讨研究基于灰度共生矩阵的纹理特征值测量技术在甲状腺良恶性结节中的鉴别价值,使用Image J软件剪影病灶同一层的平扫和增强图像,测量ROI的纹理特征(对比度、熵和分行维数),结果显示恶性结节的熵及分行维数值均高于良性结节,差异有统计学意义。郭炜 等[13]应用CT-Kinetics软件对甲状腺良恶性结节进行研究,认为熵值在甲状腺良恶性结节间差异有统计学意义。
本研究使用AK软件,基于CT平扫图像的影像组学分析方法提取甲状腺结节的影像特征,分别采用SVM、 LR及贝叶斯三种方法建立TA和PTC的影像组学模型,结果显示SVM回归分析方法建立的预测模型对鉴别两者有较好的结果,明显高于常规超声及CT平扫的诊断结果。综上所述,基于CT平扫图像影像组学分析的SVM预测模型可较好区分TA及PTC,可为这两种病变鉴别诊断提供依据,促进后续治疗工作的顺利开展等具有积极意义。
本研究存在一定局限性:① 选择了以TA为代表的良性结节及以PTC为代表的恶性结节,对甲状腺良恶性结节鉴别结果存在一定的误差;② 甲状腺结节ROI的勾画采用二维手动勾画,图像层厚为5 mm,对图像信息的覆盖不全,且存在主观上的误差;③ 病例数较少,需要调查更大的数据集。

