ApoJ基因修饰的骨髓间充质干细胞移植对脑出血大鼠凋亡的影响
普 绢,刘茂春,陈 慧,刘 亮,徐 斌,刘学良,郑晓梅
脑出血(intracerebral hemorrhage,ICH)是神经科的常见疾病,其致残率及死亡率均较高[1]。线粒体促凋亡因子Omi/HtrA2 Omi又称HtrA2(high temperature requirement A),是存在于线粒体膜间隙的一种丝氨酸蛋白酶,李凤 等[2]研究证明Omi/HtrA2有促进细胞凋亡的作用,近年来细胞凋亡在ICH后继发性损伤中越来越受关注。载脂蛋白-J(apolipoprotein J,Apo J)[3]是一种多功能糖蛋白,在补体调节、凋亡调控、炎症反应等过程中发挥重要作用。研究[4]表明ApoJ可能通过抑制补体级联反应起到神经保护作用,目前国内外少有关于ApoJ对凋亡方面的研究。课题组前期实验运用脂质体介导重组绿色荧光蛋白质粒(plasmid enhanced green florescence protein,pEGFP)pEGFP-N1-apoJ转染大鼠骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs),经RT-PCR、免疫组化、Western blot等技术证明转染后的ApoJ在BMSCs能够稳定且大量表达[5-7]。将转染好的BMSCs移植入大鼠ICH部位,通过Western blot检测显示ApoJ蛋白能在ICH大鼠脑组织中表达[8]。在前期实验成果的基础上,该实验利用外源性ApoJ修饰的BMSCs干预大鼠ICH模型,通过RT-PCR、Western blot法检测血肿周围组织中Omi/HtrA2的含量,结合脑组织含水量、神经功能恢复情况,旨在探讨外源性ApoJ对ICH后继发性损伤的治疗作用。
1 材料与方法
1.1 实验动物与主要试剂3~4月龄雄性SD大鼠110 只,体质量200~250 g,由西南医科大学动物中心提供,大鼠在标准条件下饲养:温度20~28 ℃,相对湿度(65±5)%,噪音85 dB以下,12 h光/暗周期,通风换气8~12 次/h,每天给予营养饲料及足量清洁饮用水。脂质体LipofectaminTM2000及TRIzol Reagent试剂盒购自美国Invitrogen 公司;重组质粒pEGFP-N1-apoJ购自上海生博生物医药科技有限公司;BCA蛋白质浓度测定试剂盒购自美国Thermo公司;兔抗大鼠Omi多克隆抗体购自美国CST公司;兔抗大鼠GAPDH多克隆抗体购自英国abcam公司;HRP标记山羊抗兔购自武汉Aspe生物技术有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser及SYBR®Premix Ex TaqTM试剂盒购自北京TaKaRa 公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.2 实验方法
1.2.1BMSCs的分离、培养及重组质粒转染BMSCs 将2只雄性SD大鼠处死分离出股骨和胫骨,反复冲洗骨髓腔,离心,接种于培养瓶中。在倒置显微镜下观察细胞生长情况,按1 ∶3比例传代培养。将第3 代BMSCs接种至6孔板中,按参考文献[7]的方法,用脂质体介导重组pEGFP-N1-apoJ质粒瞬时转染体外培养的BMSCs,转染后6、24、48、72、96 h在荧光显微镜下观察细胞绿色荧光蛋白表达情况,收集转染效率最高的BMSCs(转染后72 h),将细胞浓度调整为2×107个/ml备用。
1.2.2实验分组及ICH模型的建立 将108只雄性SD大鼠随机分为:ApoJ/BMSCs组、BMSCs组和生理盐水(NS)组,每组36 只。腹腔注射3%水合氯醛麻醉大鼠,固定于脑立体定位仪上,定位右侧尾状核,钻孔,断尾取血,采用经典的“改良二次注血法”注血(50 ul),缓慢退针,缝合切口。造模2 h后用改良神经功能评分法(modified neurological severity score,mNSS)对大鼠进行神经缺失评分[9],8分以上视为造模成功。
1.2.3细胞移植及组织取材 造模成功后 24 h,分别移植30 μl转染细胞悬液、BMSCs悬液和生理盐水至3 组大鼠脑出血部位。移植后又分为1、3、5、7 d 4 个亚组,每亚组9 只。相应时间点腹腔麻醉各亚组大鼠,断头取脑,取组织标本备用。
1.2.4神经功能评分 移植后1、3、5、7 d对各亚组大鼠进行mNSS评分,mNSS评分总分18 分,分值越高表示神经功能越差,其中1~6 分为轻度损伤,7~12 分为中度损伤,13~18 分为重度损伤。
1.2.5测定脑组织含水量 各组大鼠完成神经功能评分后立即处死,取出脑组织秤湿重,再于100 ℃烤箱里烘烤24 h后秤干重,运用干湿重法计算脑组织含水量,其公式为:含水量(%)=(湿重-干重)/湿重×100%。
1.2.6Western blot法检测Omi/HtrA2 提取总蛋白,测定蛋白浓度。上样行SDS-PAGE电泳、转膜、封闭,加入稀释好的一抗和GAPDH过夜,回收已稀释的一抗,用TBST洗3次,再加稀释好的二抗,孵育30 min,最后用TBST在摇床上洗4次,曝光、显影、定影。
1.2.7荧光实时定量PCR 取血肿周围脑组织约100 mg,提取总RNA;取10 μl RNA按PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒进行反转录合成第一链cDNA;采用SYBR®Premix Ex TaqTM试剂盒进行PCR 扩增,同时扩增GAPDH作内参。
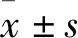
2 结果
2.1 BMSCs分离、形态学观察起初BMSCs分离时呈圆形或椭圆形,大小不等。原代培养24 h后呈多角形、小梭形等多种形态。见图1A。3~5 d后圆形细胞减少,梭形集落细胞互相融合。第6天梭形细胞集落增多,呈旋涡状排列。见图1B。传至第3代时,得到纯度较高、形态均一的细胞。

图1 镜下观察原代培养的BMSCs形态
2.2 重组质粒转染BMSCs后荧光观察选取生长良好的第3代BMSCs用于转染,转染后分别在镜下观察6、24、48、72、96 h荧光表达情况,转染后绿色荧光蛋白的阳性细胞表达逐渐增多,72 h时荧光表达最强。见图2。随后减少,说明转染成功。

图2 镜下观察第3代BMSCs转染后72 h的形态 ×100
A:第3代BMSCs转染后72 h的白光;B:第3代BMSCs转染后72 h的荧光
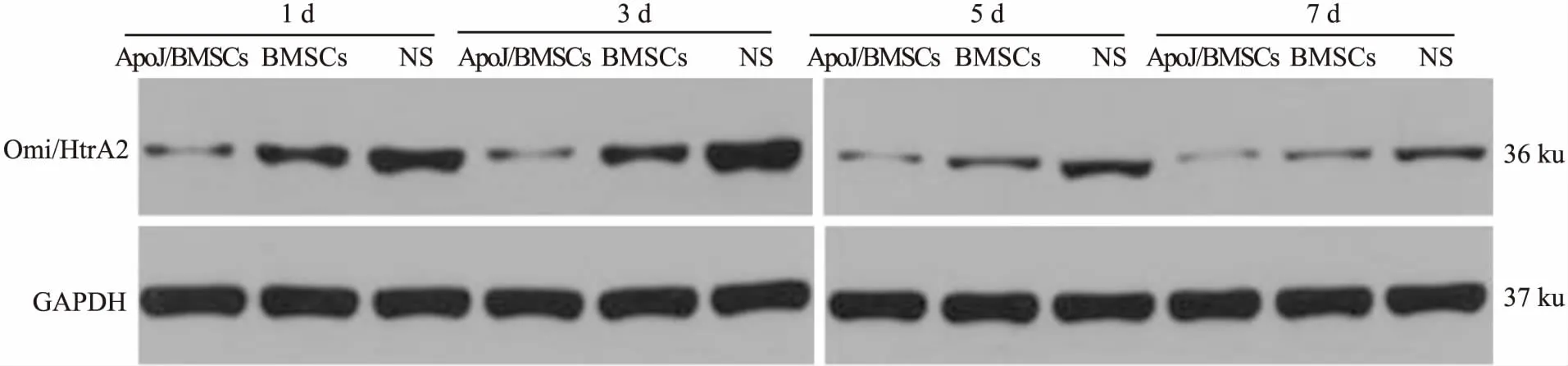
图3 Western blot法检测ApoJ/BMSCs、BMSCs、NS作用于ICH大鼠第1、3、5、7天时Omi/HtrA2蛋白的表达水平
2.3 各组大鼠神经功能缺损评分ApoJ/BMSCs组第3、5、7 天各时间点mNSS评分低于BMSCs组和NS组,其中BMSCs组低于NS组,差异均有统计学意义(P<0.05),见表1。
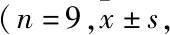
表1 各组大鼠不同时间点mNSS评分比较分)
与BMSCs组比较:*P<0.05;与NS组比较:#P<0.05
2.4 各组大鼠脑组织含水情况ApoJ/BMSCs组第1 、3 、5 、7天各时间点脑组织含水量低于BMSCs组和NS组,其中BMSCs组低于NS组,差异均有统计学意义(P<0.05),见表2。
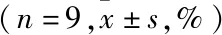
表2 各组大鼠不同时间点脑组织含水量比较
与BMSCs组比较:*P<0.05;与NS组比较:#P<0.05
2.5 各组Omi/HtrA2蛋白表达通过Western blot检测,经过电泳后可见Omi/HtrA2和GAPDH两条带分别为36、37 ku,3组中均有表达。通过对各相应时间点3 组目的条带与GAPDH条带的灰度比值的统计分析,ApoJ/BMSCs组及BMSCs组Omi/HtrA2的表达随着时间的逐渐延长而降低,其中ApoJ/BMSCs组Omi/HtrA2蛋白表达与另外两组比较明显降低,且BMSCs组又较NS组降低,差异均有统计学意义(P<0.05)。见表3、图3。
2.6 Omi/HtrA2 mRNA通过RT-PCR检测,ApoJ/BMSCs组和BMSCs组的Omi/HtrA2 mRNA随着时间的延长逐渐降低,其中ApoJ/BMSCs组的Omi/HtrA2 mRNA较BMSCs组和NS组明显降低,BMSCs组各时间点的Omi/HtrA2 mRNA又较NS组显著减低,差异均有统计学意义(P<0.05),见表4、图4。此结果与Western blot检查结果一致。
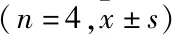
表3 各组不同时间点Omi/HtrA2蛋白表达的变化
与BMSCs组比较:*P<0.05;与NS组比较:#P<0.05
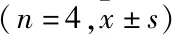
表4 各组不同时间点Omi/HtrA2 mRNA表达
与BMSCs组比较:*P<0.05;与NS组比较:#P<0.05
3 讨论
ApoJ具有众多生物学功能[10],主要包括:脂蛋白的转运、抗细胞凋亡、抑制补体激活、抗氧化应激等。近年来ApoJ 的神经保护作用越来越被国内外学者关注,目前大多关注于ApoJ对缺血性脑卒中、创伤性脑损伤及多种神经退行性疾病的保护作用,较少有关于ApoJ在脑出血方面的研究。近年来ICH后的继发性损伤逐渐引起大家的关注,已有研究[4]表明,ApoJ作为一种补体抑制剂可能通过抑制补体级联反应减少细胞凋亡和水肿,促进神经功能恢复。目前国内外对ICH后细胞凋亡中相关调节基因的研究较少,而细胞凋亡又是导致神经元损伤的重要因素,阻断细胞凋亡有望成为改善ICH预后的有效治疗手段。
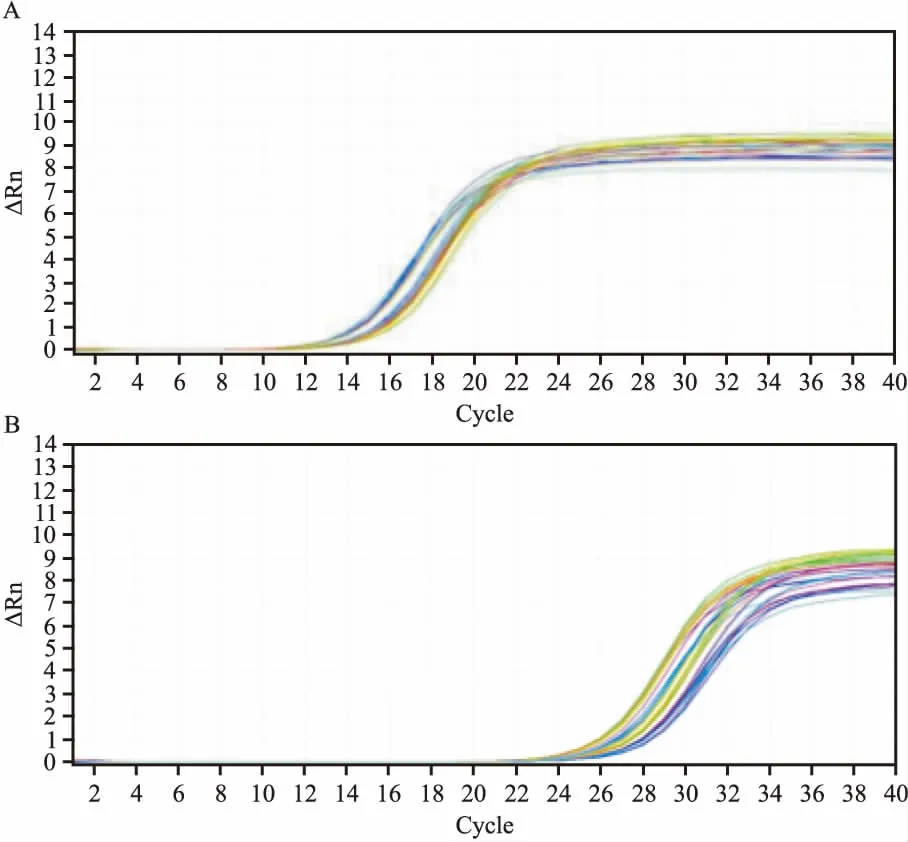
图4 Omi/HtrA2 和内参GAPDH的mRNA 表达扩增图谱
ICH是非外伤性脑实质内血管破裂引起的出血,ICH后除血肿占位效应的直接破坏,还包括血肿周围水肿、血脑屏障破坏、炎性细胞浸润、自由基释放、补体激活、细胞凋亡等造成的继发性损伤。细胞凋亡是ICH后细胞死亡的主要方式,是基因控制的细胞程序性死亡,但引起ICH后细胞凋亡的机制尚不清楚,目前有两个已知通路[11]:外源性凋亡通路和内源性凋亡通路(又称线粒体通路),其中以线粒体通路为主。线粒体的功能在细胞的存活与凋亡之间起着重要调节作用,此过程包括细胞色素C及Omi/HtrA2的释放。Omi/HtrA2正常情况下是存在于线粒体膜间隙中的一种保护性蛋白[12]。ICH后,当细胞受到各种刺激时,线粒体膜通透性改变,Omi/HtrA2从线粒体膜间隙中释放进入细胞质中与X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)结合,抑制XIAP活性,激活Caspase酶原,引起一系列水解反应,降解细胞蛋白导致细胞死亡。Yoshioka et al[13]研究表明在大脑缺血后释放入细胞液中的Omi/HtrA2主要通过抑制XIAP的功能导致神经元损伤,促进神经细胞的凋亡,参与了脑缺血后的病理生理演变过程。
基于上述原因,本实验旨在探讨ApoJ基因对ICH后凋亡可能的影响机制,前期研究[5-7]已证实ApoJ基因能够成功转染BMSCs,且ApoJ蛋白能够在ICH大鼠脑组织中表达,本实验转染结果与文献[5]基本一致。本实验通过RT-PCR、Western blot检测血肿周围组织中Omi/HtrA2的含量变化,结果显示随着时间的逐渐延长,AopJ/BMSCs组和BMSCs组的Omi/HtrA2表达均有所下调,其中AopJ/BMSCs组各时间点下调较BMSCs组均更明显,从而推测ApoJ基因修饰的BMSCs较单独的BMSCs能够更好地减少ICH后Omi/HtrA2的表达。Cordero-Llana et al[14]研究也表明,当脑细胞受损时ApoJ蛋白表达上调,有减少细胞凋亡并促进神经前体细胞的分化的作用,本实验结果与之相一致,ApoJ基因可能通过抑制细胞凋亡起到神经保护作用。
综上,ApoJ基因可能通过抑制Omi/HtrA2介导的细胞凋亡减轻脑水肿,促进神经功能恢复,对ICH具有治疗作用,但ApoJ抑制Omi/HtrA2介导凋亡的具体机制及信号通路需要进一步深入研究,为进一步探讨ApoJ基因对脑出血的治疗提供了新的理论依据。

