小鼠中枢组胺能神经元的特异性投射环路
徐永霞,沈显琦,葛梦临,季 月,田 龙,卞浩东,许 奇
中枢组胺能神经元位于下丘脑后部的结节乳头核(tuberomammillary nucleus,TMN),参与觉醒、学习与记忆等高级神经功能调节[1-2]。传统的辣根过氧化物酶或生物素化葡聚糖胺等神经示踪方法研究发现结节乳头核神经主要投射至内侧隔区、丘脑及前脑等脑区[3]。但这些神经示踪方法缺乏特异性,且中枢组胺能系统调控脑高级行为的功能环路仍不明确。近年来,借助Cre-LoxP重组酶技术可将人源绿色荧光蛋白(humanized Renilla green fluorescent protein,hrGFP)特异性表达在某一特定类型神经元,解析其神经投射环路[4]。该研究拟借助组氨酸脱羧酶(histidine decarboxylase,HDC)-Cre小鼠,将腺相关病毒(adeno-associated virus,AAV)携带的hrGFP特异性表达在TMN组胺能神经元,旨在揭示中枢组胺能神经元的特异性投射环路,为进一步研究其神经功能环路提供解剖学基础。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性HDC-Cre及其野生型(wild type,WT)小鼠8 ~10周龄,体质量22~24 g。小鼠自由摄食、饮水,室温(22±1)℃,湿度(60±2)%,明暗周期12 h(07:00~19:00)。实验遵守安徽医科大学《实验动物管理条例》。
1.1.2试剂 AAV-lox-Stop-hrGFP(日本筑波大学Lazarus M教授赠送);兔抗鼠HDC抗体(货号:AB37291,英国Abcam公司);驴抗兔Alexa Fluor®594抗体(货号:711-585-152,美国Jackson ImmunoResearch公司);胎牛血清(货号:B2064)、Triton-X 100(货号:T8787)均购自美国Sigma-Aldrich公司;多聚甲醛(货号:80096618)、水合氯醛(货号:30037517)、蔗糖(货号:10021418)、磷酸氢二钠(货号:10026310)、磷酸二氢钠(货号:20040718)、氯化钠(货号:10019318)均购自上海国药集团化学试剂有限公司。
1.1.3仪器 冰冻切片机(型号:CM1900,德国Leica公司);脱色摇床(型号:SK-O180-E,美国Scilogex公司);磁力搅拌器(型号:MS7-H280-Pro,美国Scilogex公司);脑立体定位仪(型号:68001)、立体手术显微镜(型号:77002)、高速颅骨钻(型号:78001)均购自深圳瑞沃德生命科技有限公司;压力微量注射推进器(型号:Picospritzer III,美国Parker公司);荧光显微镜(型号:BX51,日本Olympus公司)。
1.2 方法
1.2.1动物手术 水合氯醛(350 mg/kg)麻醉小鼠,将HDC-Cre或WT小鼠固定于脑立体定位仪,定位至结节乳头核(AP:-2.54,MR:+0.6,DV:-5.65 mm)。用高速颅骨将颅骨钻通,但不损伤硬脑膜,借助气体压力推进微注射系统将AAV-lox-Stop-hrGFP(20 nl)经玻璃微注射针缓慢注射至结节乳头核,留针5 min后缝合皮肤[5]。术后恢复及饲养4周。
1.2.2免疫荧光染色 术后4周,水合氯醛(500 mg/kg)深麻醉小鼠,用0.01 mol/L PBS经心灌注小鼠,再用含4%多聚甲醛的0.1 mol/L PBS固定,取出脑组织并经4%多聚甲醛后固定6~8 h,将脑组织依次经过10%、20%和30%蔗糖脱水。待组织完全脱水后行冰冻切片机切片,片厚30 μm。采用漂片法进行免疫荧光染色,将一套全脑切片在室温下用含10%胎牛血清与0.3% Triton-X 100的0.01 mol/L PBS进行封闭1 h,将脑片转至含兔源HDC抗体(1 ∶500)的PBS中孵育,4 ℃过夜。第2天将脑片用0.01 mol/L PBS浸洗6次,每次5 min,避光条件下将脑片转至含有Alexa Fluor®594驴抗兔IgG(1 ∶100)的0.01 mol/L PBS内,室温下孵育1 h,0.01 mol/L PBS清洗后裱片、封片。
1.2.3图像采集与统计分析 封片后的组织切片在荧光显微镜拍照,红色荧光为HDC阳性神经元,绿色荧光为hrGFP阳性神经元及神经末梢。图片经图像处理软件Image J统一进行对比度、亮度、色彩平衡等调节以获得更好的显示效果。首先在低倍显微镜(×4)下找到各核团边界,进一步在高倍显微镜(×100)下找到hrGFP阳性神经元或其神经末梢。借助图像处理软件Image J将hrGFP阳性神经末梢的荧光强度分为丰富、大量、中等、少量+。
1.3 统计学处理采用SPSS 17.0软件进行数据分析,计数资料组间比较选用行列表χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 结节乳头核组胺能神经元的形态特点立体定位微注射法将AAV-lox-Stop-hrGFP微量注射至HDC-Cre小鼠TMN(图1A)。荧光显微镜下观察显示HDC-Cre小鼠表达hrGFP的神经元都位于结节乳头核内(图1B),而WT小鼠结节乳头核内未发现hrGFP阳性信号,即WT小鼠脑内没有hrGFP表达(图1C)。进一步验证hrGFP在组胺能神经元表达的特异性,免疫荧光双标结果显示hrGFP阳性神经元(图1D)同时HDC染色也呈阳性(图1E),hrGFP与HDC共定位在同一类神经元,即本实验中hrGFP阳性神经元均为组胺能神经元(图1F)。
2.2 小鼠脑内组胺能神经元的特异性投射中枢组胺能神经元(hrGFP阳性神经元)的轴突广泛投射至外侧下丘脑、大脑皮层、海马、丘脑及脑桥等几乎整个中枢神经系统。其中,hrGFP阳性神经纤维密集投射至基底前脑、伏隔核、尾壳核、腹外侧视前区等脑区,也投射至中脑多巴胺能腹侧被盖区及黒质致密部,以及脑干及脑桥多个核团,可能与组胺能神经调控睡眠-觉醒行为有关(图2)。组胺能神经元在脑内为双侧投射,以同侧投射为主,其具体投射通路见表1。
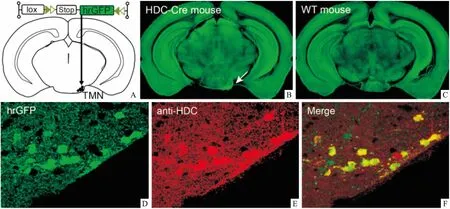
图1 hrGFP在HDC-Cre小鼠TMN组胺能神经元的表达免疫荧光
A:AAV模式图及其微注射位置示意图;B: hrGFP表达在HDC-Cre小鼠TMN ×10;C: WT小鼠TMN没有hrGFP表达 ×10;D: TMN的hrGFP阳性神经元 ×100;E:TMN的HDC阳性神经元 ×100;F: hrGFP与HDC共定位同一类神经元 ×100
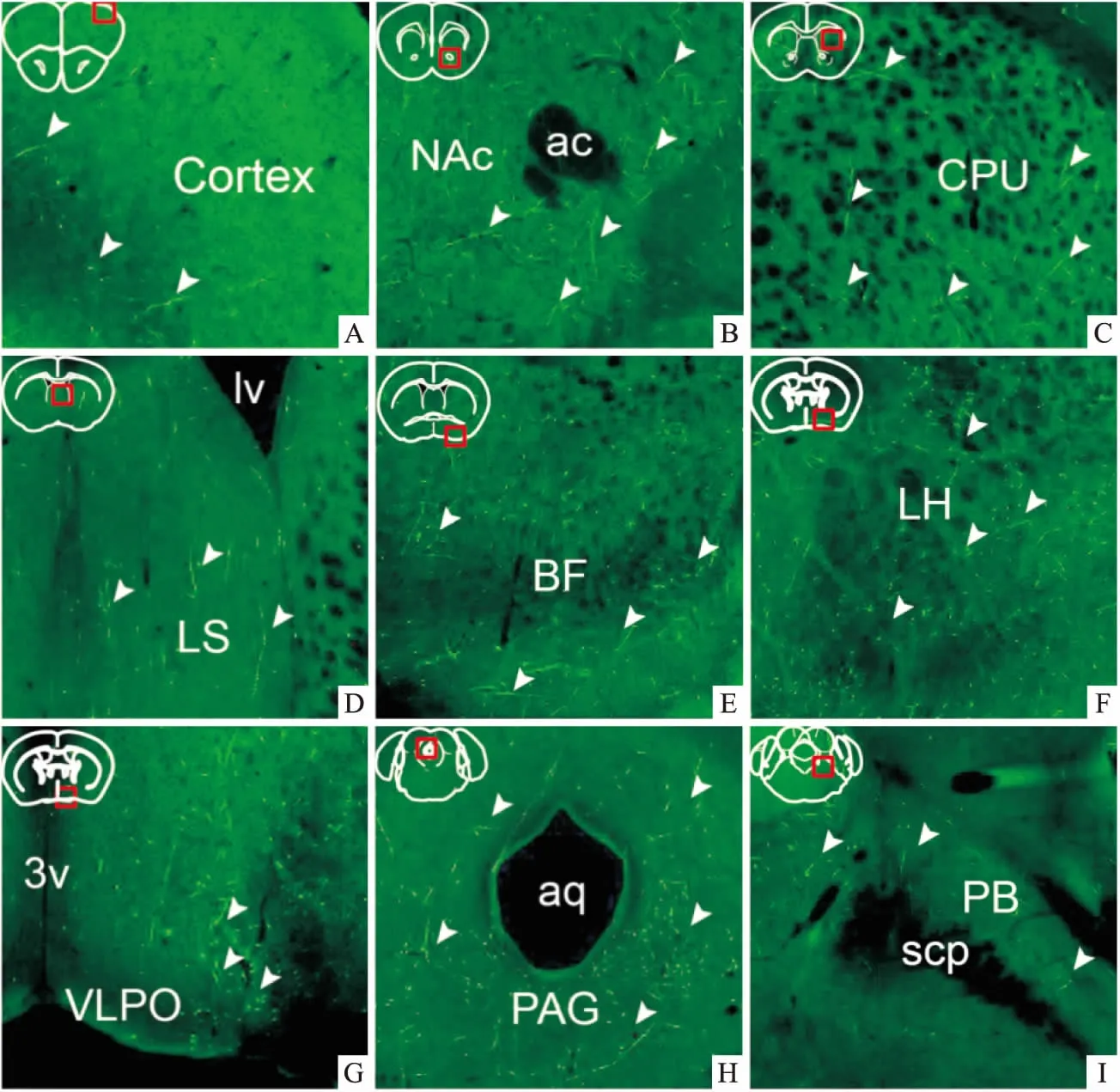
图2 TMN组胺能神经元向脑内睡眠-觉醒相关脑区的特异性神经投射 免疫荧光×100
A:Cortex大脑皮层;B:NAc伏隔核;C:CPU尾壳核;D:LS外侧隔核;E:BF基底前脑;F:LH外侧下丘脑;G:VLPO腹外侧视前区;H:PAG导水管周围灰质;I:PB臂旁核
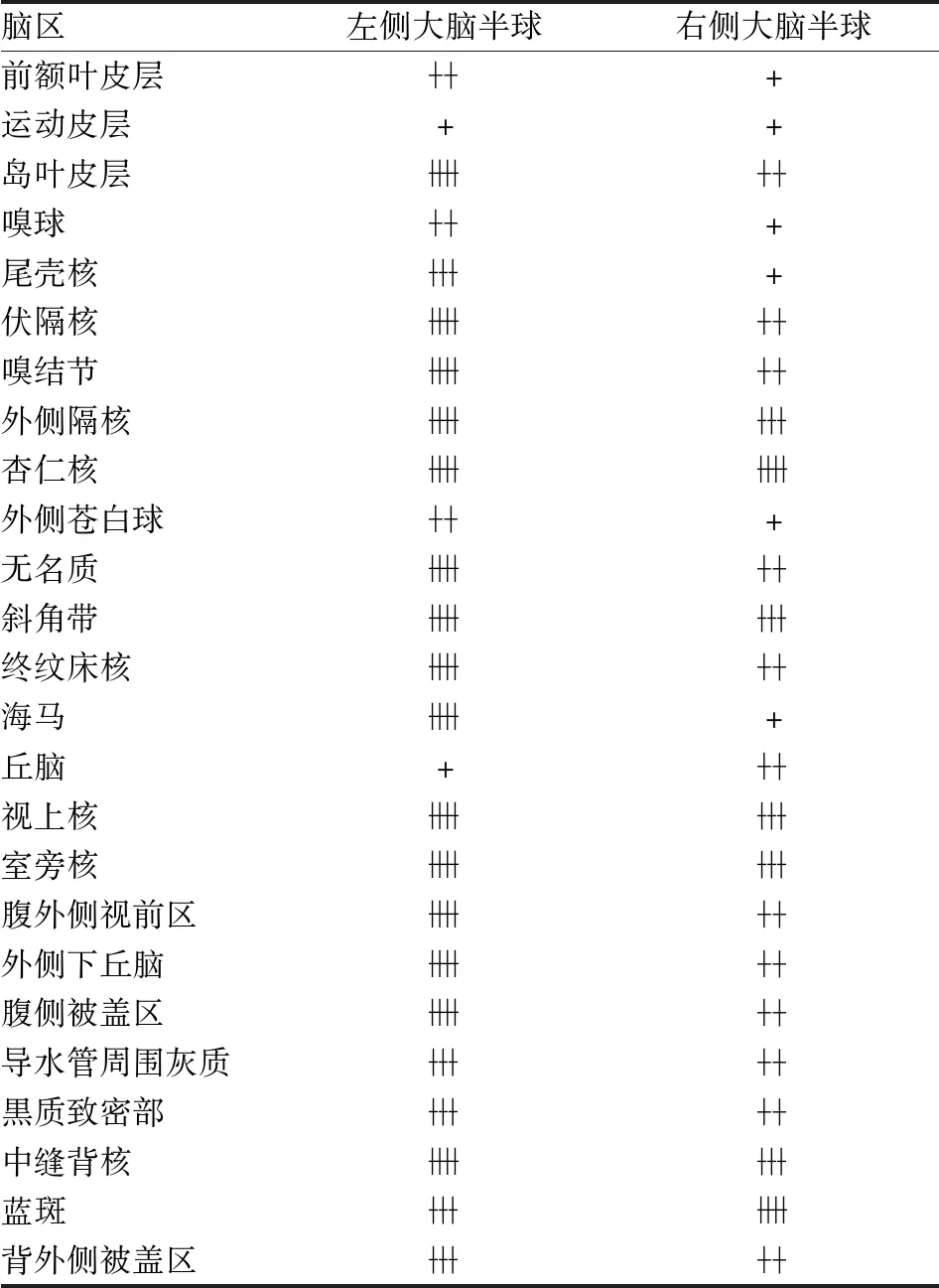
表1 TMN组胺能神经元hrGFP阳性神经末梢分布
3 讨论
中枢组胺能神经元全部位于结节乳头核,其神经纤维可广泛投射至脑内其他核团及脊髓。既往对结节乳头核神经元传出投射路径的研究主要来自传统的辣根过氧化物酶等神经解剖学示踪方法,但这类神经示踪方法缺乏特异性,无法解析某一特定类型神经元的传出或传入通路[4,6]。比如结节乳头核内除了含组胺能神经元外,还含有胞体较小的促甲状腺激素释放激素、甘丙肽、脑啡肽及P物质等多种不同神经元类型[7]。大量的传统神经示踪研究发现:结节乳头核神经元主要由两条上行通路和一条下行通路投射至全脑及部分脊髓。TMN神经投射的背侧上行通路主要沿第三脑室两侧上行,经内侧前脑束和到达前脑广泛区域。腹侧上行通路主要沿大脑基底部上行,投射至内侧隔区、嗅结节及嗅球等脑区。下行通路主要投射至脑干核团和小脑、脊髓等[3]。采用hrGFP特异性神经示踪技术显示TMN中枢组胺能神经元投射的范围与密度与传统示踪实验结果有差异,比如,传统示踪方法研究报道TMN组胺能神经元密集投射至内侧隔核,而hrGFP特异性示踪发现TMN组胺能神经元主要投射至外侧隔核。这可能与传统的示踪剂特异性差有关,投射至内侧隔核的神经元可能是TMN的非组胺能神经元,比如脑啡肽阳性神经元或P物质阳性神经元。因此,本研究特异性揭示了中枢组胺能神经投射特点,为进一步研究中枢组胺能神经的功能及功能环路具有重要的指导意义。
中枢组胺能神经元参与调节觉醒、生物节律、情绪、体温以及呼吸等多种神经功能。因此,阐明TMN组胺能神经元特异性投射环路将为研究其调节高级行为的功能环路提供坚实的解剖学基础。TMN组胺能神经元及小胶质细胞均参与调控睡眠-觉醒行为[8-9],随着觉醒时间前额叶皮层组胺含量升高[10],阻断组胺H1受体促进睡眠[11]。本研究显示TMN组胺能神经元特异性、密集投射至尾壳核、伏隔核、基底前脑、腹外侧视前区、导水管周围灰质等睡眠-觉醒相关神经核团,提示TMN组胺能神经元可能支配这些神经核团神经元活性调控睡眠-觉醒行为。借助hrGFP特异性神经示踪技术,Zhang et al[6]发现伏隔核腺苷A2A受体阳性神经元向腹侧苍白球、TMN、腹侧被盖区等神经核团均有解剖学投射,提示其可能调控这些核团的神经活性调节睡眠-觉醒行为。Oishi et al[12]进一步借助光遗传学、电生理学等研究手段发现伏隔核A2A受体阳性神经元通过调节腹侧苍白球神经元活性发挥其促睡眠作用。综上,本研究阐明了TMN组胺能神经元在中枢神经系统内的特异性投射环路,为揭示其神经功能环路提供了有力的理论基础和解剖学证据。阐明TMN组胺能神经元调控脑高级行为的功能环路,还需结合电生理学、光遗传学、组织学及行为学等多种研究手段。

