人脂肪干细胞对放射线损伤大鼠唾液腺的修复作用
李 辰,阳宏林,时 函
唾液在消化食物、润滑口腔、保持口腔内环境稳定以及抵抗各种有害物质和微生物中起着重要作用。根据国际流行病学研究机构统计,近年来我国头颈部肿瘤的发病率明显上升,年发病率达15.22/10万,约占全身恶性肿瘤的4.45%。放射治疗是头颈部肿瘤治疗的重要组成部分,放射野内唾液腺腺泡细胞(salivary gland acinar cells,SGACs)会遭受严重的不可逆性损伤,多数患者唾液腺实质组织几乎全部丧失[1]。因此,放疗会引起唾液腺(salivary gland ,SG)分泌功能低下,导致患者出现口干症、吞咽困难、味觉减退、龋齿、真菌感染、营养不良,睡眠障碍等一系列症状,严重影响生存质量[2]。该实验采用头颈部局部放射建立SG损伤的大鼠模型后,通过腺体内局部注射人脂肪干细胞(human adipose tissue-derived stem cells, hADSCs),初步研究其对放射线损伤的大鼠SG修复作用。
1 材料和方法
1.1 实验材料
1.1.1实验动物 清洁级SD大鼠60只,雄性,体质量为(280±20)g,由上海第二军医大学实验动物中心提供。
1.1.2试剂及仪器 本实验所使用的hADSCs由同济大学医学院刘小青教授实验室提供;戊巴比妥那(美国Sigma公司);毛果芸香碱注射液(天津金耀药业公司);间充质干细胞培养基(深圳Biowit公司);PBS缓冲液(美国Hyclone公司);HE染色试剂盒(上海碧云天生物技术公司);PE10管(上海元象医疗器械公司);4%多聚甲醛(北京Solarbio);2100 C/D医用电子直线加速器(美国Varian公司);CO2培养箱(日本Sanyo公司);倒置相差显微镜(日本Olympus公司);大鼠手术台、手术器械等。
1.2 实验方法60只SD大鼠分为3组,实验组、放射组(阳性对照组)和对照组(阴性对照组)。普通饲料喂养,清洁饮水,适应性饲养1周后开始试验。
1.2.1放射线损伤唾液腺的大鼠模型建立 所有大鼠腹腔麻醉,实验组和放射大鼠仰卧位固定于特制放射台上,仅将颌下腺区(上缘起自下颌下缘,下缘止于胸腔入口锁骨之上,两侧至皮缘)置于放射野中,其余部位进行防护。一次性给予18 Gy放射线照射(美国Varian2100 C/D医用电子直线加速器,能量为6 MV,剂量率为300 cGy/min。)。对照组只麻醉不用放射线照射。
1.2.2hADSCs培养和分化潜力鉴定 hADSCs在间充质干细胞培养基中扩增。通过成骨和成脂诱导分化实验鉴定hADSCs的多向分化潜能。成骨分化培养基:10 mmol/L β-甘油磷酸钠,0.15 mmol/L维生素C,10 nmol/L地塞米松;成脂分化培养基:5 μmol/L地塞米松,0.5 μmol/L异丁基甲基黄嘌呤和50 mmol/L吲哚美辛。当细胞生长至100%密度时,更换为分化培养基,之后每3 d换液1次,分化14~21 d。细胞经4%多聚甲醛溶液固定后,分别用茜素红,油红O染色检测成骨和成脂分化。
1.2.3干细胞移植 放射后第2天,将实验组和放射组大鼠腹腔麻醉,常规消毒后,切开颈部皮肤及皮下组织,暴露颌下腺,实验组腺体内注射P3代hADSCs PBS悬混液0.1 ml(密度为1×107/ml);放射组腺体内注射等体积PBS溶液。
1.2.4唾液收集 放射后第8周,将长度为1.5 cm的PE10管一端剪成约45°的斜面,插入麻醉后大鼠的口内颌下腺导管开口处。颈部皮下注射2%毛果芸香碱注射液刺激唾液分泌,剂量为每100 g体质量0.013 ml。将唾液收集在已称重的1.5 ml离心管内,收集时长10 min。假设唾液的密度是1.0 g/cm3,以其质量代表体积,计算唾液流率。
1.2.5切片标本制备 放射后第8周,收集唾液后颈部脱臼法处死大鼠,剖取颌下腺,立即置入4%多聚甲醛固定。24 h后进行石蜡包埋并切片(厚度5 μm)。采用苏木精-伊红(HE)染色法进行染色,中性树胶封片。
1.2.6细胞凋亡 石蜡切片0.1% Triton-100冰浴5 min后滴加50 μl的TUNEL反应混合液,在湿盒中37 ℃孵育60 min。PBS洗3次,每次5 min。加入50 μl转化剂POD,湿盒中37 ℃孵育30 min。PBS洗3次,加入50~100 μl DAB底物溶液,室温(10~25 ℃)孵育,在显微镜下观察到颜色变化时立刻用PBS冲洗后苏木精复染1 min,中性树胶封片。
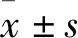
2 结果
2.1 唾液流率本实验中大鼠都能很好地耐受放射,并且存活于整个实验过程中。实验结果(图1)显示放射8周后,对照组大鼠唾液流率为(20.77±5.16)μl/min,放射组大鼠唾液腺流率为(11.23±10.10)μl/min,实验组大鼠唾液腺流率为(15.92±5.41)μl/min。放射组和实验组的唾液流率分别为对照组的54.07%和76.65%,经方差分析结果显示,三组之间唾液流率之间的差异具有统计学意义(F=8.64,P<0.05)。
图1 放射8周后颌下腺唾液流率与对照组比较:*P<0.05;与放射组比较:#P<0.05
2.2 hADSCs多向分化潜能鉴定体外培养的hADSCs为贴壁生长,排列有序。胞体呈梭形类似成纤维细胞,细胞核核居中(图2A)。hADSCs经成骨分化诱导后,细胞排列紧密、呈长梭形,茜素红染色阳性,镜下可见被染成红色的钙化结节 (图2B)。hADSCs经成脂诱导21 d后,多数细胞呈圆形,胞内脂滴密布,油红O染色呈阳性(图2C)。
2.3 组织学检测
2.3.1放射8周后SD大鼠颌下腺组织学改变 放射8周后SD大鼠颌下腺组织石蜡切片HE染色结果显示:对照组大鼠颌下腺腺体以浆液性腺泡细胞为主,同时可见少量黏液性腺泡细胞、纹管细胞、润管细胞、颗粒曲管细胞、血管内皮细胞。颗粒曲管细胞胞质内充满颗粒 (图3A)。放射组颌下腺镜下见广泛的细胞水肿,间质水肿。腺泡细胞胞质颗粒空泡成群分布,胞质均质红染;可见核固缩,核裂解等异常核型。部分腺泡细胞核消失,呈凝固性坏死。导管细胞扁平,管腔扩大、血管充血 (图3B)。实验组腺体内部分腺泡细胞胞质内存在颗粒空泡,细胞水肿, 血管充血 (图3C)。
2.3.2颌下腺腺上皮细胞凋亡 照射后8周TUNEL检测显示,对照组仅见个别凋亡细胞 (图4A)。放射组的颌下腺内凋亡细胞数量明显增多,细胞核深染呈黄褐色,累及腺泡细胞、导管细胞以及血管内皮细胞 (图4B)。接受hADSCs移植的实验组颌下腺腺泡水肿,与放射组相比凋亡细胞数量少(图4C)。

图2 hADSCs成骨和成脂诱导分化 ×400A:光镜下hADSCs;B:成骨诱导;C:成脂诱导
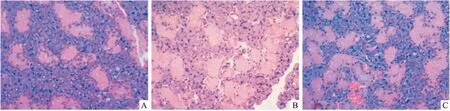
图3 放射8周后颌下腺切片HE染色 ×200A:对照组;B:放射组;C:实验组
图4 放射8周后颌下腺切片TUNEL染色 ×400A:对照组; B:放射组; C:实验组
3 讨论
放疗是头颈部肿瘤治疗的重要方法之一。目前临床头颈部肿瘤放射治疗时通常采用的放射剂量为50~70 Gy。本实验采取一次性给予18 Gy的照射量,是模拟口腔颌面部肿瘤治疗中常用的放射剂量60 Gy,根据放射治疗归一公式[3]推算而来的:D等效=d*N-0.65*X-0.11。研究认为当唾液流率下降35%左右时,即可认为唾液腺损伤基本确立了[4-5]。
多数学者认为SG细胞损伤的主要机制之一是由于放射线引起的细胞凋亡活性增强。HE染色在鉴定细胞凋亡上存在较大的困难,而末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法是近年发展起来的观察凋亡细胞的一种简便、灵敏、快捷的新方法。TUNEL法染色后凋亡细胞的细胞核核呈棕黄色,可以在显微镜下清晰的观察到。本实验通过颌下腺组织切片HE染色观察到了腺泡破坏(包括细胞水肿和坏死、核异型和消失等)、导管扩张、血管充血;并通过TUNEL染色检测到在放射组大鼠的颌下腺组织中浆液性腺泡中多数细胞出现局灶型凋亡。此外,凋亡细胞同时也广泛存在于导管中,特别是分泌管和排泄管。
头颈癌放疗后口干的患病率在74%~85%之间,即使在保留腮腺和调节放疗强度后,唾液分泌减少和口干症状也未见明显改善[6]。对于口干症,迄今尚无令人满意的治疗方法,临床上主要采用增加饮水等对症措施。近年来有学者研究使用胚胎干细胞治疗放射线损伤的SG功能,但由于组织相容性低和形成恶性畸胎瘤的可能使胚胎干细胞的应用非常有限。Kojima et al[7]利用大鼠SG的始祖细胞修复部分受损腺体的功能。然而,临床上大部分头颈部肿瘤患者多为老年人,腺体增龄性萎缩后往往难以分离培养出唾液腺始祖细胞。间充质干细胞(mesenchyaml stem cell, MSCs)的发现和研究为疾病治疗提供了新的途径。Sumita et al[8]采用骨髓间充质干细胞移植,修复了放疗损伤唾液腺的小鼠模型的部分唾液腺分泌功能。但因其取材困难,纯化率低且数量有限,存在免疫排斥等缺点,难以满足临床应用的要求。脂肪干细胞(adipose-derived stem cells,ADSCs)具有来源广泛、取材容易、免疫原性低、体外扩增稳定且衰亡率低等特点,适合大规模培养和移植[9]。此外,有研究显示脂肪组织中MSCs的密度高于骨髓[10]。由于具有以上特点,在组织工程和再生医学领域中ADSCs被广泛用于多种疾病的治疗研究。本实验在放射后的SD大鼠颌下腺移植hADSCs,8周后实验组唾液流率为放射组的1.42倍,显著提高了放射损伤的SG的分泌功能。组织学切片及HE染色结果显示放射组大鼠颌下腺出现广泛的细胞水肿,间质水肿,血管充血,以及细胞凝固性坏死;实验组大鼠颌下腺主要表现为细胞水肿和血管充血等可逆性损伤,损伤程度较放射组轻,进一步证实了ADSCs对于放射线导致的唾液腺损伤具有修复作用。Lim et al[11]的研究结果表明hADSCs具有转化为唾液腺上皮细胞的潜力,并能保护细胞免受辐射损伤,建议将hADSCs作为治疗辐照导致SG损伤的备选治疗方法。Choi et al[12]的研究结果也证明对于放射线照射后局部移植ADSCs可减少唾液腺的纤维化,改善SG组织辐射损伤后的组织重建,实现了唾液分泌功能恢复和唾液蛋白合成。
关于ADSCs能够促进放射损伤大鼠SG的分泌功能的机理,学者们也进行了研究。Wang et al[13]发现移植ADSCs能保存更多功能性腺泡细胞,增加唾液流率和淀粉酶的产生,减轻了唾液腺形态和功能的改变。通过共培养发现ADSCs能转化为唾液腺上皮细胞并分泌淀粉酶,PCR也证实a-AMY(a-amylase)基因的表达[13]。唾液腺腺上皮在细胞增殖周期中,G1期和S期之间及G2期和M期之间,都可能存在影响细胞周期进行的控制点,一旦细胞通过这些控制点,将不能阻止细胞进入S期或M期,药物或者其他制剂对细胞增殖的影响可能通过上述环节来实现。在本实验中,hADSCs可能是通过内环境的免疫调节,对细胞周期进行调控,进而恢复原有细胞的正常节律;或者是hADSCs进入颌下腺后通过细胞与微环境间的相互作用(cross-talk)诱导hADSCs表型发生转化,分化成具有分泌功能的涎腺上皮细胞,从而提高了唾液流率[14]。SGACs的组织再生还可能与ADSCs诱导的旁分泌刺激有关,如生长因子和趋化因子,可提供急性放射性保护[15]。众多实验表明局部直接注射ADSCs能增强组织再生活性,如血管形成和细胞增殖,凋亡活性下降,使SG功能得以改善。关于ADSCs介导的SG再生过程的机理还需要进一步的研究来阐明。

