淫羊藿苷对MC3T3-E1细胞增殖分化的影响及机制研究
安 庆,刘国雄,Bikash Kumar Sah,周 霖,庹 伟,曹 洪
淫羊藿苷(icariin,ICA)分子式:C33H40O15,分子量:676,是抗骨质疏松中药淫羊藿的有效成分之一[1]。研究[2]表明,ICA可促进骨形成、抑制骨吸收,提高骨密度及影响骨代谢指标,具有明显的抗骨质疏松作用。然而,对其作用机制及分子机制方面的研究仍不够全面[3],故ICA在预防骨质疏松方面仍需要更深入地研究。该实验以小鼠颅顶前成骨细胞亚克隆14(mouse embryo osteoblast precursor cells, MC3T3-E1 subclone 14)为细胞模型,研究ICA对其细胞形态、细胞增殖活性以及细胞碱性磷酸酶(acid phosphatase, ALP)活性的影响,同时研究骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)BMP-2/(small mothers agalnst decapentaplegic,Smad)Smads信号通路在其中的作用,为ICA治疗骨质疏松等骨代谢疾病提供分子依据。
1 材料与方法
1.1 细胞和试剂小鼠颅顶前成骨细胞亚克隆14(MC3T3-E1 subclone 14)细胞购自中国科学院上海细胞库;高糖DMEM培养基购自美国Gibco公司;胎牛血清(FBS)购自美国HyClone公司;BCA蛋白定量检测试剂盒购于上海碧云天生物科技公司;CCK-8试剂盒购于日本同仁化学研究所;ALP检测试剂盒购于南京建成生物工程研究所;头蛋白(noggin)购自美国R&D公司,目录号:1967-NG-025;兔多克隆抗体BMP-2(ab14933)、兔多克隆抗体骨形态发生蛋白2受体(bone morphogenic protein receptor-2, BMPR-2)(ab96826)、兔单克隆抗体Smad4(ab40759)均购自英国Abcam公司;兔多克隆抗体Smad1/5/8/9 (NB100-56443)购自美国Novus公司。ICA标准品购自中国药品生物制品北京检定所,目录号:T2855,纯度为99%(HPLC检验)。
1.2 方法
1.2.1淫羊藿苷储备液 取2 mg ICA加入2 ml DMSO中制成1 mg/ml的储备液保存于-20 ℃。根据实验要求,用细胞培养液稀释储备液制成含不同浓度ICA(0、10、20、40 ng/ml)的培养液备用。
1.2.2细胞培养 MC3T3-E1细胞完全培养液为含10% FBS的高糖DMEM,培养环境为37 ℃、5% CO2培养箱。根据实验要求,向各实验组中加入含不同浓度ICA(0、10、20、40 ng/ml)的培养液,每2 d换液1次。
1.2.3细胞苏木精-伊红(HE)染色 取第3代MC3T3-E1细胞接种于24孔板,用完全培养液培养24 h后更换含不同浓度ICA(0、10、20 、40 ng/ml)的培养液,分别培养48、72、96 h。HE染色法对MC3T3-E1细胞进行染色,并在倒置显微镜下观察细胞形态。
1.2.4检测细胞增殖活性 CCK-8法检测MC3T3-E1细胞的增殖活性。将第3代MC3T3-E1细胞接种于96孔板,细胞培养方法同HE染色部分。根据CCK-8操作说明向每孔中加入10 ul检测液,用酶联免疫检测仪于450 nm波长检测每孔细胞光密度值(optical density, OD)并计算出每组细胞相对增殖活性。
1.2.5检测细胞ALP活性 ALP检测试剂盒检测MC3T3-E1细胞ALP活性。取第3代MC3T3-E1细胞接种于6孔板,细胞培养方法同HE染色部分。根据试剂盒操作说明裂解并离心细胞后取上清液,用酶联免疫检测仪于405 nm波长检测上清液OD并计算出各组细胞ALP相对活性。
1.2.6Western blot 将MC3T3-E1培养的细胞接种于10 cm培养皿,细胞培养方法同HE染色部分:① 细胞经RIPA裂解后,离心取上清液;② 用BCA法检测上清液蛋白质浓度;③ 分别用5%的浓缩胶和12%分离胶分离蛋白质;④ 分别孵育一抗BMP-2(1 ∶1 000),BMPR-2(1 ∶1 000),Smad4 (1 ∶1 000),Smad1/5/8/9 (1 ∶200)和β-actin (1 ∶1 000)和二抗后显色。
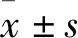
2 结果
2.1 ICA对MC3T3-E1细胞形态的影响倒置显微镜下见48、72h组细胞形态饱满,呈多角形或梭形,各ICA浓度间细胞形态无明显差异。见图1、2。
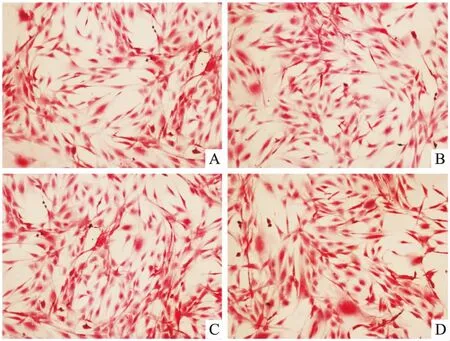
图1 ICA对MC3T3-E1细胞形态的影响(48 h) HE×100
A:0 ng/ml ICA;B:10 ng/ml ICA;C:20 ng/ml ICA;D:40 ng/ml ICA
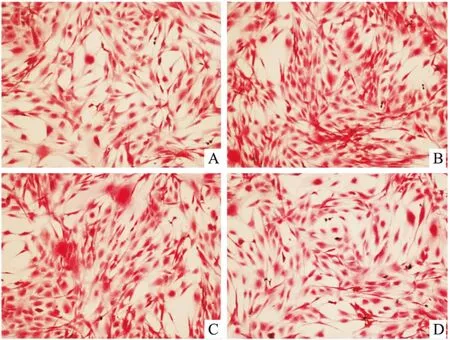
图2 ICA对MC3T3-E1细胞形态的影响(72 h) HE×100
A:0 ng/ml ICA;B:10 ng/ml ICA;C:20 ng/ml ICA;D:40 ng/ml ICA
96 h组镜下见细胞排列紧密,部分细胞伸出突起,胞质丰富,细胞核较清晰,各ICA浓度间细胞亦无明显差异。见图3。结果提示ICA对MC3T3-E1细胞形态无明显影响。
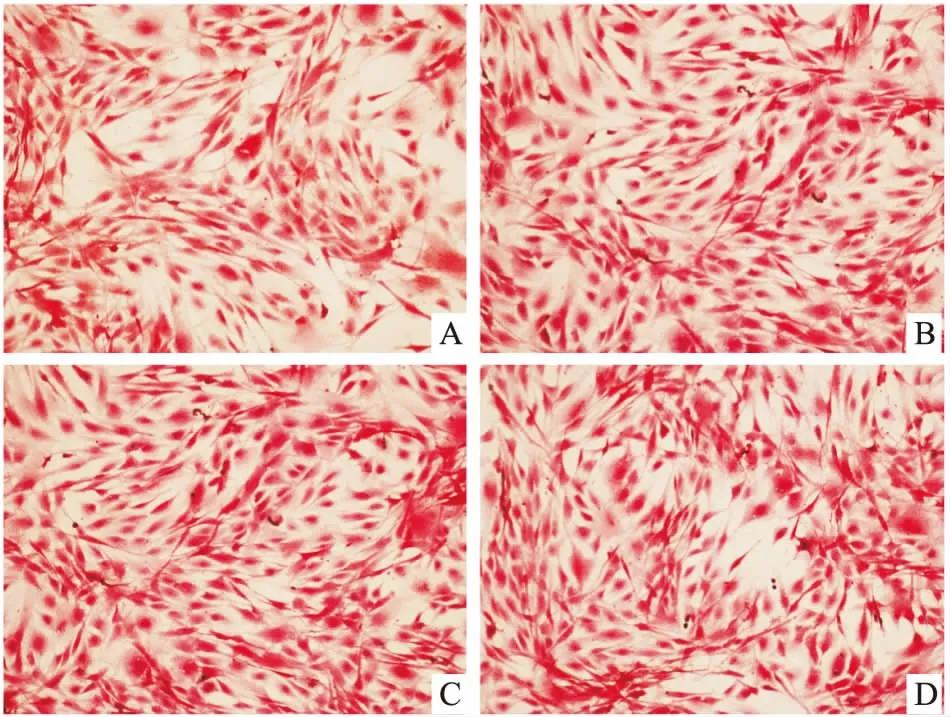
图3 ICA对MC3T3-E1细胞形态的影响(96 h) HE×100
A:0 ng/ml ICA;B:10 ng/ml ICA;C:20 ng/ml ICA;D:40 ng/ml ICA
2.2 ICA对MC3T3-E1细胞增殖活性的影响各组在培养48、72、96 h后,10、20 ng/ml ICA组细胞增殖活性较对照组(ICA,0 ng/ml )显著增强(P均< 0.01),其中20 ng/ml ICA组细胞活性更强,并且于96 h时细胞增殖活性达到最高,而40 ng/ml ICA组细胞活性与对照组比较差异无统计学意义,见图4A。向细胞中加入Noggin,观察ICA(20 ng/ml)与Noggin(100 ng/ml)共同培养MC3T3-E1细胞72 h后对细胞增殖活性的影响。结果显示各指标在各组间差异有统计学意义(F=102.7,P<0.01)。与ICA(20 ng/ml)组比较,ICA+ Noggin组细胞增殖活性明显受到抑制(P<0.01);与ICA(0 ng/ml)组相比差异无统计学意义,见图4B。
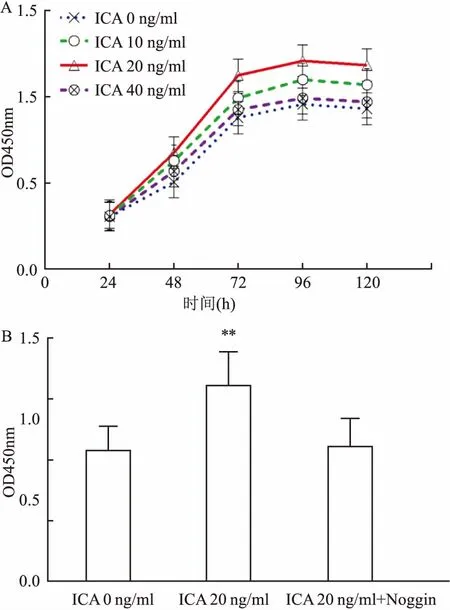
图4 ICA对MC3T3-E1细胞增殖活力的影响及阻断BMP/Smads信号通路后的变化
A: ICA对MC3T3-E1细胞增殖活力的影响;B: 阻断BMP/Smads信号通路后ICA对MC3T3-E1细胞增殖活性的影响;与0 ng/ml ICA组比较:**P< 0.01
2.3 ICA对MC3T3-E1细胞ALP活性的影响各组在培养48、72、96 h后,10和20 ng/ml ICA组细胞ALP活性较对照组显著增高(P均<0.01),40 ng/ml ICA组细胞ALP活性与对照组比较差异无统计学意义,见图5A。向细胞中加入Noggin,观察ICA(20 ng/ml)与Noggin(100 ng/ml)共同培养MC3T3-E1细胞72 h后对细胞ALP活性的影响。结果显示各指标在各组间差异有统计学意义(F=26.10,P<0.01)。与ICA(20 ng/ml)组比较,ICA+ Noggin组细胞ALP活性受到抑制(P<0.01);与ICA(0 ng/ml)组相比差异无统计学意义,见图5B。
2.4 ICA对MC3T3-E1细胞BMP-2、BMPR-2、Smad1/5/8和Smad4蛋白表达的影响Western blot分析,结果显示各指标在各组间差异有统计学意义(F=98.22、96.17、146.35、123.10,P<0.01)。各组在培养48、72、96 h后,10、20 ng/ml ICA组细胞BMP-2、BMPR-2、Smad1/5/8和Smad4蛋白表达水平较对照组均显著增加(P均<0.01),40 ng/mlICA组细胞上述蛋白表达水平少量增加,但与对照组相比差异无统计学意义,见图6。
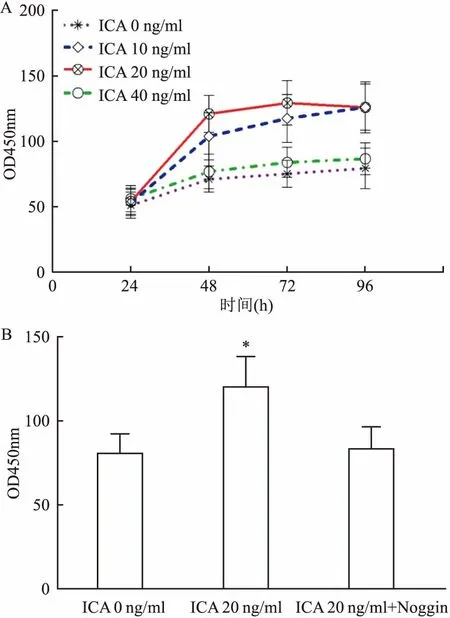
图5 ICA对MC3T3-E1细胞ALP活性的影响及阻断BMP/Smads信号通路后的变化
A: ICA对MC3T3-E1细胞ALP活性的影响;B: 阻断BMP/Smads信号通路后ICA对MC3T3-E1细胞ALP活性的影响;与0 ng/ml ICA组比较:*P<0.05
2.5 Noggin对ICA促MC3T3-E1细胞BMP-2、BMPR-2、 Smad1/5/8 和Smad4蛋白表达的影响向细胞中加入Noggin(100 ng/ml),观察不同浓度ICA与Noggin共同培养48、72、96 h后对细胞BMP-2、BMPR-2、Smad1/5/8和Smad4蛋白表达的影响。结果显示各指标在各组间差异无统计学意义(F=2.099、1.731、1.098、1.951,P>0.05)。加入Noggin后,细胞BMP-2、BMPR-2、Smad1/5/8和Smad4蛋白表达水平与对照组差异无显著性,ICA对MC3T3-E1细胞BMP-2、BMPR-2、Smad1/5/8 和Smad4蛋白表达的促进作用均受到抑制,见图7。
3 讨论
骨质疏松症是威胁中老年人健康的常见病和多发病。据统计,我国老年人骨质疏松症的发病率高达70%[4]。骨质疏松易导致患者骨折,进一步会导致残疾、终身丧失独立生活能力甚至死亡。同时,患者生活质量的降低,死亡率的升高,会给家庭和社会带来沉重的负担[5]。双磷酸盐是治疗骨质疏松的重要药物,但是最近的研究[6]却发现长期服用双膦酸盐并不一定能降低骨质疏松症患者骨折的风险。雌激素是治疗绝经后骨质疏松的有效药物,然而长期使用人工合成的雌激素可能会增加子宫内膜癌、乳腺癌及深静脉血栓疾患的风险[7]。因此,寻找一种更为安全有效的治疗骨质疏松的药物是防治的重要任务。
ICA具有较强的促进成骨细胞和骨髓间充质干细胞增殖、分化,发挥抗骨质疏松的能力[8]。Song et al[9]研究表明,ICA可通过上调MC3T3-E1细胞增殖细胞核抗原和细胞周期蛋白E基因的表达,促进细胞增殖并抑制其凋亡。本实验结果显示,ICA可促进MC3T3-E1细胞增殖,并且其作用具有浓度依赖性特点。
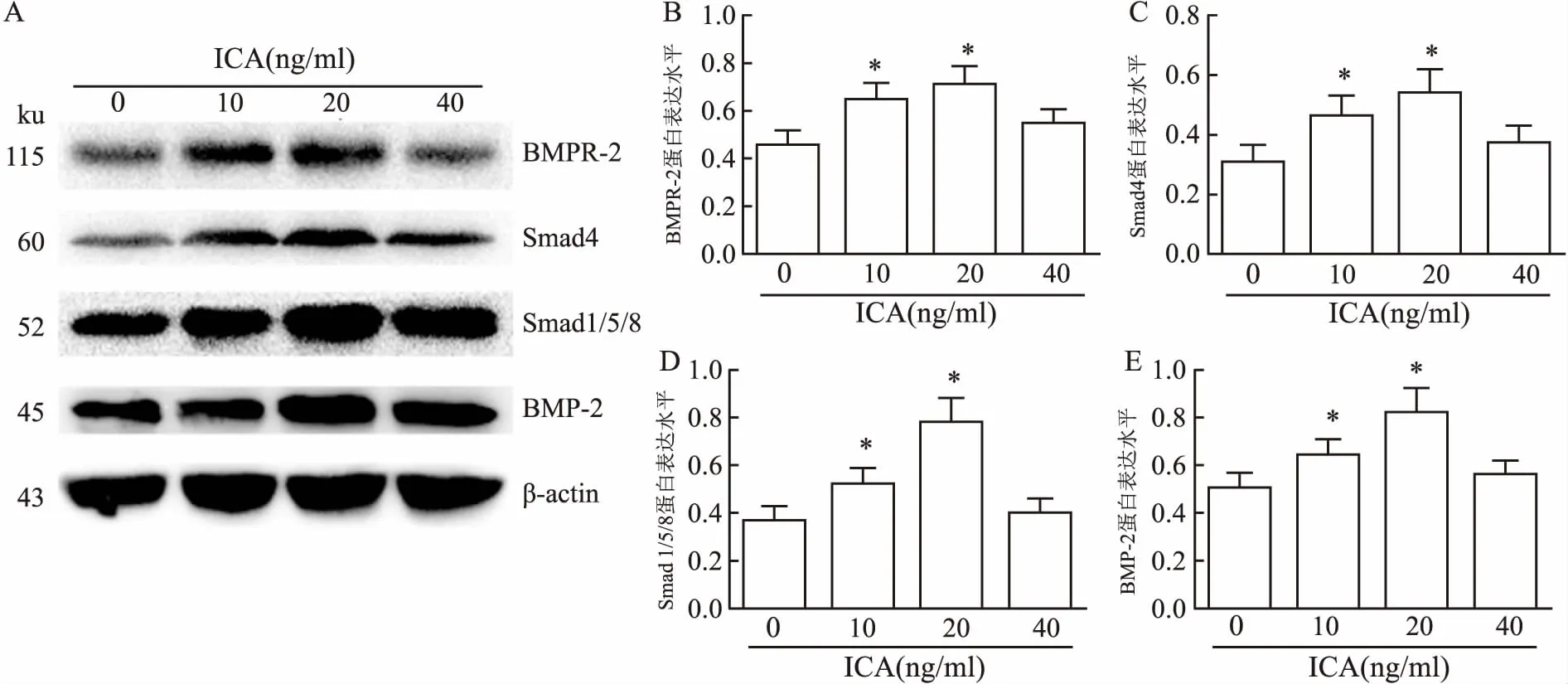
图6 ICA对MC3T3-E1细胞BMP-2、BMPR-2、Smad1/5/8 和 Smad4蛋白表达水平的影响
与0 ng/ml ICA组比较:*P<0.05
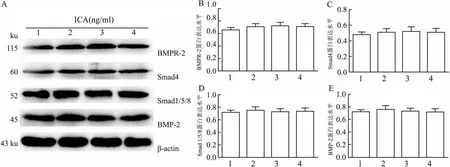
图7 Noggin对ICA诱导的BMP-2、BMPR-2、Smad1/5/8 和Smad4蛋白表达水平的影响 1:ICA 0 ng/ml+Noggin组;2:ICA 10 ng/ml+Noggin组;3:ICA 20 ng/ml+Noggin组;4:ICA 40 ng/ml+Noggin组
ALP是参与骨代谢的重要蛋白,亦是成骨细胞分化成熟的早期标志之一[10]。随着成骨细胞不断分化,ALP活性也逐渐增强,其活性大小可反映成骨细胞的分化水平。该实验结果显示,ICA具有显著的促进MC3T3-E1细胞分化作用,其作用亦具有浓度依赖性特点。
BMPs是转化生长因子-β(transforming growth factor-β, TGF-β) 家族成员之一,骨组织中含量丰富,在骨的诱导和形成方面发挥重要作用[11]。BMPs促分化作用主要通过增加细胞内ALP活性、骨钙素和胶原蛋白的合成及分泌而发挥作用。BMP-2被认为是TGF-β家族中活性最高且唯一能单独诱导成骨的因子,BMP-2的高表达可以促进成骨细胞的增殖分化[12]。SMADS 家族是TGF-β超家族的下游信号传导通路,Smad4作为SMADS的公共递质在SMAD家族成员中十分重要,是TGF-β家族成员在细胞内传导的必经之路。细胞外的BMPs与细胞膜上的 BMPR结合后导致受体激酶的激活,活化的受体会磷酸化细胞内的Smadl/5/8,其与Smad4形成复合物后进入到细胞核内,结合到DNA序列上,从而调节下游成骨相关基因的转录[13]。该实验结果显示,ICA可能通过上调MC3T3-E1细胞BMP-2蛋白的表达,激活BMP-2/Smads信号通路,启动下游成骨相关基因的表达,从而促进了MC3T3-E1细胞的增殖、分化。
Noggin是BMP的抑制剂,能够竞争性与BMPs受体结合,下调BMPs的活性。为了进一步研究BMP-2/Smads信号通路在MC3T3-E1细胞增殖、分化中的作用,向细胞中加入BMP抑制剂Noggin(100 ng/ml),再次观察上述指标的变化。结果显示,加入Noggin后,ICA对MC3T3-E1细胞增殖活性及ALP活性的促进作用均受到明显抑制。同时ICA对BMP-2/Smads信号通路中BMP-2、BMPR-2、Smad4和Smadl/5/8等相关蛋白表达的促进作用明显下降。以上结果显示,阻断BMP-2/Smads信号通路可抑制ICA对MC3T3-E1细胞增殖、分化的促进作用,表明该信号通路在MC3T3-E1细胞的增殖、分化中发挥重要作用。

