丹参酮ⅡA抑制HT22海马神经元发生铁死亡的机制研究
许 璐,汤其强
铁死亡是一种铁依赖的脂质过氧化(lipid peroxidation,LPO)导致的细胞死亡方式,这一死亡过程的标志为细胞内脂质活性氧增多、线粒体变小以及线粒体膜密度较大[1]。研究[2-5]证明铁死亡与各种疾病密切相关。脑组织由于具有丰富的多不饱和脂肪酸且抗氧化酶含量低等特点,极易产生自由基损伤神经细胞,因此神经系统与铁死亡关系非常密切。因此,需要寻找一种新药物来抑制铁死亡。
丹参酮ⅡA(tanshinone ⅡA, Tan ⅡA)来源于我国传统中药丹参,广泛应用于临床,主要用于治疗心脑血管疾病。体外研究[6-9]表明,Tan ⅡA具有抗自由基损害、抗炎抗凋亡、降低神经毒性、抗动脉硬化等作用。同时研究表明丹参酮ⅡA可以通过促进细胞中血红素氧合酶1(heme oxygenase-1,HO-1)的表达进而保护细胞[9-10],神经系统疾病中HO-1发挥抗氧化、抗炎、抗凋亡等作用从而保护神经细胞,相关研究[5]显示HO-1对肾脏近曲小管细胞发生铁死亡时具有保护作用,而在癌症细胞中HO-1可促进细胞发生铁死亡[11],但是它在神经细胞发生铁死亡时的作用尚未可知。该实验使用Erastin损伤HT22海马细胞为模型,探索Tan ⅡA抑制海马细胞发生铁死亡的机制研究。
1 材料与方法
1.1 材料Erastin、Tan ⅡA购自美国Selleck公司;锌原卟啉IX(zinc protoporphyrin IX, ZnPP IX)购自瑞士ENZO Life Science公司;DMEM培养液购自美国Hyclone公司;胎牛血清购自美国Lonsa公司;细胞计数试剂盒8(cell counter kit-8,CCK-8)和超氧化物阴离子荧光探针(dihydroethidium,DHE)购自上海碧云天生物技术研究所;BODIPYTM581/591 C11购自美国Thermo fisher公司;特异性Fe2+荧光探针(FeRhoNoxTM-1)购于武汉百博翌科技有限公司;烟酸已可碱(hoechst)购于美国Sigma公司;HO-1和铁蛋白(ferrtin)抗体购自美国abcam公司,半胱天冬酶-3(cleaved caspase-3)抗体购自美国Cell Signaling公司;小鼠HT22海马细胞由上海交通大学实验室所馈赠。
1.2 细胞培养HT22细胞于含5% CO2、37 ℃恒温箱中培养,生长在含10%血清的DMEM培养基中,当细胞密度约为70%~80%时可进行实验。
1.3 CCK-8实验在96孔板中种植HT22细胞,每孔中加入CCK-8溶液10 μl,培养箱内孵育3 h,酶标仪上读取450 nm处的吸光值。细胞存活率每组按照以下公式计算:细胞存活率%=(处理组-空白对照组/(对照组-空白对照)×100%。实验重复3次。
1.4 细胞形态学观察在24孔板中种植HT22细胞,当细胞密度长到约为60%~70%时,预处理药物2 h,再加入0.5 μmol/L Erastin作用8 h后,在倒置显微镜下观察相关细胞的形态,并拍照记录。实验重复3次。
1.5 细胞存活率检测在24孔板中种植HT22细胞,当细胞密度长到约为60%~70%时,预处理药物2 h,再加入0.5 μmol/L Erastin作用8 h后,分别加入5 μl Hoechst溶液和细胞一起在37 ℃孵育15 min左右,在荧光显微镜下随机照片记录,应用图形分析软件(Image J)计算出蓝色荧光的的细胞数量,并对每组数据进行统计分析。实验重复3次。
1.6 细胞内活性氧(reactive oxygen species, ROS)水平检测在24孔板中种植HT22细胞,当细胞密度长到约为60%~70%时,预处理药物2 h,再加入0.5 μmol/L Erastin作用8 h后,加入5 μmol/L Dihydroethidium溶液和细胞一起在37 ℃孵育30 min左右,在荧光显微镜下随机照片记录,应用图形分析软件(Image J)计算出红色荧光的细胞数量,并对每组数据进行统计分析。实验重复3次。
1.7 细胞内脂质过氧化水平检测在24孔板中种植HT22细胞,当细胞密度长到约为60%~70%时,预处理药物2 h,再加入0.5 μmol/L Erastin作用7 h后,加入1 μmol/L BODIPYTM581/591 C11溶液和细胞一起在37 ℃孵育1 h左右,在荧光显微镜下随机照片记录,应用图形分析软件(Image J)计算出绿色荧光的强度的平均值(平均荧光强度,其数值大小能间接反映LPO水平的高低),并对每组数据进行统计分析。实验重复3次。
1.8 细胞内活性铁含量的检测在24孔板中种植HT22细胞,当细胞密度长到约为60%~70%时,预处理药物2 h,再加入0.5 μmol/L Erastin作用7 h后,加入100 μl FeRhoNoxTM-1溶液和细胞一起在37 ℃孵育1 h左右,最后用Hank′s平衡盐溶液(Hank's balanced salt solution, HBSS)清洗细胞2次,在荧光显微镜下随机照片记录,应用图形分析软件(Image J)计算出红色荧光的强度的平均值,并对每组数据进行统计分析。实验重复3次。
1.9 细胞内铁蛋白含量检测在24孔板中种植HT22细胞,当细胞密度长到约为60%~70%时,预处理药物2 h,再加入0.5 μmol/L Erastin作用7 h后,将各组细胞用4%多聚甲醛后+冰甲醇固定后,PBS缓冲液洗3次,封闭1 h,分别滴加抗Ferritin抗体(浓度为1 ∶100),4 ℃下孵育过夜后使用PBS缓冲液洗3次;再用二抗于37 ℃下孵育30~60 min,PBS缓冲液洗3次;封片,在荧光显微镜下随机照片记录,应用图形分析软件(Image J)计算出荧光的强度的平均值,并对每组数据进行统计分析。实验重复3次。
1.10 Western blot检测HO-1和Cleaved Caspase-3蛋白表达HT22细胞在100 mm培养皿中生长至约60%~70%时,给予不同的处理后加入100 μl细胞裂解液作用10 min后,超声3次每次3 s,对上清液采用BCA法进行蛋白质定量,在加入1×SDS,沸水中煮5 min。等量蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)后,转移至PVDF膜上,经过5%牛奶封闭1 h后加入抗HO-1、Cleaved Caspase-3或β-actin抗体(浓度均为1 ∶1 000),室温 30 min,4 ℃过夜后加入二抗孵育1 h,ECL法使PVDF膜显色,曝光,使用Image J软件分析结果。实验重复3次。
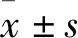
2 结果
2.1 Erastin诱导细胞发生铁死亡的模型建立及Tan ⅡA不同浓度的筛选为建立诱导的细胞发生铁死亡模型,本研究首先应用不同浓度的Erastin对HT22细胞作用不同的时间,结果显示0.5 μmol/L Erastin作用HT22细胞8 h后,细胞生长受到明显的抑制,同时与正常组比较,细胞存活率为(57±3.2)%,经单因素方差分析(F=214.236,P<0.01),细胞损伤严重。故选此浓度作为最佳造模浓度。见图1。HT22细胞中给予不同浓度的Tan ⅡA预处理2 h后加入0.5 μmol/L Erastin,结果显示0.1 μmol/L Tan ⅡA起到明显的保护作用,细胞存活率为(94.26±4.2)%与对照组比较存活率无明显变化(F=46.543,P>0.05),见图2。
2.2 倒置显微镜下观察和Hoechst染色确定Tan ⅡA对HT22细胞的保护作用0.5 μmol/L Erastin作用HT22细胞8 h后对细胞具有明显形态学改变,并出现部分死亡,加入0.1 μmol/L Tan ⅡA对细胞具有明显的保护作用(F=71.235),而加入0.1 μmol/L Tan ⅡA+10 μmol/L Znpp后对细胞的保护作用消失。ZnPP为经典的HO-1蛋白表达抑制剂。用Hoechst染色显示Erastin使大量HT22细胞发生凋亡,而Tan ⅡA对细胞具有很好的保护作用。见图3。
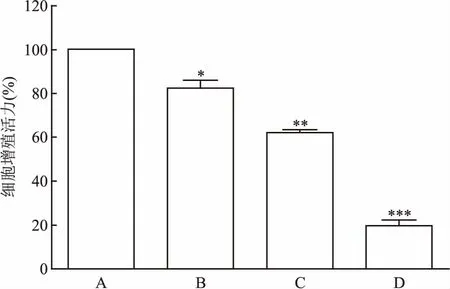
图1 CCK-8检测Erastin对HT22的细胞毒性
A:对照组;B:0.05 μmol/L Erastin处理组;C:0.5 μmol/L Erastin处理组;D:1 μmol/L Erastin处理组;与对照组(0 μmol/L)比较:*P<0.05,**P<0.01,***P<0.001
2.3 Tan ⅡA对Erastin损伤HT22细胞内ROS、LPO的影响利用DHE、BODIPYTM581/591 C11检测细胞内 ROS及LPO变化。实验结果显示,与对照组相比,Erastin组中细胞内ROS和LPO显著增高(F=172.412,P<0.001),表明Erastin促进HT22细胞内ROS和LPO生成;与对照组比较,Tan ⅡA组中细胞内ROS和LPO升高没有统计学意义(F=59.132,P>0.05),而Tan ⅡA+ZnPP组中细胞内ROS和LPO与对照组相比显著升高(P<0.001)。实验结果表明Erastin可以诱导HT22细胞内ROS和LPO水平升高,而Tan ⅡA可以抑制HT22细胞内ROS和LPO水平升高。通过加入HO-1抑制剂ZnPP,结果显示含有Tan ⅡA+ZnPP细胞内的ROS和LPO水平再次升高。因此推测Tan ⅡA可能通过诱导细胞内HO-1的表达,从而抑制细胞内ROS和LPO水平的升高。见图4。
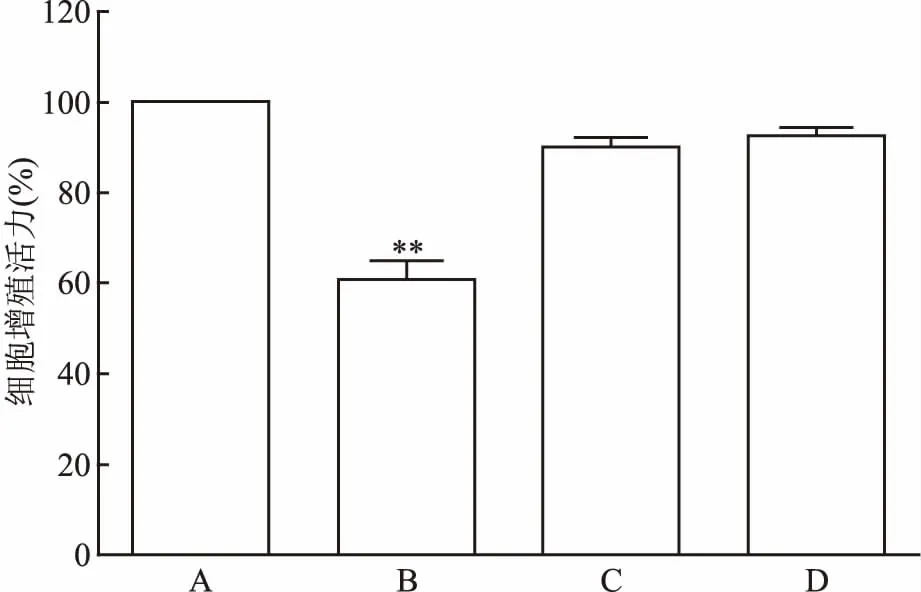
图2 CCK-8检测Tan ⅡA对HT22的细胞毒性
A:对照组; B:0.01 μmol/L Tan ⅡA预处理后加入Erastin 0.5 μmol/L;C:0.1 μmol/L Tan ⅡA预处理后加入Erastin 0.5 μmol/L;D:1 μmol/L Tan ⅡA预处理后加入Erastin 0.5 μmol/L;与对照组(0 μmol/L)比较:**P<0.01
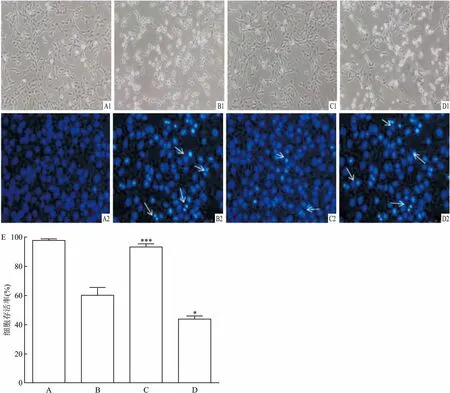
图3 倒置显微镜下观察各组细胞形态变化(×100)及Hoechst检测各组细胞的存活率
A:对照组;B:Erastin组;C:Tan ⅡA组;D:Tan ⅡA+ZnPP组;E:细胞存活率柱状图;与Erastin组比较:*P<0.05,***P<0.001
2.4 Tan ⅡA对Erastin损伤HT22细胞内活性铁及铁蛋白的影响为了确定细胞内活性铁的含量利用特异性Fe2+荧光探针(FeRhoNoxTM-1)进行检测,实验结果显示,与对照组相比Erastin组中细胞内活性铁显著增高(P<0.001),表明Erastin诱导HT22细胞内活性铁的生成;Tan ⅡA组中细胞内活性铁与对照组差异无统计学意义;Tan ⅡA+ZnPP组中与Erastin组相比细胞内活性铁降低,但与对照组比较差异有统计学意义(F=55.302,P<0.001),见图5,表明Tan ⅡA可以减少细胞内活性铁的含量。
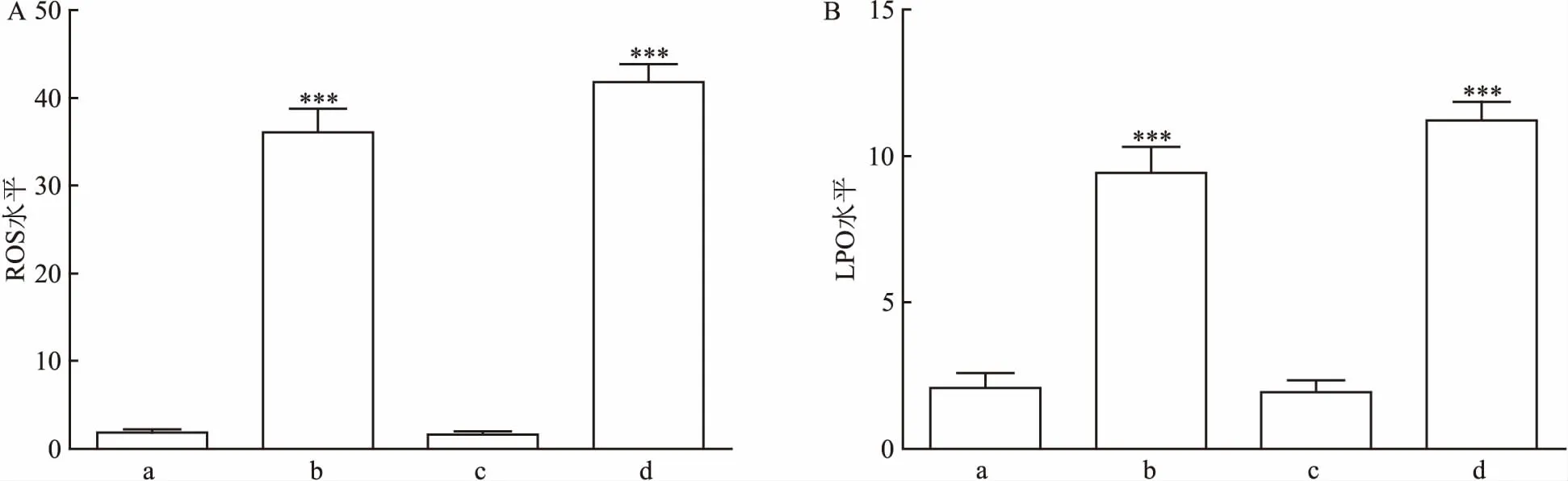
图4 DHE、BODIPYTM 581/591 C11检测细胞内ROS和LPO水平
A:细胞内ROS相对变化水平;B:细胞内LPO相对变化水平;a:对照组;b:Erastin组;c:Tan ⅡA组;d:Tan ⅡA+ZnPP组;与对照组比较:***P<0.001
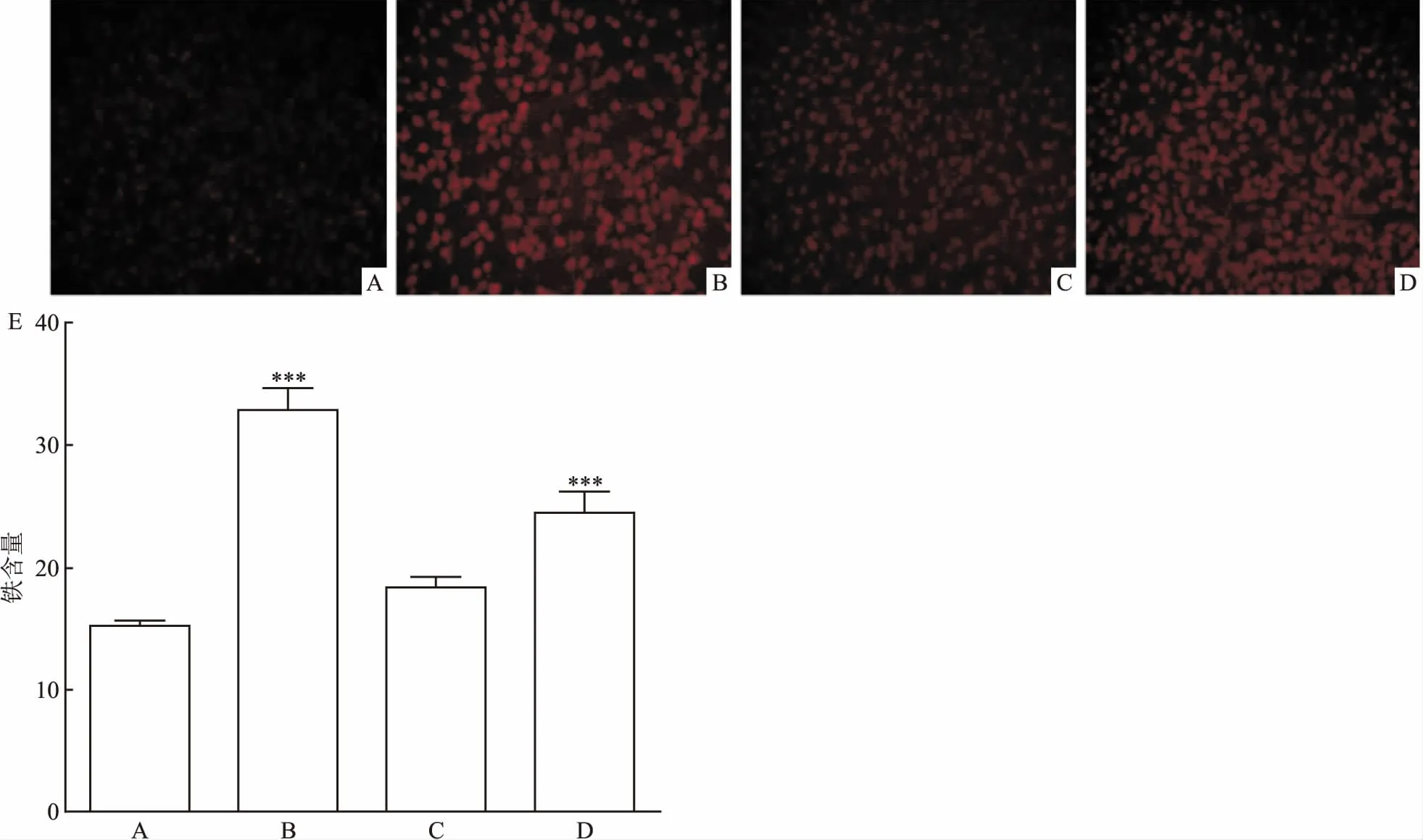
图5 FeRhoNoxTM-1探针检测细胞内活性铁的含量×100
A:对照组;B:Erastin组;C:Tan ⅡA组;D:Tan ⅡA+ZnPP组;E:细胞内活性铁含量相对变化水平;与对照组比较:***P<0.001
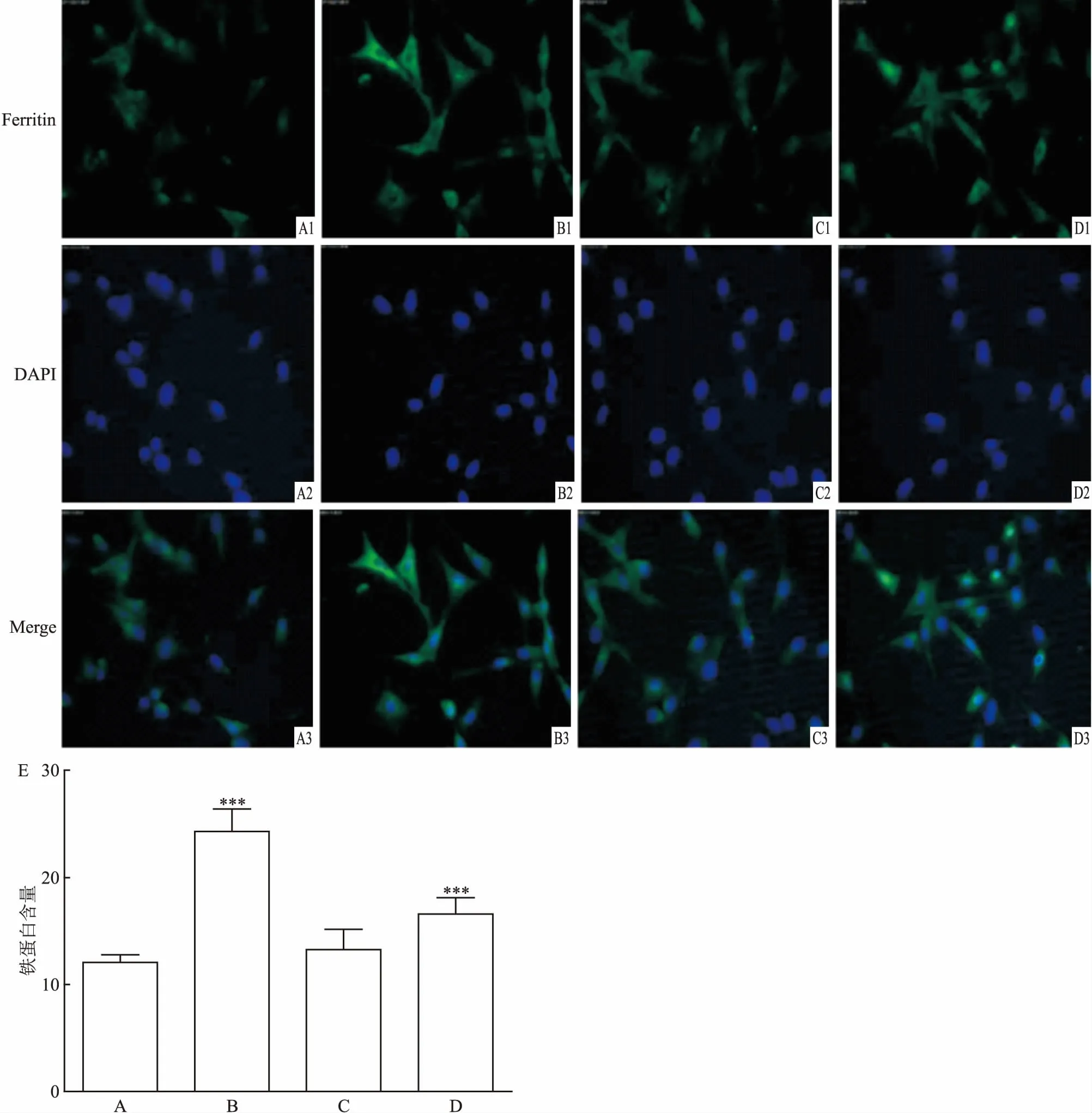
图6 荧光显微镜检测细胞内铁蛋白的表达免疫荧光×100
A:对照组;B:Erastin组;C:Tan ⅡA组;D:Tan ⅡA+ZnPP组;E:细胞内铁蛋白相对表达水平;1:细胞内铁蛋白荧光图;2:细胞核染色图;3:1和2的结合图;与对照组比较:***P<0.001
通过加入HO-1抑制剂ZnPP,发现含有Tan ⅡA+ZnPP的细胞内活性铁含量升高。进一步探究HT22细胞内铁蛋白的表达量,利用细胞免疫荧光进行检测。实验结果表明,与对照组比较,Erastin组中细胞内铁蛋白表达显著增高(P<0.001),表明Erastin诱导HT22细胞铁蛋白的生成;Tan ⅡA组中细胞内铁蛋白与对照组差异无统计学意义;Tan ⅡA+ZnPP组中细胞内铁蛋白的表达与Erastin组相比降低了,但与对照组比较F=12.365,P<0.001差异明显,见图6,表明Tan ⅡA能减少细胞内铁蛋白的表达。实验结果与活性铁的含量检测结果相同。说明Tan ⅡA能够降低细胞内活性铁的含量以及铁蛋白的表达,加入HO-1抑制剂能够抑制Tan ⅡA发挥作用,说明Tan ⅡA可能通过诱导HO-1高表达发挥作用。
2.5 Tan ⅡA对HT22细胞中HO-1和Cleaved Caspase-3蛋白表达的影响为了进一步研究Tan ⅡA对HT22细胞的保护机制,利用Western blot检测细胞中HO-1和Cleaved Caspase-3蛋白的表达。实验结果显示,与对照组比较,Erastin组的HO-1的蛋白表达增多(P>0.05), 而与Erastin组比较,Tan ⅡA组的HO-1的蛋白表达升高,Tan ⅡA+ZnPP组的HO-1的蛋白表达明显降低,表明Tan ⅡA能促使HT22细胞内HO-1蛋白的高表达。虽然Erastin组的HO-1蛋白表达量也增加,推测HO-1的表达是细胞抵抗死亡的自身反应。而Tan ⅡA能够诱导HO-1蛋白大量表达从而来抵抗细胞的死亡。为了验证Erastin所引起的细胞死亡是否由凋亡引起,检测了Cleaved Caspase-3蛋白表达,结果显示在各组细胞内Cleaved Caspase-3蛋白表达无明显差异,表明Erastin损伤引起的细胞死亡是一种不依赖于经典凋亡通路Caspase的细胞死亡。Tan ⅡA对HT22细胞的保护作用是通过高表达HO-1蛋白,从而抵抗细胞死亡。见图7。
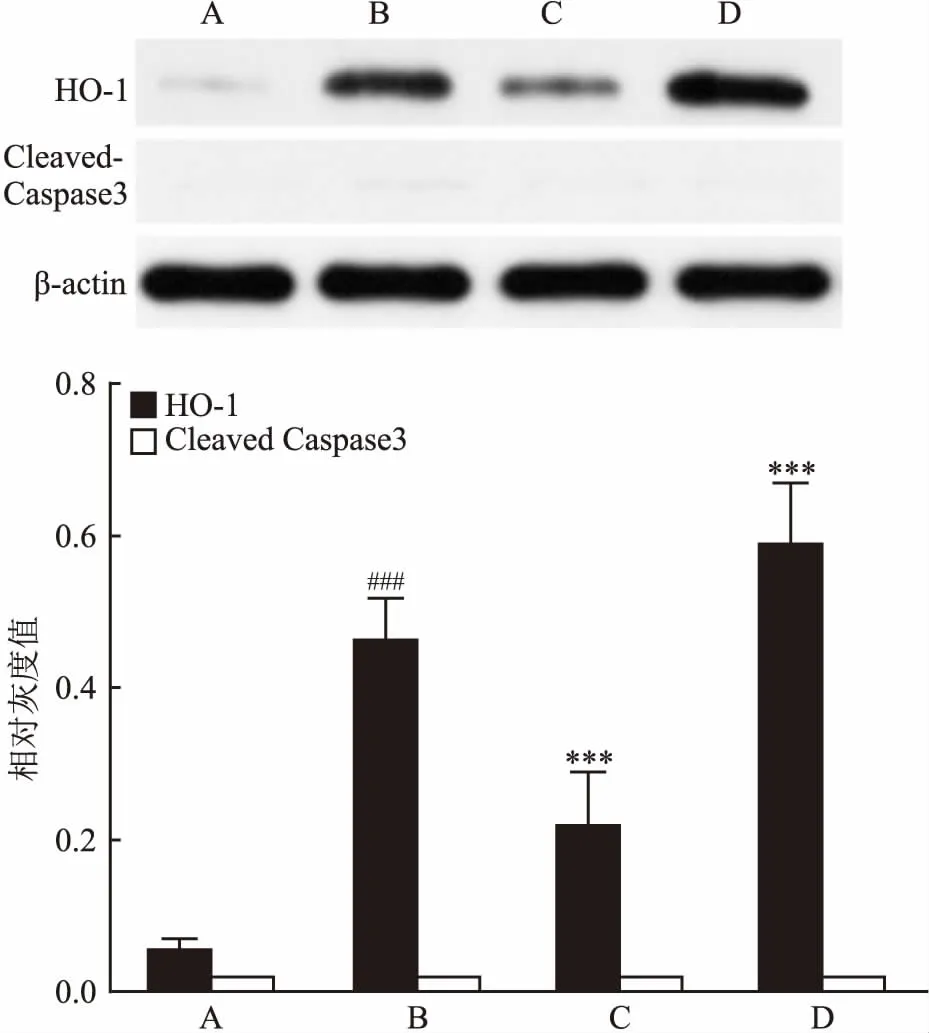
图7 各组细胞处理后HO-1和Cleaved Caspase-3的表达
A:对照组;B:Erastin组;C:Tan ⅡA+ZnPP组;D:Tan ⅡA组;与对照组比较:***P<0.001;与对照组比较:###P<0.001
3 讨论
铁死亡是Dixon et al[1]在2012年提出的一种新的非凋亡的细胞死亡方式。铁死亡发生时会导致细胞内铁依赖的脂质过氧化物蓄积进而促进细胞死亡。研究[3]证明铁死亡与神经系统疾病有着密切联系,但是铁死亡抑制剂很难通过血脑屏障,因此,探讨Tan ⅡA抑制铁死亡的损伤机制,对于治疗多种神经系统疾病具有重要的意义。
研究[12]表明HO-1可将血红素分解为铁、胆红素和一氧化碳,胆红素可有效保护细胞膜、抵抗脂质过氧化,从而保护机体免受氧化应激损伤。而很多体外模型证实在HO-1被诱导而活性增高的同时,铁蛋白的水平也同时升高,与HO-1相关的铁蛋白表达量与细胞的抗损伤能力呈平行关系。考虑到HO-1将血红素分解而产生的生物分子与铁死亡的发生可能相关,同时相关研究证实HO-1在肾脏近曲小管细胞发生铁死亡时具有保护作用[5],因此推测HO-1表达可能抑制神经细胞发生铁死亡。
Tan ⅡA具有抗自由基损害、抗炎抗凋亡、降低兴奋性氨基酸的神经毒性、降低血脂、抗动脉硬化等作用[6-9]。研究[9-10]表明Tan ⅡA还可以通过促进HO-1表达进而发挥抗氧化、抗炎、抗凋亡等作用,进而保护细胞免受损伤。因此Tan ⅡA可能通过上调HO-1表达,减少细胞内铁和脂质过氧化物含量,减轻铁死亡,从而对神经细胞起到保护作用。
本研究应用小鼠HT22海马神经元建立铁死亡损伤模型探讨Tan ⅡA抑制HT22细胞发生铁死亡的作用机制。Erastin是一种铁死亡的诱导剂,作用于离体细胞能诱导出铁死亡的各种损伤,包括细胞内ROS生成增多、LPO及活性铁含量增多等。在本研究中,首先利用CCK-8确立了铁死亡损伤模型中Erastin诱导剂使用的浓度和Tan ⅡA对细胞的有效保护浓度;根据细胞存活率结果确定应用0.5 μmol/L Erastin作用HT22细胞建立铁死亡损伤模型,并用0.1 μmol/L Tan ⅡA抑制HT22细胞发生铁死亡,研究观察到,Eratin可诱导细胞发生损伤,并且显示细胞内活性氧、脂质活性氧及活性铁含量都明显增加而加入Tan ⅡA后细胞存活率升高,细胞内活性氧、脂质活性氧、活性铁及铁蛋白都受到了抑制。为了验证Tan ⅡA能促进细胞内HO-1的表达,利用HO-1抑制剂ZnPP作为通路抑制剂,研究结果显示细胞存活率降低,细胞内ROS、脂质活性氧、活性铁及铁蛋白都升高了。说明ZnPP抑制了Tan ⅡA对细胞的保护作用。为了进一步解释推测,利用Werstern blot检测HO-1和Cleaved Caspase-3蛋白表达,该实验结果显示Erastin损伤引起的细胞死亡是一种不依赖于Caspase的细胞死亡,同时证实了Tan ⅡA对HT22细胞的保护作用,是通过提高HO-1表达。这对于Tan ⅡA对神经系统疾病的治疗研究具有重要意义。

