响应面法优化荞麦胰蛋白酶抑制剂固定化条件
李霞,栗安之,李晨
山西大学 生命科学学院,山西 太原 030006
胰蛋白酶抑制剂,又名抑肽酶,能抑制胰蛋白酶及糜蛋白酶,阻止胰脏中其他活性蛋白酶原的激活及胰蛋白酶原的自身激活。临床上胰蛋白酶抑制剂可用于预防和治疗急性胰腺炎、纤维蛋白溶解引起的出血及弥漫性血管内凝血,还可用于抗休克治疗,腹腔手术后注入腹腔可预防肠粘连。最近的研究表明,胰蛋白酶抑制剂还能够抑制肿瘤细胞的增殖、迁移,并促进肿瘤细胞的凋亡,其在抗肿瘤方面的效应受到广泛关注[1]。
荞麦药食同源,含有丰富的活性物质,如维生素、膳食纤维、微量元素、多种氨基酸等,是惟一含有黄酮类化合物的粮食作物,具有降压、降糖、降血脂功能,是“三高”患者的理想食物[2]。课题组之前从荞麦中提取出一种耐热的胰蛋白酶抑制剂(buckwheat trypsin inhibitor,BTI),通过基因工程手段获得了重组BTI,并对其性质进行了详尽研究[3-4]。BTI由69个氨基酸残基组成,相对分子质量为7900,具有很好的酸碱稳定性及很高的耐热性,100℃处理60 min后对胰蛋白酶的抑制作用仍可保留80%以上[5]。目前,已实现了BTI的大规模制备,如用100 L发酵罐发酵培养菌液,100 mL离子交换柱层析及超滤纯化制备高纯度的BTI[6]。在此基础上,对BTI的应用研究显得尤为迫切。BTI是胰蛋白酶的抑制剂,与胰蛋白酶有特异亲和力,可以利用这种特异亲和性分离纯化胰蛋白酶,如将BTI固定化后,制成亲和填料,由于这种高度的特异性,有望实现一步层析得到高纯度的目的蛋白酶。
目前,固定化技术发展迅猛,广泛应用于食品工业[7-8]、环境工程[9]、生物传感器[10]、染料降解[11]等领域。固定化后的酶与游离状态相比,具有热稳定性提高、能反复使用、保存稳定性好、抵抗性强、不易水解,以及对变性剂的耐受性好等特点[12]。用于蛋白质固定化的方法很多,固定化的载体有海藻酸钠、壳聚糖、纤维素、树脂等,其中海藻酸钠-聚乙烯醇载体由于安全性高、凝胶易成型、硬度适中等多种优点受到学者的广泛关注[13]。
在此,我们以海藻酸钠-聚乙烯醇为载体,研究了CaCl2浓度、载体与BTI体积比和固定化时间等3个单因素对固定化后BTI抑制率的影响,依据单因素实验结果进行响应面设计,优化BTI最佳固定化条件,以期BTI得到更广泛的应用。
1 材料与方法
1.1 材料
海藻酸钠、聚乙烯醇、无水氯化钙均购于天津市风船化学试剂科技有限公司;胰蛋白酶(1∶250)购于生工生物工程(上海)股份有限公司;苯甲酰-DL-精氨酰-对硝基苯氨(BApNA)是Sigma公司产品;其余试剂为分析纯。
TU-1810紫外-可见分光光度计(北京普析通用仪器有限责任公司);恒温水浴锅(北京市长风仪器仪表公司);JY92-IIN超声破碎机(宁波新芝生物科技股份有限公司);精密pH计[梅特勒-托利多仪器(上海)有限公司];精密电子天平[奥豪斯仪器(上海)有限公司]。
1.2 BTI的制备
在5 mL LB液体培养基(含50 μg/mL卡那霉素)中加入15 μL大肠杆菌pExSec I-BTI工程菌,37℃、180 r/min恒温振荡培养过夜;转接2 mL菌液至100 mL LB液体培养基(含50 μg/mL卡那霉素)中,37℃、180 r/min振荡培养6 h至对数生长期;加入诱导剂IPTG至终浓度为0.4 mmol/L,继续培养4 h诱导蛋白表达;8000 r/min离心8 min 收集菌体,用 20 mmol/L Tris-HCl(pH7.5)缓冲液将菌体重悬,冰浴超声破碎,直到悬浮液透光;破碎的菌液于80℃加热30 min,12 000 r/min离心15 min,收集上清保存备用。
1.3 BTI抑制活性测定方法
按文献[14]方法,在2.5 mL活性测定体系[0.1 mol/L Tris-HCl(pH8.0),含 0.01 mol/L CaCl2]中加入0.5 mL胰蛋白酶(20 mg/mL)和100 μL BTI,37℃预热 5 min,加入 17 μL底物 BApNA(0.15 mol/L,溶剂为DMSO),持续保温10 min,加入0.5 mL 33%的醋酸溶液终止反应,在410 nm下测定反应体系中产物对硝基苯胺(PNA)的吸光度对照组以100 μL测活缓冲液代替抑制剂样品溶液,计算抑制率。
1.4 BTI的固定化
以0.2%聚乙烯醇-3%海藻酸钠溶液为固定BTI的载体[13]。将载体溶液与BTI溶液混合,用15号注射器将混合溶液均匀滴到CaCl2溶液中,在4℃进行固定,得到球状的固定化BTI。固定后,用蒸馏水洗涤3次,称取1.00 g固定化BTI,按1.3的方法测定计算抑制率。
1.5 不同单因素对固定化BTI的影响
1.5.1 CaCl2浓度对固定化BTI的影响 配制1%、3%、5%、7%、9%的CaCl2溶液,将载体与BTI溶液按体积比为2∶1混合均匀,于4℃固定30 min,过滤,用蒸馏水洗涤3次,称取1.00 g固定化抑制剂,按1.3的方法测定D410nm值,计算抑制率。
1.5.2 载体与BTI体积比对固定化BTI的影响将载体与 BTI溶液分别按体积比为 1∶1、2∶1、3∶1、4∶1、5∶1混合,用15号注射器滴到5%CaCl2溶液中,4℃固定30 min后过滤洗涤,称取1.00 g固定化BTI,按1.3的方法测定D410nm值,计算抑制率。
1.5.3 时间对固定化BTI的影响 将载体与BTI溶液按体积比为2∶1混合,用15号注射器滴到5%CaCl2溶液中,4℃分别固定 10、20、30、40、50 min,过滤,蒸馏水洗涤3次,称取1.00 g固定化的BTI,按1.3的方法测定D410nm值,计算抑制率。
1.6 BTI固定化的响应面实验设计
根据单因素实验结果,研究CaCl2浓度、载体与BTI体积比和固定化时间3个单因素对抑制率的影响。选择CaCl2浓度为3%、5%和7%,载体与抑制剂溶液体积比为1∶1、2∶1、3∶1,固定化时间为20、30、40 min,以抑制率为指标进行响应面设计(表1),优化BTI固定化条件。
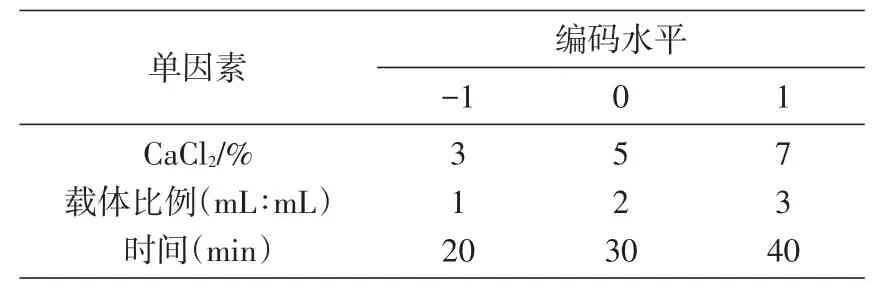
表1 BTI的响应面试验设计表
1.7 数据处理
数据处理采用Microsoft Excel 2017软件,实验做图使用Origin 9.0软件,响应面制图及数据分析用Design Expert 8.0.6软件。
2 结果
2.1 不同单因素对固定BTI抑制率的影响
2.1.1 CaCl2浓度对固定化BTI抑制率的影响 实验结果如图1,当CaCl2浓度小于5%时,随着浓度升高,微球抑制活性明显增强;而当CaCl2浓度大于5%时,其抑制活性逐渐降低;当CaCl2浓度为5%时,固定化BTI抑制活性最高。其原因可能是Ca2+浓度与形成凝胶孔径有关,当Ca2+浓度过高时会使凝胶球的交联太过紧密,影响BTI与胰蛋白酶的结合,降低其抑制作用。因此,选择CaCl2浓度为5%。
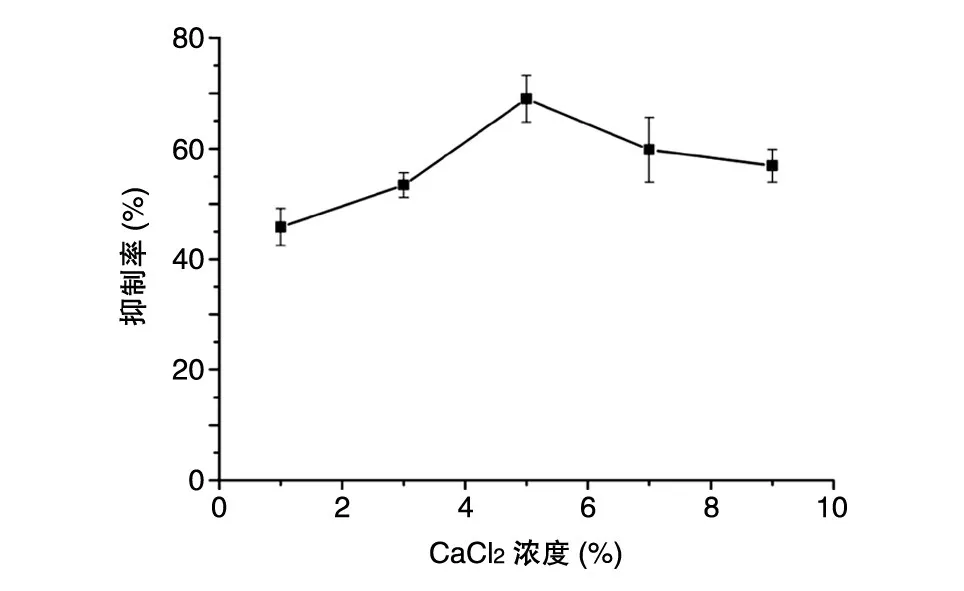
图1 CaCl2浓度对固定化BTI抑制率的影响
2.1.2 载体与BTI体积比对固定化抑制剂的影响 如图2所示,载体比例对固定化BTI抑制活性有明显影响。当载体与BTI溶液体积比为2∶1时,其抑制活性最高;但当二者比例小于2∶1或大于2∶1时,抑制活性会降低。其原因可能是载体与BTI比例较低时,载体含量相对不足,导致对BTI包埋不充分;而当二者比例大于2∶1时,载体含量过多,导致固定化过程中Ca2+和Na+置换时间延长[13],从而影响固定化BTI的量。因此,选择载体与BTI的体积比为2∶1。

图2 载体与抑制剂体积比对固定化BTI抑制率的影响
2.1.3 固定化时间对固定化BTI抑制率的影响如图3所示,随着固定化时间的延长,BTI抑制活性呈先升高后降低并趋于稳定的趋势,固定化时间为30 min时抑制活性达到最高,抑制率为74.9%。其原因可能是当固定化时间太短时,Ca2+孔径较大,抑制剂容易流失;随着固定化时间的延长,海藻酸钠凝胶空间结构更加紧密,BTI的扩散阻力会增大,所以抑制活性会降低[15]。因此,选择BTI的固定化时间为30 min。
2.2 响应面试验结果及分析
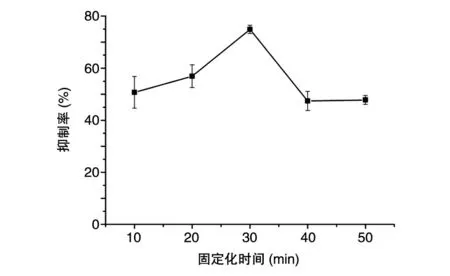
图3 固定化时间对固定化BTI抑制率的影响
2.2.1 响应面分析 响应面法被广泛应用于确定多因素实验的最佳条件,采用数理统计学方法计算出最为合理的实验设计,得到不同因素之间以及因素和水平之间的相互关系,相比正交试验具有精度高、试验周期短等特点[16]。
通过响应面方法对CaCl2浓度)、载体与BTI体积比、固定化时间进行三因素三水平优化,试验结果见表2。
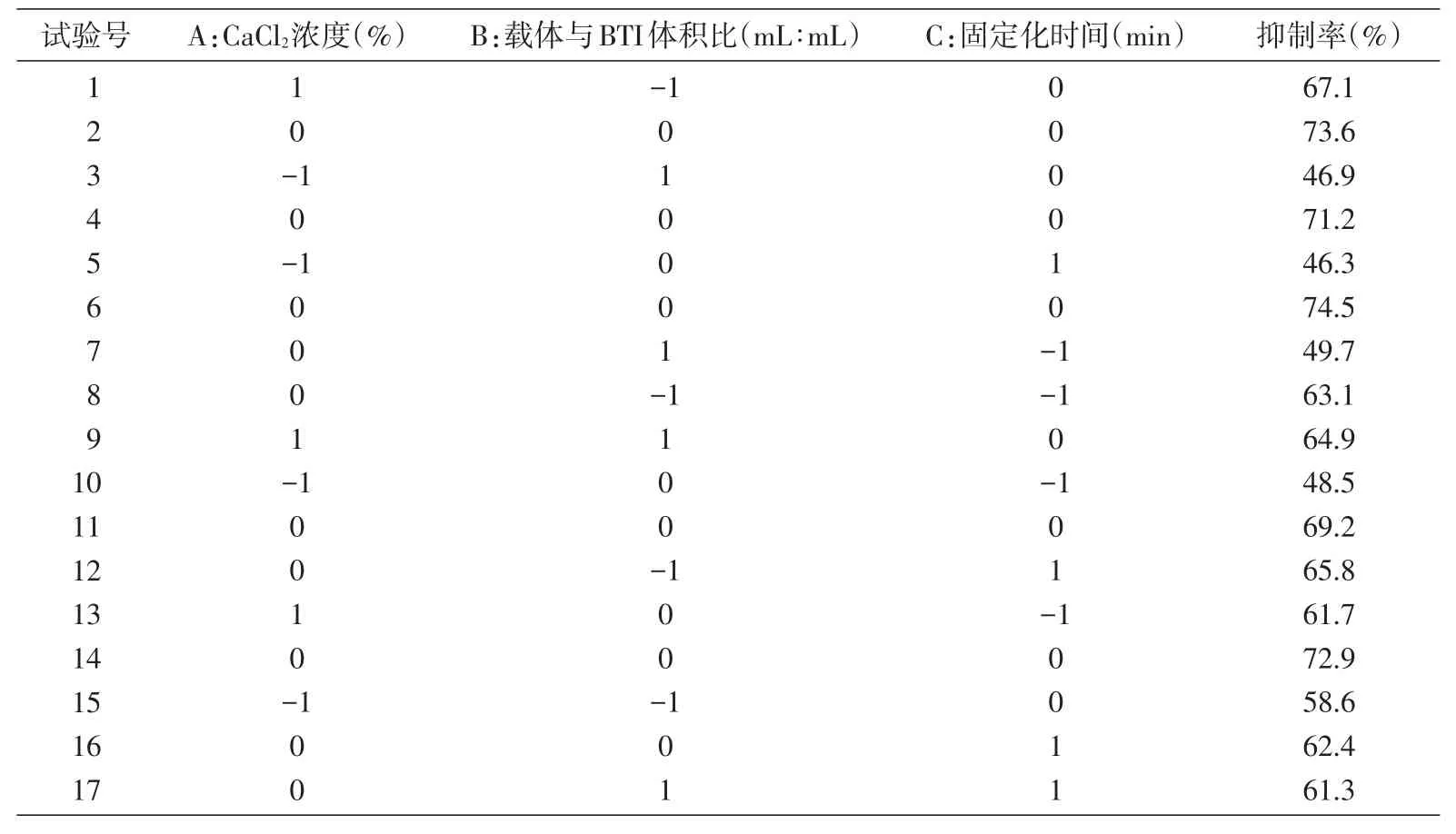
表2 响应面分析实验结果
2.2.2 回归模型建立及参数分析 以CaCl2浓度(A)、载体与抑制剂BTI体积比(B)、固定化时间(C)为单因素,抑制率为相应指标,建立回归模型,方差分析结果见表3。回归方程为y=72.28+6.98A-3.97B+1.60C+2.37AB+0.72AC+2.23BC-9.08A2-3.83B2-3.48C2。
表3为回归分析结果,此模型的P<0.01,说明回归模型显著,方程因变量与所有自变量之间的线性关系良好,实验方法可行。失拟项P(0.1906)>0.05,说明差异性不显著。模型回归系数表明该模型拟合程度较好,误差较小,可以用此模型对固定化BTI的抑制率进行分析检测[17]。由表3可知,模型的A、B、A2、B2、C2均可达到显著水平。由F值可以判断各因素对固定化条件影响的强弱,依次为CaCl2浓度>载体与抑制剂体积比>固定化时间。
2.2.3 固定化条件的响应面分析 CaCl2浓度、载体与BTI体积比和固定化时间之间的交互影响见图4~6,从曲面的陡势和等高线的形状可以直观了解各因素间的相互作用对固定化结果的影响。可以看到,这3组交互影响作用的曲面中心顶点都接近于零,说明响应面优化得到的最佳固定化条件在3个因素的零水平左右[14]。
由图4可知,当固定化时间为30 min时,随着载体与BTI比例的增加,固定化BTI的抑制率呈先升高后降低的趋势;随着CaCl2浓度的增加,抑制率也呈先升高后降低的趋势。在CaCl2浓度的变化范围处于4.5%~7.0%、载体与抑制剂比例范围处于1∶1~2.5∶1时,抑制率达到最高点。
由图5所示,当载体与BTI比例为2∶1时,随着固定化时间的增加,固定化BTI抑制率呈先升高后降低的趋势;随着CaCl2浓度的增加,固定化BTI抑制率也呈先升高后降低的趋势。在CaCl2浓度的变化范围处于4.5%~7.0%、固定化时间范围处于25~35 min时,抑制率达到最高。等高线图呈圆形,表明载体与抑制剂体积比和时间的相互作用弱,等高线的曲面比较陡,说明固定化BTI的抑制率对时间和CaCl2浓度比较敏感。
由图6可以得出,当CaCl2浓度为5%时,随着固定化时间延长及载体与抑制剂比例的增加,都会使抑制率形成先增加后减小的变化趋势。在载体与抑制剂的比例范围为1∶1~2.5∶1、固定化时间范围为25~35 min时,抑制率达到最高。
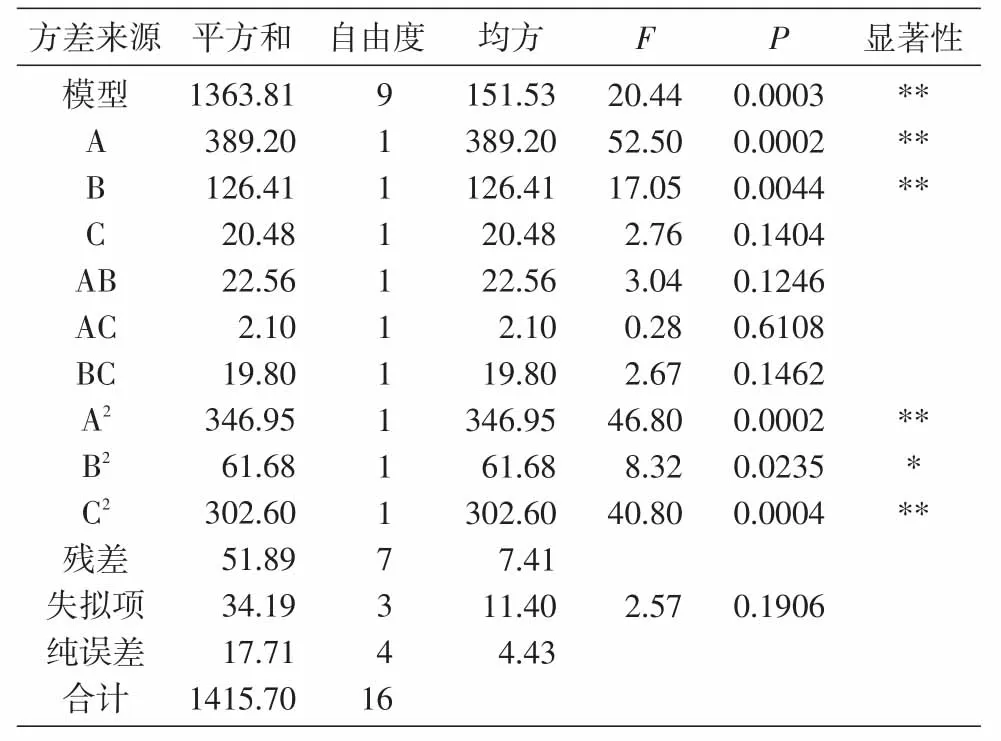
表3 响应面二次回归模型的方差分析
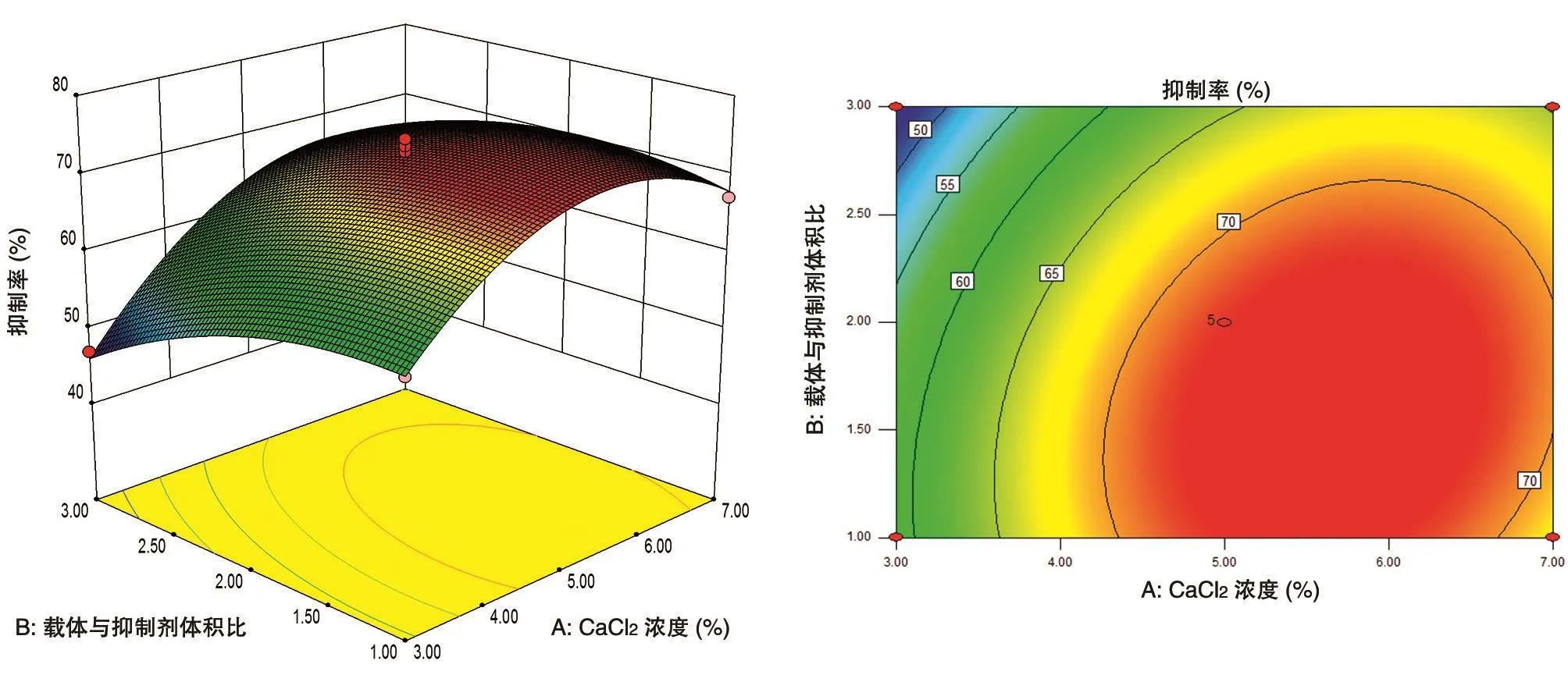
图4 CaCl2浓度和载体与抑制剂比例对固定化BTI抑制率的响应面和等高线

图5 固定化时间和CaCl2浓度对固定化BTI抑制率的响应面和等高线
利用Design Expert 8.0.6软件对模型进行分析,得到固定化BTI的最佳条件:CaCl2浓度为5.67%,载体与BTI体积比为1.6∶1,时间为30.56 min,此时固定化BTI抑制率为74.3%。根据实际操作情况,调整CaCl2浓度为5.6%,时间为31 min,载体与抑制剂体积比为1.6∶1,进行验证试验,通过3次平行试验得到固定化BTI抑制率为72.4%,与预测值74.3%相近,说明采用响应面法优化得到的BTI固定化工艺条件参数准确可靠,利用本实验建立的模型在实践中可行。
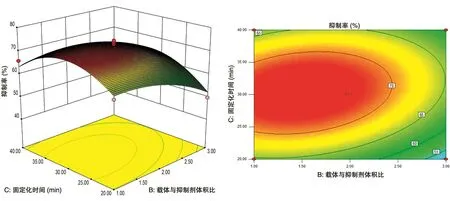
图6 载体与抑制剂比例和固定化时间对固定化BTI抑制率的响应面和等高线
3 讨论
本实验用物理包埋法对BTI进行固定化,根据CaCl2浓度、载体与BTI体积比和固定化时间3个单因素结果,利用响应面法对固定化条件进行优化,得到了最佳固定化条件及主要影响因素。
单因素实验得出BTI的最优固定化条件为CaCl2浓度5%、载体与BTI体积比2∶1、固定化时间30 min。根据单因素实验结果,设计响应面实验对固定化条件进行优化,建立了以抑制率为响应值的回归模型,模型拟合程度较高,表明实验结果准确有效。在该模型下得出最佳固定化条件为CaCl2浓度5.6%、载体与抑制剂体积比1.6∶1、固定化时间30.56 min。方差分析表明,CaCl2浓度、载体与抑制剂体积比、固定化时间对固定化BTI抑制率影响是显著的,而且是非线性的,但它们的交互影响不显著。实验结果表明,响应面分析法可以有效地优化BTI的固定化条件。

