miR-490-3p通过靶向调控TGFBR1抑制非小细胞肺癌细胞的增殖和侵袭
李艳青,郭婷婷,曾毅,周玉柏
北京工业大学 生物科学与生物工程学院,北京 100124
肺癌是全球癌症发病和死亡的首要原因,2018年预计新发病例210万,致死180万,占所有癌症死亡人数的五分之一[1]。肺癌可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),约 85%的肺癌患者为NSCLC[2]。非小细胞肺癌又可分为腺癌、鳞状细胞癌、大细胞癌等,其中以肺腺癌和肺鳞癌最为常见。近年来,随着酪氨酸激酶抑制剂的使用和免疫治疗技术的发展,NSCLC患者的治疗模式发生了革命性的变化[3-4]。然而,上述新型治疗方法也存在患者适用范围窄、副作用明显及易发耐药等缺点,NSCLC患者的5年综合生存率仍然偏低。因此,深入研究NSCLC发生发展的分子机制,寻找药物作用的新靶点,对于改善肺癌患者预后,提高生活质量有重要的临床意义。
微小 RNA(microRNA,miRNA)是一类包括20~25个核苷酸的非编码RNA,通过与mRNA的3'非翻译区(UTR)结合,降解mRNA或抑制其翻译过程,进而调控靶基因的表达水平[5-6]。大量数据表明,miRNA在癌症的发生发展中发挥重要的调控作用,根据作用的不同可分为促进肿瘤生长的促癌miRNA和具有抑癌作用的抑癌miRNA[7]。近来研究表明,miR-490-3p的表达异常与肿瘤发生有着密切关系,在乳腺癌、结肠癌、肝癌、胃癌等恶性肿瘤中发挥抑癌基因的作用[8-11],但其在肺癌中的作用还不明确[12-13]。我们以非小细胞肺癌A549细胞为模型,探讨miR-490-3p在NSCLC中的作用及分子机制,为寻找新的药物靶点,开发新的治疗措施提供理论依据。
1 材料与方法
1.1 材料
A549细胞由本实验室保存;DMEM培养基、胎牛血清(FBS)、PBS、Opti-MEM购自Gbico公司;LipofectAMINE 3000购自Invitrogen公司;质粒小提试剂盒、胶回收试剂盒、RT-PCR试剂盒、SYBR荧光定量试剂盒均购自TaKaRa公司;TGFBR1抗体购自Abcam公司;GAPDH抗体购自CST公司;抗兔IgG抗体购自KPL公司;Transwell小室购自Corning公司;pmirGLO质粒、双萤光素酶检测试剂盒购自Promega公司;Cy3标记的miR-490-3p mimics、miR-NC由广州锐博生物公司合成。
1.2 细胞培养
A549细胞用含10%FBS的DMEM培养基(添加100 μg/mL青霉素和链霉素),于含5%CO2的37℃培养箱中培养。
1.3 细胞转染
将A549细胞以3×105/孔接种于6孔板中,培养24 h后设置miR-490-3p mimics组、阴性对照组(miR-NC)和空白组,用LipofectAMINE 3000进行相应miRNA转染,每组设置3个复孔,转染48 h后进行检测。
1.4 CCK8检测细胞增殖
将转染后24 h的各组细胞以5×103/孔接种于96孔板,每组设置5个复孔,分别于24、48、72 h弃旧培养基,每孔加入100 μL CCK8试剂和培养基DMEM混合液,继续培养2 h,用酶标仪测定D450nm值。
1.5 细胞划痕实验检测细胞迁移能力
将转染后24 h的各组细胞接种于六孔板,待细胞汇合度达80%~90%时,用10 μL的无菌枪头垂直方向划直线,PBS清洗3次去除脱落细胞后加入2 mL无血清的新鲜DMEM培养基,分别在0和24 h于显微镜下拍照记录,用ImageJ软件测量迁移距离,计算各组细胞的迁移率。
1.6 Transwell检测细胞的迁移与侵袭能力
将转染后24 h的各组细胞分别用无血清培养基制成单细胞悬液,迁移实验Transwell上室细胞接种数为5×104,侵袭实验(含基质胶Matrigel)Transwell上室细胞接种数为1×105,下室分别加入600 μL含20%FBS的DMEM培养基,继续培养24 h,取出小室,PBS清洗1次,4%多聚甲醛固定20 min,用0.1%结晶紫染色后显微镜下观察,随机选取10个视野拍照计数。
1.7 miR-490-3p靶基因的预测及qRT-PCR筛选
miRwalk在线工具通过集成Targetscan和miRTarBase预测网站的算法进行miRNA靶基因的预测,并可对不同算法获得的预测基因取交集以得到更可信的结果。我们对预测结果根据基因功能进行进一步筛选,最终确定进入后续筛选的候选调控基因。用TRIzol法提取转染48 h后的A549细胞总RNA,以U6为内参,反转录后进行荧光定量反应(反应条件:95℃ 5 min,95℃ 30 s,60℃ 30 s,40个循环数),记录最终结果,用 2-ΔΔCt法计算不同调控基因mRNA表达的差异。
1.8 Western印迹检测蛋白表达
A549细胞转染48 h后,每孔加100 μL RIPA细胞裂解液,置冰上裂解15 min,收集至EP管,4℃、12 000 r/min离心10 min,收集上清进行蛋白定量;加入SDS上样缓冲液沸水浴10 min,每组取25 μg蛋白上样,进行SDS-PAGE;电泳结束后,在100 mA恒流下将蛋白转至NC膜上,室温下用5%的脱脂奶粉封闭2 h;加入一抗,4℃孵育过夜;加入二抗,室温孵育1 h;条带信号用Odyssey远红外影像分析仪检测;用ImageJ对检测结果进行灰度扫描,以目的蛋白条带灰度值与GAPDH蛋白条带灰度值的比值表示蛋白的相对表达量。
1.9 双萤光素酶报告基因实验
将相应基因的3'-UTR序列插入pmirGLO载体的多克隆位点,将构建的载体与miR-490-3p mimics、miR-NC用 LipofectAMINE 3000共转染A549细胞,转染48 h后用双萤光素酶活性检测试剂盒检测萤火虫萤光素酶和海肾萤光素酶活性。相对萤光素酶活性以萤火虫萤光素酶活性值/海肾萤光素酶活性值表示。
1.10 统计学分析
采用Graphpad Prism7.00统计软件进行数据分析,数据以x±s表示,2组间比较采用t检验,多组间比较采用单因素的方差分析。P<0.05代表差异具有统计学意义。
2 结果
2.1 miRNA-490-3p对A549细胞增殖的影响
用LipofectAMINE 3000转染Cy3标记的miR-490-3p mimics,在明场和荧光下观察,转染效率可达90%以上(图1)。CCK8实验结果显示,转染了miR-490-3p mimics的A549细胞在培养48和72 h后,细胞数明显少于阴性对照组(图2,P<0.01),提示miR-490-3p过表达可显著降低A549细胞的增殖能力。
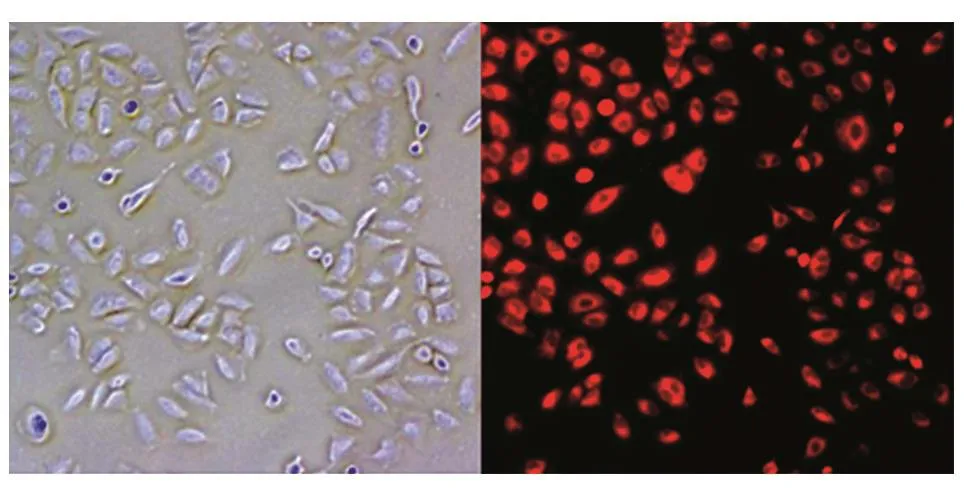
图1 miR-490-3p mimics的转染效率
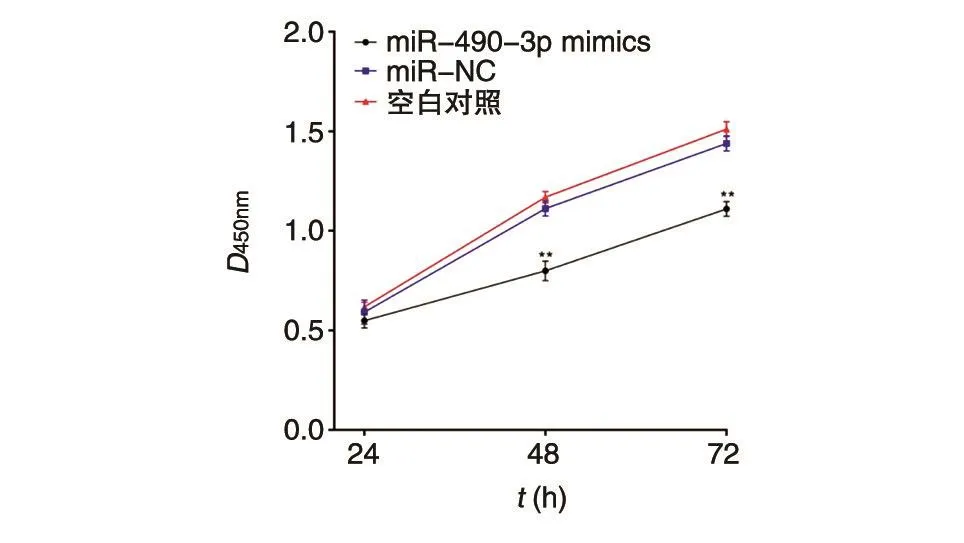
图2 miR-490-3p过表达抑制A549细胞增殖
2.2 miRNA-490-3p对A549细胞迁移的影响
采用划痕实验测定过表达miR-490-3p后A549细胞迁移能力的变化,结果显示,与阴性对照组相比,转染了miR-490-3p mimics的A549细胞的迁移率明显降低(图3,P<0.01),提示miR-490-3p过表达可抑制A549细胞的迁移能力。
2.3 miRNA-490-3p对A549细胞迁移侵袭的影响
采用Transwell迁移实验进一步验证miR-490-3p对A549细胞迁移能力的影响,结果显示,与阴性对照组相比,转染miR-490-3p mimics的A549组细胞穿膜数目显著减少(图4,P<0.001)。Transwell侵袭实验结果显示,与阴性对照组相比,miR-490-3p过表达的A549组细胞穿膜数目明显减少(图5,P<0.001)。提示miR-490-3p过表达可显著抑制A459细胞的迁移与侵袭能力。

图3 划痕实验检测miR-490-3p对A459细胞迁移的影响

图4 Transwell实验检测miR-490-3p对A549细胞迁移能力的影响

图5 Transwell实验检测miR-490-3p对A549细胞侵袭能力的影响
2.4 qRT-PCR筛选miRNA-490-3p的靶基因
根据在线预测的miRNA-490-3p靶基因并结合基因功能分析,选择与细胞增殖、迁移及侵袭表型相关的RASAL2、TGFBR1、PAPPA、HMGA2、TGFA基因进行后续qRT-PCR筛选。结果表明,仅TGFBR1基因的mRNA表达水平显著下调(图6,P<0.01),其他基因的mRNA与对照组相比无显著差异。因此,选择TGFBR1基因为miRNA-490-3p的候选靶基因进行后续研究。

图6 qRT-PCR检测过表达miR-490-3p对靶基因mRNA表达水平的影响
2.5 Western印迹检测miRNA-490-3p对TGFBR1蛋白水平的影响
Western印迹显示,与阴性对照组相比,转染miR-490-3p mimics后,A549细胞中的TGFBR1蛋白表达显著下调(图7,P<0.05),说明miR-490-3p与A549细胞中TGFBR1蛋白的表达水平存在负相关性。

图7 miR-490-3p对A549细胞中TGFBR1蛋白表达水平的影响
2.6 双萤光素酶报告基因实验验证miR-490-3p靶向TGFBR1基因
TGFBR1基因的3'-UTR和miR-490-3p的结合序列如图8A所示。用LipofectAMINE 3000将miR-490-3p mimics/miR-NC和双萤光素酶报告基因载体pmirGLO-TGFBR1共转染A549细胞,转染48 h后用双萤光素酶试剂盒检测各组萤光素酶的活性。结果显示,与对照组相比,转染miR-490-3p mimics组相对荧光值显著下降(图8B,P<0.05),提示miR-490-3p可通过结合TGFBR1的3'-UTR抑制TGFBR1基因的表达。TGFBR1基因是miR-490-3p的靶基因。

图8 miR-490-3p与靶基因TGFBR1结合位点的预测和验证
3 讨论
数十年来,随着新型靶向药物及免疫治疗的发展,肺癌的治疗手段越来越多样化,治疗效果有明显的提高,但肺癌患者的总体预后仍然不容乐观,5年生存率仅为15%[14]。因此,探讨NSCLC的发生机制,寻找新的分子标志物及药物靶点,对于进一步提高肺癌患者的治疗效果十分必要。
现已明确,miRNA参与了多种恶性肿瘤的发生发展过程。综合已有的数据,可以认为,对于肿瘤这种表型多样复杂的疾病,必然存在不同层面的涉及多种代谢及信号通路的异常,而在此过程中,不同的miRNA及其靶基因之间形成的复杂调控网络可能发挥重要作用。目前仅有不多的几种miRNA被证实与肺癌的发生密切相关[15-18]。比如miR-4326可通过靶向APC2促进肺癌细胞的增殖;miR-214通过靶向CPD抑制肺癌细胞的生长。因此,发现新的具有调控作用的miRNA分子,对于加深对肺癌调控网络的认识,开发新型靶向药物具有重要意义。miR-490-3p被认为在多种肿瘤中发挥作用,在乳腺癌中可通过下调RhoA基因抑制乳腺癌细胞的增长[19],在结直肠癌细胞中miR-490-3p的下调可以激活Wnt/βcatenin通路[20]。然而,miR-490-3p在肺癌中的作用及分子机制并不清楚。本研究将miR-490-3p mimics导入非小细胞肺癌A549细胞,通过CCK8、细胞划痕及Transwell实验,表明miR-490-3p过表达可显著抑制A549细胞的增殖、迁移和侵袭能力。随后,通过qRT-PCR和Western印迹对其可能的靶基因进行筛选。qRT-PCR结果显示,仅有TGFBR1基因的mRNA水平显著下调,随后的Western印迹也进一步确证TGFBR1蛋白表达水平与其mRNA具有同样的变化趋势,提示TGFBR1基因可能是miR-490-3p调控的靶基因。最后,运用双萤光素酶报告实验证明,miR-490-3p可通过直接结合TGFBR1基因的3'-UTR最终下调该基因的蛋白表达水平。TGFBR1基因编码TGF-β信号通路中的重要受体TGF-β受体1,接受胞外刺激信号的TGF-β受体1发生磷酸化进而激活Smad信号通路,调节相关基因的转录,广泛参与细胞生长、增殖等过程[21]。研究发现,TGFBR与肿瘤的增殖、侵袭表型密切关系[22-24],在NSCLC患者人群中存在较高的TGFBR1等位基因特异性表达,且与TGFBR1基因的一个两位点单倍型相关,这提示TGFBR1基因与NSCLC的病因学有重要联系[25]。本研究证明在非小细胞肺癌A549细胞中miR-490-3p通过靶向TGFBR1调控其表达,从而发挥抑癌作用,进一步丰富了对miR-490-3p在肺癌中的调控机制的认识。
综上,miR-490-3p可通过直接靶向TGFBR1抑制非小细胞肺癌细胞的增殖和迁移侵袭。此研究为miR-490-3p在肺癌靶向治疗中的潜在应用提供了实验基础。

