伏核微量注射异丁司特对吗啡成瘾大鼠甩尾痛阈的影响
徐秋菊 张广文
癌痛(Cancer pain)是指由肿瘤直接引起的疼痛,或者是因为特殊治疗带来的疼痛,与精神、心理和社会因素交织,是癌症患者最常见、最痛苦的症状之一。自1977年来,口服阿片类药物成为慢性中度-重度癌痛的首选治疗药物,但是,阿片类药物应用伴随着很多副作用,包括耐药、成瘾、痛敏以及情绪和行为的改变[1],并且,其滥用产生成瘾可造成巨大社会危害,因此,寻找一个新靶点,解决阿片类药物滥用倾向和成瘾,具有极其重大的临床及社会意义。既往的研究证明,阿片类药物成瘾的形成与其强大的奖赏效应密切相关,奖赏系统主要涉及腹侧被盖区、伏核、弓状核、杏仁核、蓝斑、中脑导水管周围灰质、额前皮质等脑区及核团,多数观点认为,奖赏系统中的腹侧被盖区和伏核是成瘾性药物引起奖赏效应的最后通路,而且,伏核也被认为是介导阿片类药物渴求的重要部位[2]。异丁司特(AV411;ibudilast)最初在日本是临床上用于治疗支气管哮喘的抗炎药物,通过其对磷酸二酯酶(PDE)的抑制作用,导致cGMP水平升高,抑制气管平滑肌的收缩力[3]。近些年,人们日益认识到了异丁司特可以作为一些神经系统疾病的治疗方法,包括慢性疼痛[4]。作为一种靶向神经营养因子信号传导和神经免疫功能的新型成瘾药物,相关的动物及临床研究涉及其对神经性疼痛、阿片样物质戒断、酒精成瘾和急性阿片类镇痛的作用[5],并且于2016年,异丁司特被批准为治疗渐冻症的“孤儿药”。本研究旨在探讨异丁司特这个用途广泛的“老药”在伏核参与吗啡成瘾大鼠的痛觉调节机制,期望能为晚期癌症疼痛治疗寻找到新的治疗方法。
1 材料和方法
1.1 实验动物及分组
实验选健康成年SD大鼠48只,体重300 g±30 g,雌雄不限,由哈尔滨医科大学第二临床医学院实验动物中心提供。大鼠在室温20℃,自然光照,水、食自由摄取的环境下饲养。大鼠随机分成4组,每组12只,分别为(1)正常大鼠生理盐水对照组;(2)吗啡成瘾大鼠生理盐水组;(3)正常大鼠异丁司特组;(4)吗啡成瘾大鼠异丁司特组。
1.2 吗啡成瘾大鼠模型建立[6]
SD大鼠背部皮下递增注射吗啡,剂量依次:5、10、20、40、50、60 mg/kg,每日三次,连续给药6天,建立吗啡成瘾大鼠模型,第7天,将大鼠放入洁净的大鼠笼中,适应30 min,然后连续观察,参照Koob[7]吗啡成瘾大鼠躯体戒断症状评分标准,直接记录大鼠咬牙、直立、理毛、湿狗样抖动、伸展、舔阴等行为的次数,按照大鼠的行为次数打分,每次1分(连续的动作每超过30秒,加1分)。
1.3 主要试剂
异丁司特(美国Sigma公司,用生理盐水稀释至5 μg/2 μL);生理盐水(四川科伦药业股份有限公司);2%丙泊酚(Fresenius Kabi Austria GmbH);盐酸罗哌卡因(100 mg/10 mL,AstraZeneca AB,Sweden);2%滂胺天蓝(Germany)。
1.4 实验方法
大鼠在2%丙泊酚(100 mg/kg)麻醉下实施常规手术,按Pellegrino图谱B座标系统,定位尾核后,颅骨开窗。术后,将大鼠的头部固定在SN-2脑立体定位仪上。用长效局部麻醉药盐酸罗哌卡因在创面局部做浸润麻醉,以减轻大鼠清醒后创口的疼痛。当大鼠清醒后,待其适应10 min后,参照Chaplan[8]所描述的方法,用PL-200热痛刺激仪照大鼠尾部的外1/3点,并调节照射强度为50%,使其甩尾潜伏期(TFL)控制在3~7 s左右,照射3次,每次间隔2 min,记录TFL,并取3次TFL的平均数作为基础对照值。用直径为2 mm的透明塑料管连接25 μL微量注射器与玻璃微电极。按Pellegrino图谱B座标系统,将内充生理盐水及异丁司特的玻璃微电极插入伏核(A:3.6 mm;R or L:1.4 mm;H:6.5 mm)内。用Stoelting微量推进仪分别匀速的向伏核内注入药,正常大鼠生理盐水对照组和吗啡成瘾大鼠生理盐水组:大鼠伏核内注入生理盐水2 μL;正常大鼠异丁司特组和吗啡成瘾大鼠异丁司特组大鼠伏核内注入异丁司特5 μg/2 μL,2 min注射完。
以PL-200热痛刺激仪照尾作为伤害性刺激,记录大鼠伏核内分别注入药物后后TFL的变化,每次间隔5 min,连续记录1 h。实验结束时,大鼠电泳2%滂胺天蓝(通直流电,阴极25 μA,电泳15 min)标记微电极尖端在伏核核内的位置,组织学定位以确定注药位置。组织学定位不准确以及滂胺天蓝扩散出伏核的数据被排除。
1.5 数据采集及分析

2 结果
2.1 伏核微量注射异丁司特对正常大鼠辐射热照尾痛阈的影响
正常大鼠伏核微量注射异丁司特5 μg/2 μL组后,大鼠的TFL延长,并在12个时间点TFL差值均为正值,呈现出镇痛效应。在注入异丁司特后30 min时,TFL值为9.76±0.36 s(表1),达到高峰。注入异丁司特后15~60 min期间,各时间点TFL差值与对照组同时间点的差异具有统计学意义(P<0.0001)(图1)。

表1 伏核微量注射异丁司特对正常大鼠TFL值的影响Table 1 Influence of intra-NAC microinjection ibudilast in the TFL values of normal rats
Note:Compared with control group,*P<0.0001.
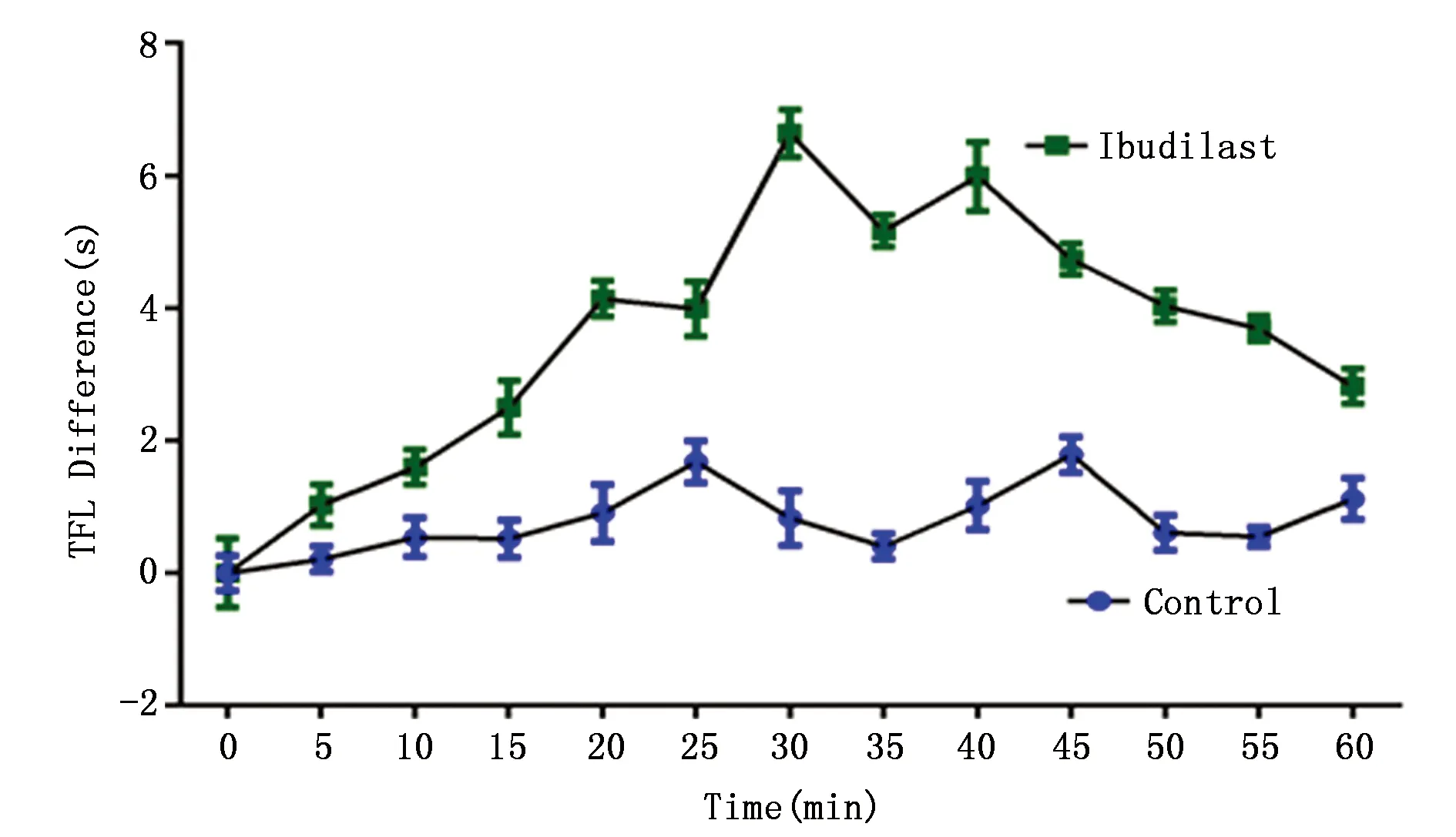
图1 伏核微量注射异丁司特对正常大鼠TFL差值的影响Figure 1 Influence of intra-NAC microinjection ibudilast in the TFL values of normal rats
2.2 伏核微量注射异丁司特对吗啡成瘾大鼠辐射热照尾痛阈的影响
吗啡成瘾大鼠伏核微量注射异丁司特5 μg/2 μL组后,大鼠的TFL延长,并在12个时间点TFL差值均为正值,呈现出镇痛效应。在注入异丁司特后30 min时,TFL值为10.56±0.52 s(表2),达到高峰。注入异丁司特后5~60 min期间,各时间点TFL差值与对照组同时间点的差异具有统计学意义(P<0.0001)(图2)。
2.3 吗啡成瘾大鼠生理盐水组与正常大鼠生理盐水对照组辐射热照尾痛阈的比较,以及吗啡成瘾大鼠异丁司特组与正常大鼠异丁司特组辐射热照尾痛阈的比较
伏核微量注入生理盐水后,吗啡成瘾大鼠的TFL差值明显低于正常大鼠(P<0.05)(图3A),表明吗啡成瘾大鼠产生痛敏,痛阈明显降低;而伏核微量注射异丁司特后,吗啡成瘾大鼠的TFL差值明显增高,产生的镇痛作用较正常大鼠明显(P<0.05)(图3B)。

表2 伏核微量注射异丁司特对吗啡成瘾大鼠TFL值的影响Table 2 Influence of intra-NAC microinjection of ibudilast in the TFL values of morphine-addicted rats
Note:Compared with control group,*P<0.0001.

图2 伏核微量注射异丁司特对吗啡成瘾大鼠TFL差值的影响Figure 2 Influence of intra-NAC microinjection ibudilast in the TFL values of morphine-addicted rats

图3 吗啡成瘾大鼠与正常大鼠TFL差值的差异Figure 3 The difference of TFL values between morphine-addicted rats and normal rats
3 讨论
疼痛是癌症患者最常见的症状之一,据统计,晚期癌症患者的疼痛发生率为60%~80%,并且其中1/3表现为重度疼痛,严重影响癌症患者的生存质量,甚至造成治疗中断。阿片类药物,包括吗啡,对癌痛管理至关重要,但同时易导致成瘾、戒断和复发的终身循环。因此寻找到一种既能增强阿片类药物镇痛作用,又能减少其成瘾和戒断发生的新方法,将具有极大的临床及社会价值。
虽然传统观点认为阿片类药物是通过神经介导发挥作用,然而近期研究表明,胶质细胞(星形胶质细胞和小胶质细胞)在阿片类药物作用中具有重要的调节作用,特别是在镇痛、耐受和依赖方面[9]。此外,有研究证明显微注射星形胶质细胞条件培养基在前扣带皮层和伏核(NAc),可增强吗啡条件性位置偏爱(CPP)[10]。胶质激活可调节吗啡的多种作用,包括镇痛、耐受和依赖[11]。并且以前就有报道神经胶质激活和PDE抑制剂异丁司特(Ibudilast)能减少戒断的体征,为我们治疗神经痛及吗啡戒断提供了一个新的思路,同时异丁司特具有非常高的临床安全性,体外实验[11]、体内动物实验[12]和临床神经药理学研究发现,异丁司特用较大剂量,或者血药浓度达到80~100 mg/d是安全有效的,并且有“越多越好”的趋势。临床最大安全剂量50 mg BID,与其对应的血浆浓度是~100 ng/mL或者~0.5 μM,这意味着异丁司特与现在应用的其他镇痛药物相比,具有更高的临床安全性。本研究通过向吗啡成瘾大鼠与正常大鼠的伏核(一个与奖赏密切相关的核团)注射异丁司特,探讨异丁司特参与伏核痛觉调制及吗啡成瘾的机制,结果显示,吗啡成瘾大鼠痛阈较正常大鼠低,伏核微量注射异丁司特在正常大鼠与吗啡成瘾大鼠均产生镇痛效果,而且在吗啡成瘾大鼠体内产生镇痛效果更为显著。本实验仅从行为学方面验证了异丁司特对吗啡成瘾大鼠的镇痛作用,其作用机制需更进一步的研究去探讨,希望异丁司特这一个安全性高,应用广泛的“老药”在吗啡类药物为主癌痛治疗中,能够发挥协同镇痛、减少吗啡成瘾、治疗吗啡引起的痛敏等作用。

