WEE1在胃癌组织中的表达及对患者预后的影响
孟 海 杜观祥 朱利玲 汤琪云
胃癌是我国最常见的恶性消化道肿瘤之一,其发病率位于男性恶性肿瘤第二位,女性胃癌发病率低于乳腺癌、肺癌和结直肠癌,位居第4位。不同细胞周期蛋白异常可以引起肿瘤细胞失控性复制,这是肿瘤的重要特征之一,也是针对肿瘤细胞进行周期性治疗的理论基础[1-2]。WEE1属于丝氨酸/苏氨酸蛋白激酶家族,最早在粟酒裂殖酵母中被发现,缺少WEE1的酵母细胞可以在体积达到正常大小的一半时进行分裂,导致体积较小,研究者以此为线索,发现了WEE1负性调节细胞周期素依赖性激酶活性的功能。在肿瘤细胞中,WEE1可参与调节细胞G2/M期转换、组蛋白合成及DNA损伤的修复,维持基因组稳定[3-4]。在结肠癌[5]、黑色素瘤[6]、乳腺癌[7]等多种实体肿瘤中均发现存在WEE1的过表达,但在胃癌中相关报道极少。因此,本研究收集了78例胃癌患者为研究对象,探讨WEE1在胃癌组织中的表达及对预后的影响,以期为胃癌的机制学研究提供更多依据。
1 资料与方法
1.1 研究对象
收集2011年1月—2013年9月我院收治的胃癌患者为研究对象。纳入标准:(1)首次确诊胃癌;(2)术前未行放化疗等抗肿瘤治疗;(3)无胃部手术史及其他病史;(4)临床资料及随访资料完整。排除标准:(1)围术期死亡病例;(2)合并有其他器官的恶性肿瘤;(3)因肿瘤相关肠梗阻等行急诊手术。最终,78例患者被纳入研究。其中,男性46例,女性32例。年龄32~83岁,中位年龄56岁。以术后病理学报告为参照,根据有无淋巴结转移,将患者分为淋巴结(-)组与淋巴结(+)组,分别有26例和52例。本研究获得医院伦理委员会审查通过。
1.2 免疫组化检测
兔抗人WEE1单克隆抗体及SP试剂盒购于美国Zymed公司。DAB显色试剂盒购自北京索莱宝科技有限公司。胃癌组织经甲醛固定后,石蜡包埋,切片,常规脱蜡、水化,滴加兔抗人WEE1单克隆抗体,低温孵育,加入二抗,DAB显色,苏木素复染,脱水,二甲苯透明,中性树胶封片。以PBS代替一抗为阴性对照,设置对照组。采用半定量积分法判断阳性结果,以出现棕色颗粒作为阳性标准。染色强度,无染色:0分,浅黄色:1分,棕黄色:2分,棕褐色:3分;高倍镜下随机取10个视野,每视野计数100个细胞,计算细胞阳性率,阳性率:阳性率<25%:1分,阳性率介于25%~50%:2分,阳性率介于50%~75%:3分,阳性率>75%:4分。两者乘积结果0分为阴性,1~8分为低表达,9~12分为高表达。
1.3 RT-qPCR检测
TRIzol购于美国Invitrogen公司,反转录试剂盒购于上海源叶生物科技有限公司。采用TRlzol法提取胃癌组织中的RNA,参照反转录试剂盒说明书合成cDNA,利用SYBGGreen试剂盒进行RT-PCR反应。引物序列为Sence:5′-CCACCACCCTGCCAGTTAAC-3′,Antisence:5′-TAAACTTTTGTGCAACCAGGGTAA-3′,反应条件为,50℃ 2 min,95℃变性15 s、30℃延伸30 s,40个循环。基因相对表达水平采用2-△△Ct法确定。
1.4 随访
随访采用门诊、电话等形式进行。以患者死亡作为随访终点。随访间隔为术后第1年内每3个月随访1次,术后1年以上每半年随访1次,直至随访终点或失访,随访截止时间为2018年8月31日。
1.5 统计学分析
数据分析采用SPSS 20.0软件进行,计数资料采用频数和率表示,单因素分析采用卡方检验,多因素分析采用Logistic回归分析。采用Log-rank检验比较两组患者生存曲线差异,P<0.05认为差异具有统计学意义。
2 结果
2.1 免疫组化染色结果
WEE1在胃癌细胞的细胞质、细胞核内均有明显表达,表现为黄色或棕黄色颗粒,总阳性率为43.6%,低表达13例,高表达21例。其中,淋巴结(+)组与淋巴结(-)组的WEE1的阳性率分别为53.8%(28/52)、23.1%(6/26),差异具有统计学意义(χ2=6.674,P=0.010)(图1)。
2.2 两组患者的WEE1 mRNA表达量比较
RT-qPCR检测结果显示,淋巴结(-)与淋巴结(+)患者的平均WEE1 mRNA表达量分别为(1.32±0.21)和(3.64±0.41),差异具有统计学意义(P<0.01)(图2)。
2.3 WEE1 mRNA表达量对胃癌淋巴结转移预测效能的ROC曲线
ROC曲线结果显示,WEE1 mRNA表达水平对胃癌淋巴结转移预测的曲线下面积为0.806,敏感性84.8%,特异性79.6%,P<0.01,有较好的诊断效能(图3)。

图1 免疫组化染色结果Figure 1 The expression of WEE1 in gastric cancer tissues by immunohistochemistryNote:A.The negative expression of WEE1 in gastric cancer tissues(100 ×);B.The positive expression of WEE1 in gastric cancer tissues(100 ×);C.The positive expression of WEE1 in gastric cancer tissues(400 ×).
2.4 WEE1表达与胃癌病理参数的关系
WEE1表达与胃癌癌灶大小、T分期、淋巴结转移、脉管浸润有关(P<0.05),但与肿瘤部位、肿瘤大小、Lauren分型、M分期无关(P>0.05)(表1)。

表1 WEE1表达与胃癌病理参数的关系Table 1 The effect of WEE1 expression on parameters of gastric cancer by univariate analysis
2.5 胃癌病理参数对WEE1表达影响的多因素分析
多因素分析结果显示,T分期、有无淋巴结转移是影响WEE1表达的独立性危险因素(P<0.05)(表2)。

表2 胃癌病理参数对WEE1表达影响的多因素分析Table 2 The effect of parameters of gastric cancer on WEE1 expression by multivariate analysis

图2 两组患者的WEE1 mRNA表达量比较Figure 2 The mRNA expression of WEE1 in LN(+)and LN(-)groups

图3 WEE1 mRNA表达量对胃癌淋巴结转移预测效能的ROC曲线Figure 3 ROC curve of WEE1 expression in predicting lymph node metastasis of gastric caner
2.5 WEE1表达对患者5年生存率及总体生存期的影响
78例患者,失访率为8.9%。5年内死亡41例,其中,WEE1(-)组、WEE1低表达组、WEE1高表达组分别死亡13例、10例、18例,三组患者的5年生存率有统计学差异(χ2=25.67,P<0.001)。两两比较后发现,WEE1低表达组与WEE1高表达的生存率无统计学差异(P>0.05),但均显著低于WEE1(-)组(P<0.05)(图4)。
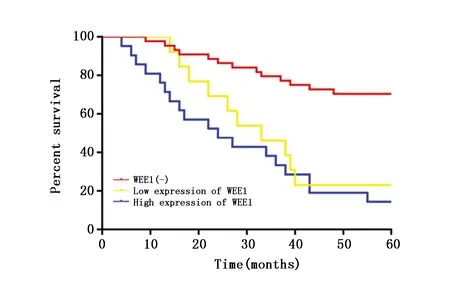
图4 不同WEE1表达强度患者的生存曲线Figure 4 Survival curve of patients with different levels of WEE1
3 讨论
胃癌是我国最常见的消化道恶性肿瘤之一,随着我国社会经济的发展,人们的生活习惯、食物谱都发生了巨大改变,胃癌的发病率也呈明显的上升趋势,找寻更具治疗意义的分子靶点有重要意义[8-9]。正常细胞在G1期修复损伤DNA,但肿瘤细胞常伴有G1~S期检查点缺陷[10],通常依赖G2~M期检查点完成DNA修复,这为靶向WEE1激酶抑制剂治疗恶性肿瘤提供了理论基础[11-12]。一项Ⅱ期临床研究也证实[13],WEE1抑制剂AZD1775对一线治疗抵抗或耐药的TP53突变型卵巢癌患者有效,但在胃癌中,WEE1的相关研究尚处于起步阶段。
在本研究中,我们从蛋白及分子两个层面对WEE1表达水平进行了检测。免疫组化结果表明,WEE1在胃癌组织中的总体阳性率为43.6%,其中,淋巴结(+)组与淋巴结(-)组的WEE1的阳性率分别为53.8%、23.1%。RT-qPCR检测结果发现,淋巴结(+)组的胃癌组织中WEE1 mRNA平均表达量显著高于淋巴结(-)组,差异具有统计学意义。表明发生淋巴结转移的患者,其胃癌组织内WEE1表达水平也明显更高,可能由于WEE1阳性表达的胃癌细胞分化增殖能力更强,侵入淋巴管或血管的风险更高。在此基础上,我们分析了WEE1表达对胃癌临床病理参数的影响,结果发现,WEE1表达对胃癌癌灶大小、T分期、淋巴结转移、脉管浸润有明显影响,进一步行多因素分析发现,T分期、有无淋巴结转移是影响WEE1表达的独立性危险因素。提示WEE1的表达可能参与了胃癌肿瘤细胞的浸润和淋巴结转移的调节。随访后发现,WEE1低表达组与WEE1高表达组的生存率无统计学差异,但均显著低于WEE1(-)组。WEE1的阳性表达意味着更高的T分期与N分期,同时也可能导致脉管浸润的发生率提高。这些不良因素共同作用,使得WEE1(+)患者预后明显较差。相应地,WEE1(-)患者预后较好。
综上所述,WEE1在胃癌中有较高的阳性率,且与患者分期及淋巴结转移密切相关,其阳性表达是患者预后不良的强烈信号。但本研究为单中心研究,样本量较小,未来在多中心联合的基础上,实施更大样本量的研究,或能得出更具说服力的结论。

