基于UPLC-TOF/MS的小细胞肺癌患者血清代谢组学研究
张佳文 于 雁 张 薇 曹京燕 罗 雯 尚利华
小细胞肺癌约占肺癌发病率的20%,由于其肿瘤倍增周期短、侵袭性高,所以5年生存率低[1-2]。早期诊断是改善小细胞肺癌预后的关键,因此,如何提高早期诊断水平已成为肺癌防治的紧迫任务,目前建立无创性的诊断方法是肿瘤筛选的研究热点。代谢组学是一类新兴学科,它沿用基因组学及蛋白质组学的研究思路,以生物体液为研究对象,检测机体出现病理变化时其代谢产物的变化,并通过定量分析鉴定相关标志物,利用此技术可以预测疾病发生发展或监测疾病对干预的反应,可以为疾病的早期诊断和疗效评估提供帮助[3-4]。本实验利用超高效液相色谱-飞行时间质谱联用仪(UPLC-TOF/MS)对小细胞肺癌患者与健康志愿者血清进行定性定量分析,通过对比小细胞肺癌患者和健康人群的代谢轮廓变化,将两组进行区别,并进一步进行成分分析,寻找潜在的肿瘤标志物。同时检测局限期、广泛期小细胞肺癌患者血清中的代谢物变化,用以区别肺癌的不同分期。
1 方法与结果判定
1.1 试验方法
1.1.1 血浆样本采集 收集2012年9月—2013年7月就诊于哈尔滨医科大学附属肿瘤医院的小细胞肺癌患者血浆样本44例,其中男性28例,女性16例,年龄34~73岁。进一步对患者按照疾病分期分组,其中小细胞肺癌局限期(LD)28例,广泛期(ED)16例。以上患者均经CT引导下穿刺病理活检或支气管镜下组织活检后进行病理诊断确诊。健康人群血样(NC)同时期收集于哈尔滨工业大学附属医院体检中心(已签署知情同意书),共计50例,既往无肿瘤病史,体检结果均无肺部疾病。均为清晨空腹血浆样本。血浆样本临床资料如表1所示,两组在年龄、性别等方面无统计学差异(P>0.05)。

表1 血清样品的临床信息Table 1 Pathological characteristics of blood samples
1.1.2 血浆样本处理 血浆样本室温静置后离心弃沉淀取上清液。分析时取30 μL血清加入120 μL甲醇,将混合液充分震荡30 s摇匀。将混合液离心后取上清液100 μL装入微量进样瓶,将微量进样瓶置于标准进样瓶中进行待检测备用。标本检测流程:(1)液相色谱部分包括进样传输系统、进样系统以及分离系统;(2)质谱部分包括离子源、质量分析器、检测器和记录系统;(3)数据处理系统则是利用标准样品校准质谱仪、设置色谱和质朴的工作条件、数据的收集和处理以及数据库检索。超高效液相色谱条件C18柱(ACQUITY,50×2.1 mm,1.7 μL,美国Waters公司)。流动相:A液0.1%甲酸水溶液,B液乙腈溶液。进样量5 μL,柱温40℃,梯度洗脱,初始流动相为10%B液,保持30 s后在35 min内线性增加到98%B液,保持 2 min后再返回10%B平衡2 min;流速0.35 mL/min。具体洗脱条件见表2。质谱条件电喷雾离子源(ESI)喷雾气流量(脱溶剂气流量高)600 L/h,锥孔气流量50 L/h,电喷雾气温度300℃,离子源温度120℃,锥孔电压30 V,毛细管电压3100 V,数据采集范围m/z100~1000,质荷比误差限:0.5,噪音上限6.0。

表2 洗脱梯度Table 2 Gradient elution
1.2 结果评定
将分析所得的原始图谱和数据导入EZinfo2.0软件进行分析,采用主成分分析法(PCA),最小二乘法-判别分析法(OPLS-DA)等方法对各组数据进行识别。利用主成分分析法,得到Score-plot图以观察各组之间离散趋势,讨论样本成分轮廓变化。利用OPLS-DA法检测代谢结果的3D模型,得到表示预测能力的Q2(cum)及解释能力的R2Y(cum)。对于所得结果,若R2Y接近1,Q2接近0.5,则模型的解释及预测能力较好,同时Q2-intercept即其截距小于0则表示模型不存在过拟合的现象[5-6]。潜在血清标志物根据反应离子贡献度(Variable importance in the projection,VIP)值、离子保留时间、质荷比进行筛选,同时结合t检验进行验证。其中VIP值应大于1,数值越大,则说明变量与模型的相关性越大。
2 结果
2.1 小细胞肺癌患者与健康人群的代谢轮廓比较
为了更加细致的考察各样本间的实质差异,研究小细胞肺癌的发生及疾病进展过程中血清代谢成分变化与其相对应的疾病情况的关系,首先采用MassLynx V4.1工作站中MarkerLynx软件进行色谱峰的识别匹配,并对数据进行了提取和标准化处理。图1、2分别为小细胞肺癌患者及正常健康人群的血清通过UPLC-TQ/MS分析所得的总离子流(TIC)图。

图1 小细胞肺癌血清负离子模式色谱图Figure 1 The typical chromatogram of SCLC serum in negative model

图2 健康对照组血清负离子模式色谱图Figure 2 The typical chromatogram of normal control serum in negative model
利用EZinfo2.0软件对包含小细胞肺癌及健康对照组图谱信息的数据集进行非监督模式的PCA,得到一个PCA模型如图3所示。其中小细胞肺癌患者与健康对照组呈分离趋势。进一步绘制score-plot图观察样本离散程度,如图4所示,小细胞肺癌组与健康对照组的血清轮廓有明显差异,其中R2Y=0.723,Q2=0.647,同时R2Y-intercept=0.25,Q2-intercept=-0.21,这些参数均证明该结果有意义,同时模型不存在过拟合现象。

图3 SCLC患者血清样本与健康对照组血清样本2D得分图Figure 3 The 2D score plot of SCLC and controls

图4 SCLC患者血清样本与健康对照组血清样本3D得分图Figure 4 The 3D score plot of SCLC and controls
2.2 差异性代谢物成分分析
将三组血清中的所有小分子代谢物进行聚类分析,并通过HMDB和METLIN数据库搜索差异物的精确质荷比,对一些具有显著性差异的物质进行了初步的成分鉴别。通过计算小细胞肺癌患者与健康对照组,小细胞肺癌局限期与小细胞肺癌广泛期两组样品,提取得分图中各数据点的坐标值,分别对X、Y坐标值进行t检验(P<0.05),筛选出两组之间具有统计学差异的化合物。现以Marker ID:4.99_464.3022为例。在对比不同分期的小细胞肺癌患者血样代谢物差异时,测得该物质保留时间Rt=4.99,[M+H]+=464.3022,VIP值=2.31。根据其相对分子质量推测该化合物分子中含有奇数个N原子,在误差为5 ppm内,可得分子式为C26H43NO6,进一步在HMDB数据库检索,认为该化合物最有可能甘氨胆酸(Glycocholic Acid)。
对其他的潜在性生物标志物应用以上方法进行结构鉴定,最终共鉴定出与小细胞肺癌发生相关的生物标志物10个,与小细胞肺癌进展相关的生物标志物10个。VIP最低为1.02,所有生物标志物VIP值均大于1,对模型和样本分类均有较大贡献,可以作为潜在的生物标志物探讨其生化意义。标志物的详细信息见表2、表3。
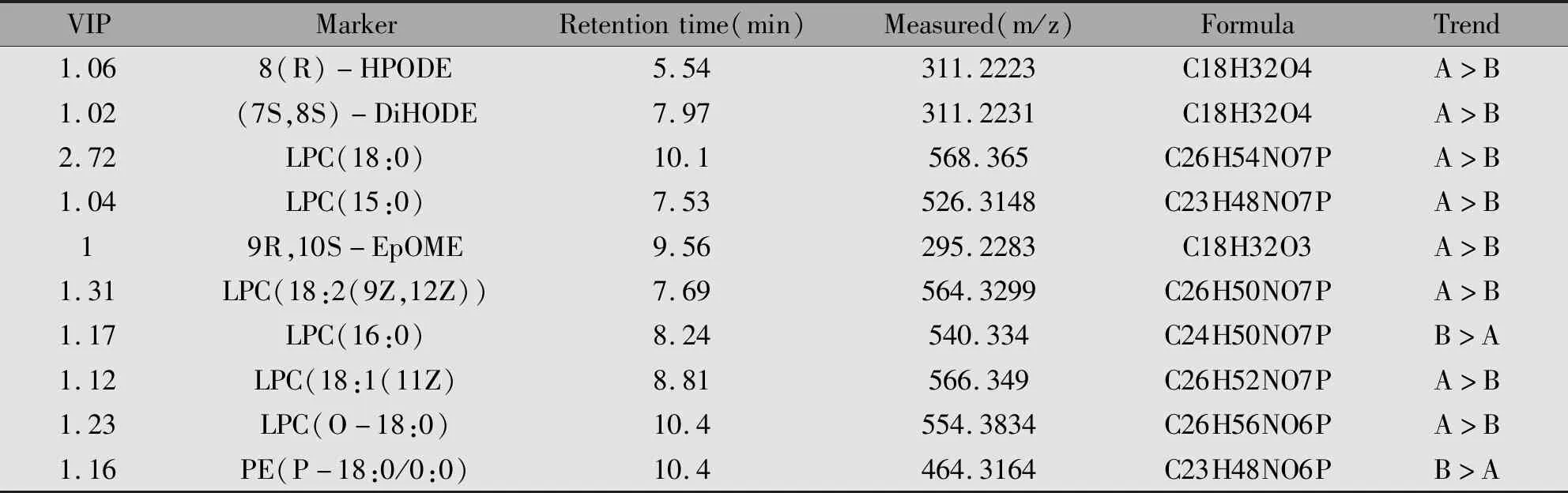
表2 小细胞肺癌患者与健康人群肿瘤代谢标志物鉴定信息表Table 2 Potential biomarkers for SCLC and normal samples
Note:P<0.05;Group A.SCLC Samples;Group B.Normal Samples.
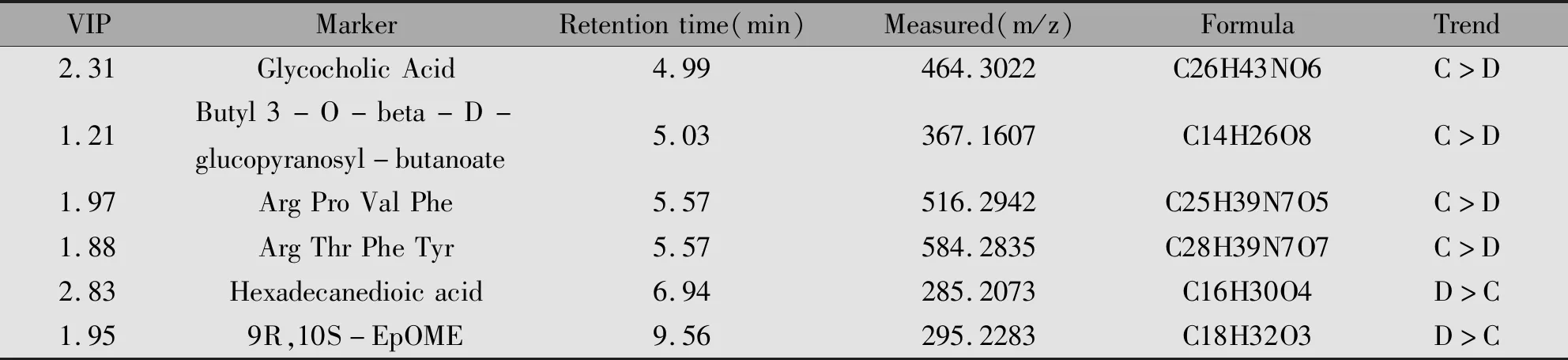
表3 不同分期小细胞肺癌患者肿瘤代谢标志物鉴定信息表Table 3 Potential biomarkers for SCLC with different staging
Note:P<0.05;Group C:SCLC-LD Samples;Group D:SCLC-ED Samples.
经过结构推导,我们发现鉴定出的20种差异性成分包括6种溶血性磷脂酰胆碱、2种脂肪酸、4种氧化脂肪酸及甘油类及氨基酸等几大类物质。对比小细胞肺癌患者与健康人群的血清样本,十八碳二烯酸(8(R)-HPODE)、亚麻酸、溶血性磷脂酰胆碱18∶0、溶血性磷脂酰胆碱15∶0、依泊二醇、溶血性磷脂酰胆碱18∶2(9Z,12Z)、溶血性磷脂酰胆碱18∶1(11Z)、溶血性磷脂酰胆碱O-18∶0在小细胞肺癌患者血清中升高,溶血性磷脂酰胆碱16∶0和磷脂酰乙醇胺(P-18∶0/0∶0)则显示下降。另一方面,对两种不同分期的小细胞肺癌患者进行分组分析,差异成分为甘氨胆酸等10种物质。其中甘氨胆酸、葡萄糖苷、精氨酸、脯氨酸、缬氨酸、苏氨酸、苯丙氨酸和酪氨酸在小细胞肺癌局限期一组内表达较高,但相反的是,十六碳二酸和依泊二醇则在小细胞肺癌广泛期一组内表达较高。
3 讨论
通过本实验结果的分析,与健康人群相比,小细胞肺癌患者血清内存在差异性的物质主要为溶血性磷脂酰胆碱、脂肪酸、甘油及氨基酸等物质。溶血磷脂酰胆碱是卵磷脂在磷脂酶A2作用下的水解产物,参与体内磷脂代谢,可以引起正常内皮的迁移,在伤口的愈合以及血管再生中起到了重要的作用。在一项研究中,研究者在肠内皮细胞中观察到0.05 mol/L的溶血性磷脂酸胆碱即可引起一个典型的细胞内钙离子动员的峰和一个平台相[7]。在免疫调节机制中,溶血性磷脂酰胆碱可以通过促进巨噬细胞、单核细胞及T淋巴细胞的吞噬功能来上调粘附分子的表达,从而在免疫调节中发挥重要作用[8]。除此之外,溶血性磷脂酰胆碱还可以促进肿瘤细胞的转移和侵袭,并调控肿瘤细胞增殖及炎症的发生。生物体内正常的磷脂代谢是一个完整的循环。溶血磷脂在酶的作用下加减烷基链来完成与磷脂的转化。溶血磷脂酰胆碱烷基转移酶(LPCAT-l)是一类调控磷脂代谢的关键酶,它主要表达于上皮细胞中,而小细胞肺癌是一类发生在支气管上皮的恶性肿瘤。既往研究表明,溶血磷脂酰胆碱烷基转移酶与肺癌、肠癌等都高度相关[9-10]。因此,我们可以推断肺癌的发生可能导致溶血磷脂酰胆碱烷基转移酶(LPCAT-l)酶活性的部分丧失或功能异常,而溶血磷脂酰胆碱(LPC)作为溶血卵磷脂烷基转移酶(LPCAT-l)的底物则会出现成分的变化。在本次试验中,对比小细胞肺癌患者与健康人群,我们发现检测出有差异的溶血性磷脂酰胆碱有6种,除了LPC16:0外其他5种均在小细胞肺癌患者血清内高表达。这一结果揭示小细胞肺癌患者体内可能存在磷脂失衡的现象,这与其他研究溶血性磷脂酰胆碱可以刺激细胞信号传导和细胞转移是一致的[11-13]。
人体内常见的脂肪酸(Fatty acid)包括棕榈酸、油酸、亚油酸、花生四烯酸等。在本研究中,亚油酸的氧化产物依泊二醇(9R,10S-EpOME)和十八碳二烯酸(8(R)-HPODE)在小细胞肺癌患者血清中含量增多,其中依泊二醇在广泛期小细胞肺癌患者血清样本中含量较局限期的更有增高。这一发现也与之前的研究中恶性肿瘤患者血清中脂肪酸的含量减少相符合[14]。在肿瘤的发生发展中,由于肿瘤细胞增殖迅速,增殖的过程中需要大量的能量及原材料满足自身生长的需要,这会导致机体内脂肪酸氧化产物增多,脂肪酸含量减少。而由于小细胞肺癌是一种神经内分泌性肿瘤,因此随着疾病的发生发展,其产生的分泌性物质也有可能导致脂肪酸的合成受到抑制[15]。亚油酸、油酸是细胞膜的重要组成成分,目前相关实验已经初步表明亚油酸的氧化产物与肿瘤的发生密切相关[16],但其具体机制尚未明确。由此,脂肪酸的合成途径与肿瘤的相关性为我们提供了一个新的研究方向。
同小细胞肺癌广泛期相比,小细胞肺癌局限期患者血清中的游离氨基酸含量显著升高,其中包括精氨酸、脯氨酸、缬氨酸、苏氨酸、苯丙氨酸和酪氨酸。血清中游离氨基酸是蛋白质合成的原料,他们通过一种动态的平衡维持机体生长发育和生理功能的需要,他们的含量变化在一定程度上反映了机体蛋白质代谢和能量代谢的改变。早期小细胞肺癌患者由于肿瘤细胞数量少,能量消耗也相应较少,因此血清中游离氨基酸能够满足机体的基本需求。但随着疾病进展,肿瘤发生全身转移,肿瘤组织中蛋白质合成显著增加,需要大量摄取多种氨基酸,致使整个机体内氨基酸代谢发生紊乱,导致游离氨基酸含量显著减少[17]。同时,肿瘤患者膳食蛋白摄入减少,营养情况恶化,也从另一方面加重了氨基酸代谢的紊乱。本实验结果提示血液中游离氨基酸含量变化可以作为监测小细胞肺癌疾病进展的潜在标志物的同时,也提示了小细胞肺癌患者除了进行放疗、化疗等传统治疗外,也应注重营养支持治疗。
综上所述,本研究通过代谢组学技术证明了小细胞肺癌患者在磷脂代谢、脂肪酸代谢和蛋白质代谢等方面均可表现为不同程度的紊乱,证明通过检测血清差异性代谢产物的表达来寻找潜在疾病是一种具有前景的手段,此技术有助于从小分子代谢水平理解小细胞肺癌的发生发展机制。肿瘤的发生离不开机体内环境的变化,内环境小分子物质变化又是肿瘤生长的关键环节,如何能够改变肿瘤生长的内环境物质,阻断肿瘤能量供应途径从而达到抗肿瘤的目的,是我们下一步需要探讨的问题。代谢组学技术,具有无创性、能够高通量检测实时代谢物质动态变化的特点,有望为小细胞肺癌诊断、评价疗效、判断预后开辟新的方法。

