2例小儿右心房瘤栓取出术的麻醉管理及文献复习*
余 倩,叶 茂,刘 巍,李义辉
(重庆医科大学附属儿童医院麻醉科/儿科学重庆市重点实验室,重庆 400014)
肾母细胞瘤(Wilms' tumor,WT)有着丰富的血供,可侵犯肾静脉形成瘤栓,可以沿下腔静脉向上延伸至肝上水平和右心房,甚至经三尖瓣扩展进入右心室、肺动脉,造成严重的循环障碍,严重时可导致猝死。肾母细胞瘤患儿中累及右心房的瘤栓发病率为2.5%~7.1%[1-4],临床上较为罕见。肾脏肿瘤切除联合瘤栓取出术,需泌尿外科及心胸外科行胸腹联合手术,手术难度大,并发症风险高,麻醉风险极高。目前尚无儿科患者这类病例麻醉管理的相关报道,偶有报道也是成人病例。本院2015年6月至2017年12月,在深低温停循环下完成2例肾脏肿瘤切除及下腔静脉右心房瘤栓摘除术,现将2例患者的救治经验及管理体会结合国内外文献做一回顾。
1 资料与方法
1.1一般资料 本组患儿共2例,均为本院2015-2017年收治的2例肾脏肿瘤伴右心房及下腔静脉瘤栓的患儿,男女各1例,年龄分别为3岁和2岁。根据美国梅奥医学中心Mayo Clinic瘤栓分级标准,将下腔静脉瘤栓分为5级。0级:瘤栓局限于肾静脉;Ⅰ级:瘤栓侵及下腔静脉,但距肾静脉开口小于或等于2 cm;Ⅱ级:距肾静脉开口处大于2 cm,肝静脉水平以下的下腔静脉瘤栓;Ⅲ级:肝内下腔静脉水平至膈肌以下;Ⅳ级:膈肌以上下腔静脉。2例患儿瘤栓分级均为Ⅳ级,且瘤栓累及右心房。2例患儿均行术前化疗。
1.2方法 两例患儿均镇静后行超声引导桡动脉穿刺并测压,再采用快速诱导气管插管,静脉注射咪达唑仑0.05 mg/kg,舒芬太尼1 μg/kg,罗库溴铵0.6 mg/kg,丙泊酚2~2.5 mg/kg,长托宁0.01 mg/kg。连接麻醉机行机械通气,采用PCV~VG模式,吸入空气氧气混合气体,吸入氧浓度35%~40%,气体流量2 L/min,潮气量8~10 L/kg,呼吸频率选择同龄儿童呼吸频率均值,维持气道峰压小于30 mm Hg,呼气末二氧化碳分压(PETCO2) 35~45 mm Hg。麻醉诱导气管插管后行颈内静脉置管。记录术中有创动脉血压(IBP)、心率(HR)、经皮脉搏氧饱和度(SPO2)、中心静脉压(CVP)、动脉血气分析、血栓弹力图(TEG)、鼻咽温、尿量。麻醉维持静脉泵注右美托咪定1 μg/kg·h,丙泊酚4~6 mg/kg·h,舒芬太尼2~3 μg/kg·h,吸入0.5~1.0 MAC七氟烷,罗库溴铵1 mg/kg·h。
1.3体外循环 胸部正中劈开胸骨开胸,全身肝素化(肝素3 mg/kg),主动脉插管、右心房插管建立体外循环,转流降温,鼻咽温24 ℃,阻断主动脉根部灌注冷晶体心肌保护液,头部放置冰帽,待中心体温降至18 ℃时,张肺及挤压肝脏后,将血液泵出体外,留存于体外循环管路的储血器中,停循环。心内探查及取出瘤栓后重新建立体外循环,复温及撤除冰帽,头低位排气,开放主动脉,心脏复跳,逐渐降低体外循环(CPB)流量,鼻咽温升至37 ℃,循环稳定,停CPB,鱼精蛋白中和肝素。体外循环中采用α稳态行内环境管理。
2 结 果
2.12例肾脏肿瘤患儿的临床资料及术中情况 见表1。

表1 2例肾脏肿瘤患儿的临床资料
2.2术中情况 2例患儿均先行腹部肿瘤切除术及下腔静脉腹腔段瘤栓取出,术中下腔静脉阻断后血气分析提示pH值降低,代谢性酸中毒,乳酸增高,血红蛋白降低,术中此阶段患儿出血较多,平均动脉压也有下降,但中心静脉压及心率变化不大,见表2、3。

表2 两例患儿术中不同时间点动脉血气变化
*1:病例1;*2:病例2

表3 术中不同时间点血流动力学变化
*1:病例1;*2:病例2
2.3瘤栓 术中心脏探查发现右心房瘤栓(见图1),深低温停循环下将右心房及下腔静脉瘤栓完整取出(见图2)。
2.4术后随访 2例患儿术毕均转运至PICU监护治疗,术后均行标准化疗,病例1目前已随访19个月,已行术后化疗10次恢复良好。病例2目前已随访10个月,已行术后化疗10次,2例患儿均未发现术后新发肿瘤远处转移。
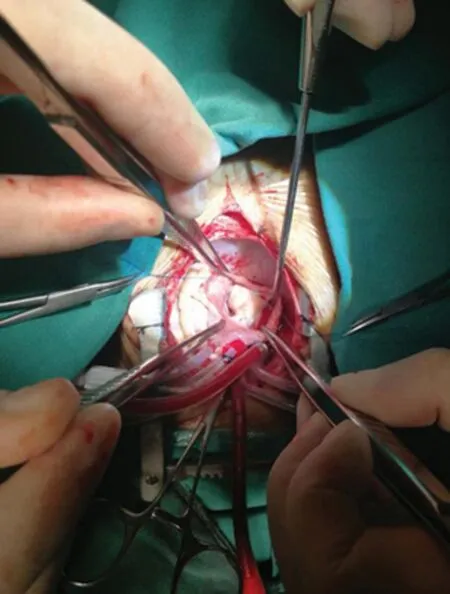
图1 术中探查发现右心房瘤栓
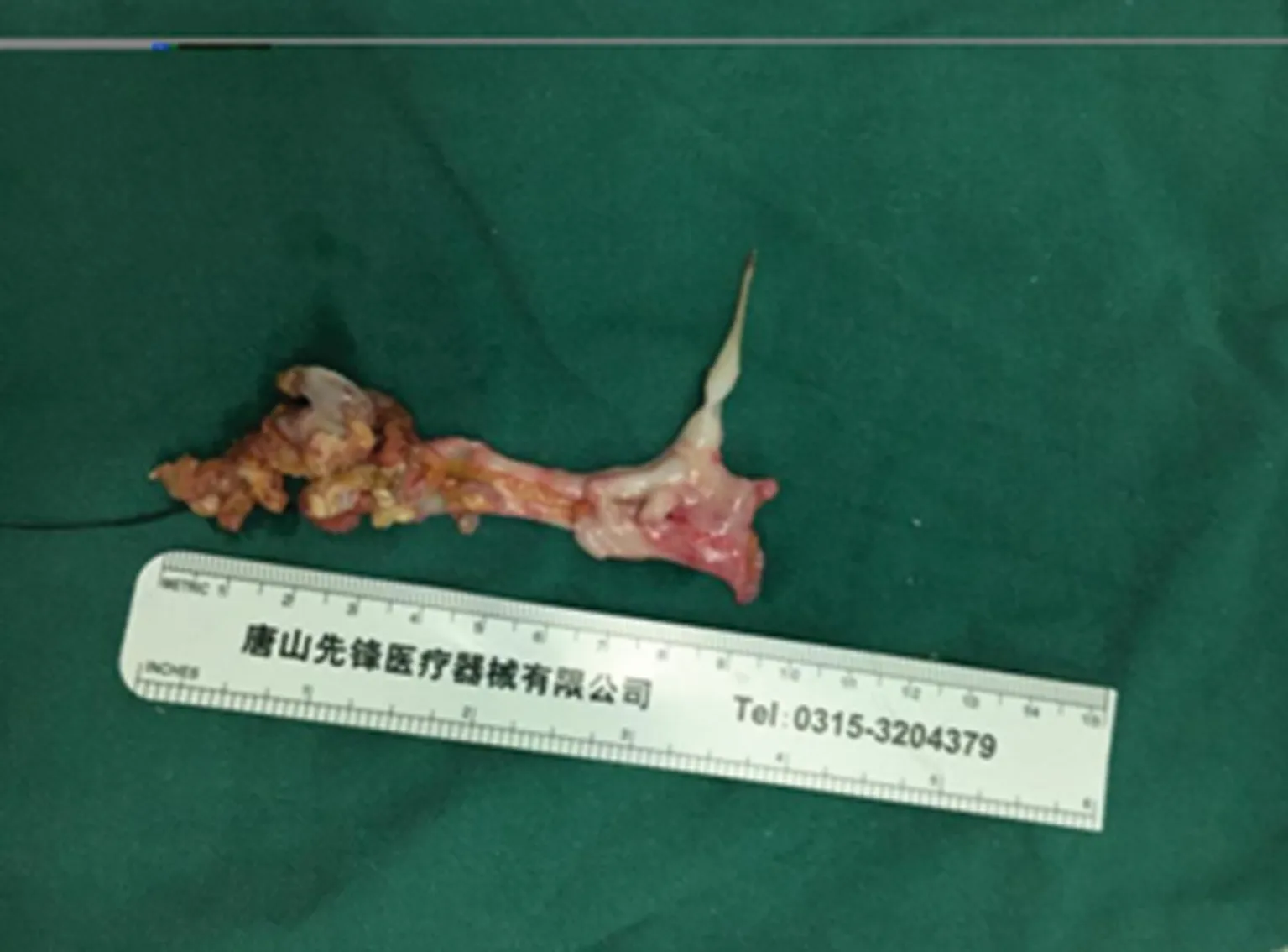
图2 右心房瘤栓完整取出
3 讨 论
肾母细胞瘤切除联合右心房及下腔静脉瘤栓取出术是小儿外科最具挑战的手术之一。为保障手术安全,麻醉医生应对患儿进行全面的术前评估,充分的术前准备。熟悉瘤栓分型及其对手术方式的影响,胸腹部联合手术中关键步骤及术中管理策略,掌握右心系统梗阻等严重并发症发生时的抢救要点。
3.1术前评估 麻醉医生术前评估非常重要,甚至需要科室内部讨论制订安全可行的麻醉预案。该类患者一旦确诊,大部分需行术前化疗,因此麻醉医生必须评估患者化疗后瘤栓大小、位置及侵犯程度,瘤栓活动度,最重要是评估患儿有无右心系统梗阻的临床表现,如气促、呼吸困难及特殊体位等,评估患儿血流动力学有无受到影响。本研究中2例患儿术前CT及心脏超声结果均显示瘤栓侵及右心房,但尚未侵及三尖瓣。因此术前2例患儿并未出现右心系统血流动力学受阻的临床表现。
3.2麻醉诱导 诱导前抽取去氧肾上腺素备用,镇静后予以动脉穿刺监测有创血压,采用静脉快速诱导气管插管待患儿入睡后超声引导下行颈内静脉置管,导丝置入深度不可过深,以免导丝刺破瘤栓发生栓子脱落。若诱导后发生低血压,应当积极纠正,予以补液、扩容和(或)缩血管药物泵注。麻醉诱导时外科医生必须在场,一旦发生紧急情况可立即手术建立体外循环。若患儿术前有右心系统阻塞的表现,麻醉诱导后由于麻醉药物作用,加重了右心流入流出道的阻塞,发生不可纠正的缺氧,此时应当采取头低脚高位,并且避免使用正性肌力药物。因为该类药物会进一步加重右心梗阻症状,同时予以补液、扩容及缩血管治疗,改善症状,若经上述治疗无明显缓解甚至发生心率减慢、心律失常甚至心脏骤停,应当立即开胸建立体外循环保障患儿生命安全。
3.3术中管理 本研究中,2例患儿术中均先行腹部正中向患侧延伸的横切口,术中游离肿瘤与周围组织,钳夹肾蒂动静脉血管,完成切除肿瘤及残肾,瘤床纱垫压迫止血。再阻断瘤栓侧肾静脉及下腔静脉,并切开下腔静脉取出瘤栓。往往在游离肾静脉及切开下腔静脉时会出现迅速而大量的出血,而儿童循环血容量不及成人,对失血更不易耐受,因此需麻醉医生快速准确评估失血量及出血速度,并及时输血,术中及时泵注血管活性药物以维持重要脏器有效灌注压。更为重要的是,在分离肝下下腔静脉瘤栓时,有可能发生瘤栓栓子脱落并随下腔静脉血流流入右心房,甚至肺栓塞,临床上虽极其罕见,但是一旦发生死亡率极高。另一种较为罕见的情况是空气栓塞,据报道[5]曾有患者术中下腔静脉巨大切口导致空气栓塞使患儿术中发生死亡。因此在腹部瘤栓剥离过程中,麻醉医生应当密切关注患儿有无右心系统梗阻表现如术中呼气末二氧化碳波形、氧饱和度、心电图等。一旦发生变化应立即告知外科医生及体外循环医生必要时暂停腹部手术改为体外循环。与成人手术方式不同,小儿由于先行切除肿瘤及残肾,再行体外循环切除瘤栓,因此麻醉医生不应当忽略瘤床创面的渗血,尤其是体外循环后由于全身肝素化作用,创面可能持续渗血,需提醒外科医生加强创面止血处理,术中注意观察腹部引流量及其性状。腹部手术结束后,在深低温停循环下行右心房内瘤栓切除。虽然体外循环、深低温会引起凝血功能异常、出血增加、感染等并发症[6-7],但是安全完整地切除瘤栓对于患儿意义更重大。因为有报道右心房瘤栓持续存在的患儿90%最终会发生死亡[8-10],但是切除瘤栓后,其预后与相同组织分型和肿瘤分期的患儿相比,差异无统计学意义[11]。深低温停循环(deep hypothermic circulatory arrest,DHCA)时缺血安全时间可明显延长,头部放置冰帽,降低颅内压和颅脑温度,降低脑氧耗,保护神经功能。为外科医生创造无血的术野,可以良好暴露视野及完整切除瘤栓,避免发生严重并发症及术中意外,因此DHCA又成为该类患儿手术的必然选择。2例患儿停循环时间均未超过60 min,术后随访患儿意识恢复良好,并未发现神经功能损害的临床表现,预后满意。关于术中是否使用血液回收机,一直存在争议,但是术中使用血液回收自体输血可能导致肿瘤细胞播散的理论风险在目前的实验中并未得到证实,可以明确的是使用血液回收机可以减少异体血用量[12]。本组中使用血液回收机的患儿输血量少于未使用者。AKCHURIN等[13]观察了联合应用体外循环和血液回收机术后肿瘤细胞血行转移情况,手术结束后对过滤器的内外表面及回收血进行细胞学监测,结果仅在过滤器的内表面发现肿瘤细胞,在过滤器外表面及清洗过的回收血内均未见肿瘤细胞。本研究中2例患儿术后并无新发肿瘤远处转移。另一方面,患儿瘤栓长期浸浴在血液循环系统内,也可能存在瘤细胞的播散风险,但是可以选择在腹部手术阶段,肿瘤切除及瘤栓剥离过程中暂停血液回收,待腹腔冲洗后再行血液回收,尽可能减少瘤细胞播散的潜在风险。
经食道超声(TEE)可以在术前评估瘤栓位置、大小及有无梗阻,帮助外科医生制订术中方案[14-15],术后评估手术效果,发现问题,评估心脏功能,维持循环稳定。虽然本组患儿手术时本科TEE技术尚在萌芽阶段,但是随着TEE技术逐渐成熟,今后该类手术TEE的参与肯定会给外科决策和麻醉管理带来更科学的循证依据。
综上所述,对于累及右心房的瘤栓的肾母细胞瘤儿科患者,做好充分的术前评估及准备,改善麻醉管理水平是提高手术麻醉安全,体外循环中做好重要脏器保护,是减少意外事件及并发症发生的关键所在。因国内累及右心房的瘤栓的儿童患者较少,关于麻醉管理方面的临床相关报道更是少见,搜索相关文献回顾内容资料不足。因此本文主要介绍了笔者对深低温停循环下右心房瘤栓取出术的麻醉管理的临床经验。

