过表达Homer1a对神经元机械性损伤模型的保护作用及可能机制*
王 远, 何主强, 罗 明, 黄从刚, 宋 平, 王孟阳, 段发亮
(武汉市第一医院神经外科, 湖北 武汉 430022)
创伤性脑损伤(traumatic brain injury, TBI)是一类具有高致残率和致死率的疾病,TBI之后的继发性脑损伤引起的神经炎症及氧自由基等可促进caspase依赖的细胞凋亡,导致大量神经元细胞凋亡,最后引起神经功能严重受损[1-3],因此,减少凋亡所引起的细胞死亡及功能障碍,促进损伤神经元的再生增殖,是目前TBI研究的热点问题。突触后膜骨架蛋白Homer1a是一种存在于中枢神经系统中的信号转导蛋白,参与调控抑郁症和癫痫等多种神经性疾病的发生和发展,是目前研究最为广泛的Homer蛋白[4-6]。研究表明,神经损伤后Homer1a蛋白表达量会发生特异性变化,是一种反映神经损伤的新型敏感指标[7]。AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种主要由神经元合成的丝氨酸/苏氨酸激酶,细胞能量代谢发生障碍可激活AMPK磷酸化,磷酸化的AMPK可通过介导多条信号通路参与神经元修复过程[8-10]。但Homer1a如何通过磷酸化的AMPK对机械性损伤的神经元细胞起到保护作用,其机制目前尚不明确。因此,本研究拟通过体外培养大鼠皮层神经元,构建神经元机械性损伤模型,并采用基因编辑技术过表达Homer1a蛋白水平,初步探讨过表达Homer1a蛋白对神经元机械性损伤模型的保护作用及其对AMPK蛋白表达的影响。
材 料 和 方 法
1 实验材料与试剂
清洁级Sprague-Dawley (SD)大鼠,雌性,孕16~17 d,由湖北省疾控中心提供,合格证号No.42000600029456;皮层神经元从胎鼠大脑皮层提取。DMEM培养液和Neurobasal培养液(Gibco);兔单克隆Homer1a抗体、兔多克隆cleaved caspase-3抗体、兔单克隆Bax抗体、兔单克隆Bcl-2抗体、兔单克隆AMPKα抗体和兔单克隆磷酸化AMPKα(p-AMPKα)抗体(Abcam);兔多克隆GAPDH抗体和小鼠抗兔IgG抗体(Bioswamp);M-MLV反转录试剂盒(Invitrogen);SYBR Green PCR试剂盒(KAPA Biosystems);Annexin V-FITC/PI细胞凋亡检测试剂盒和RIPA蛋白裂解液(上海碧云天生物技术有限公司);乳酸脱氢酶(lactate dehydrogenase, LDH)检测试剂盒(南京建成生物工程研究所)。
2 方法
2.1 大鼠脑皮层神经元的分离培养 取孕16~17 d SD大鼠,常规消毒后腹腔注射戊巴比妥钠(120 mg/kg)进行麻醉后,暴露腹腔,快速取出大鼠子宫置于无菌台上消毒过的培养皿中,分离胎鼠大脑皮层,吸入于预冷的PBS中,仔细去除脑皮层表面脑膜及细小血管组织,PBS清洗1遍后,将脑皮质小心剪碎,逐滴缓慢加入预热至室温的0.1%胰蛋白酶,置于37 ℃培养箱中消化20 min。随后将消化后的组织块转移到含有10%FBS的DMEM培养液中,小心多次吹打细胞成匀浆后离心,去掉上清液,使用含FBS的DMEM重悬细胞沉淀,显微镜下计数,调整细胞浓度,将5×108/L细胞接种至铺有多聚赖氨酸的培养皿中,置于37 ℃、5% CO2恒温恒湿培养箱中培养。24 h后弃去培养液,小心洗涤细胞后,用含有10% B27的Neurobasal培养液培养细胞,每3 d半量换液。培养6~8 d,经细胞鉴定成功后,用于后续实验。
2.2 离体神经元机械性损伤模型的建立 取10 μL的微量移液器塑料枪头在培养皿内划割神经元,横竖各划8道,划伤道宽度约为1 mm,标记线均匀分布在培养皿表面,造成神经元机械性损伤[11],对神经元细胞进行台盼蓝染色及LDH含量测定,以保证同一组内神经元损伤程度和范围一致。
2.3 实验分组 待神经元培养成功后,以每孔5×104的密度将神经元接种至24孔培养板,待细胞生长融合度达70%左右时,采用Homer1a过表达慢病毒载体(pLVX-IRES-ZsGreen1-expHomer1a,购于上海汉恒生物科技有限公司,下文记作Exp-Homer1a)及相应的空载体按照感染复数为20进行细胞感染,置于培养箱中培养,24 h后更换培养液,继续培养24~48 h备用。本实验分为4组,分别为对照(control)组、模型(model)组、空载(empty vector)组和Exp-Homer1a组。对照组为正常神经元;模型组按照上述方法构建神经元机械性损伤模型;空载组和Exp-Homer1a组是在神经元机械性损伤模型中转载空载体和Homer1a过表达慢病毒载体。
2.4 qPCR检测Hormer1a mRNA表达水平 收集各组细胞沉淀,TRIzol法提取各组神经元总RNA,根据M-MLV反转录试剂盒说明书反转录成cDNA。随后以cDNA作为模板,采用SYBR Green PCR试剂盒进行Real-time PCR扩增反应。Hormer1a上游引物序列为5’-CACCCGATGTGACACAGAACTC-3’,下游引物序列为5’-TGATTGCTGAATTGAATGTGTACCT-3’。GAPDH上游引物序列为5’-CAAGTTCAACGGCACAG-3’,下游引物序列为5’-CCAGTAGACTCCACGACAT-3’。以GAPDH作为内参照,采用2-ΔΔCt方法计算各组之间Hormer1a的表达差异。
2.5 MTT检测细胞增殖活性 将各组细胞置于96孔板内,每孔加入终浓度为0.5 g/L MTT溶液,继续培养4 h。小心吸出培养液,每孔加入750 μL DMSO,低速震荡摇床中混匀10 min,然后取出150 μL溶液置于96孔板内,采用酶标仪测定490 nm处光吸光度(A),计算各组细胞相对活力,细胞相对活力(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
2.6 LDH活性检测 各组细胞处理结束后,留取各组培养液上清,依据LDH检测试剂盒说明书测定各组细胞培养上清中LDH活性。
2.7 流式细胞术检测凋亡 收集各组细胞的培养液上清,采用0.2%胰蛋白酶(不含EDTA)消化处理制备单细胞悬液,与培养液上清一起收集至15 mL离心管内。200×g室温离心5 min,去除上清,采用预冷的PBS清洗细胞2次,弃去上清。加入适量Annexin V-FITC结合液重悬细胞,各取100 μL细胞悬液置于1.5 mL离心管中,依次加入5 μL Annexin V-FITC和10 μL PI染液,设置单染管和双染管,轻轻混匀后置于25℃水浴中避光孵育15 min。然后加入适量Annexin V-FITC结合液,混匀后置于冰上终止反应。直接采用流式细胞仪检测荧光信号。
2.8 Western blot检测Hormer1a、cleaved caspase-3、Bax、Bcl-2和p-AMPK蛋白表达 收集各组细胞沉淀,加入适量RIPA蛋白裂解液提取神经元总蛋白,采用BCA法测定蛋白浓度。每孔上样20 μg蛋白,经12% SDS-PAGE后,采用湿转法将分离蛋白转移至PVDF膜上,置于5%脱脂牛奶(TBST配制)中室温封闭1.5 h;TBST洗膜后将膜放入自封袋中,分别加入抗Homer1a、cleaved caspase-3、Bax、Bcl-2、p-AMPK、AMPK以及GAPDH抗体的稀释液,于4℃孵育过夜,TBST洗膜3次后加入小鼠抗兔IgG抗体稀释液,室温孵育1.5 h。TBST洗膜3次,HRP显色液显色,全自动化学发光分析仪检测。使用ImageJ软件分析蛋白条带灰度值,将目的蛋白灰度值与GAPDH蛋白灰度值的比值以及p-AMPK蛋白灰度值与AMPK蛋白灰度值的比值作为各目的蛋白相对表达量。
3 统计学处理
采用统计学软件SPSS 22.0进行数据分析,实验数据采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,以P<0.05表示差异具有统计学意义。
结 果
1 各组神经元Homer1a表达
采用qPCR和Western blot分别检测各组神经元中Homer1a的表达,结果显示,模型组神经元中Homer1a的mRNA和蛋白表达水平均显著高于对照组神经元(P<0.05);Exp-Homer1a组神经元中Homer1a的mRNA和蛋白表达水平均显著高于模型组和空载组神经元(P<0.05),见图1、2,表明神经元转染过表达Homer1a载体成功,可用于后续实验。

Figure 1. Relative protein expression of Homer1a was determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图1 各组神经元Homer1a的蛋白表达
2 过表达Homer1a可提高机械性损伤神经元的活力
过表达Homer1a后,MTT检测各组细胞活力,结果显示,与对照组相比,模型组神经元活力显著降低(P<0.05);与模型组相比,Exp-Homer1a组神经元活力显著升高(P<0.05),空载组与模型组神经元活力之间的差异无统计学意义,见图3。
3 过表达Homer1a可降低机械性损伤神经元上清液的LDH活性
LDH活性检测结果显示,与对照组相比,模型组LDH活性显著升高(P<0.05);与模型组相比,Exp-Homer1a组LDH活性明显降低(P<0.05),见图4。

Figure 2. Relative mRNA expression of Homer1a was detected by qPCR. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图2 各组神经元Homer1a的mRNA表达
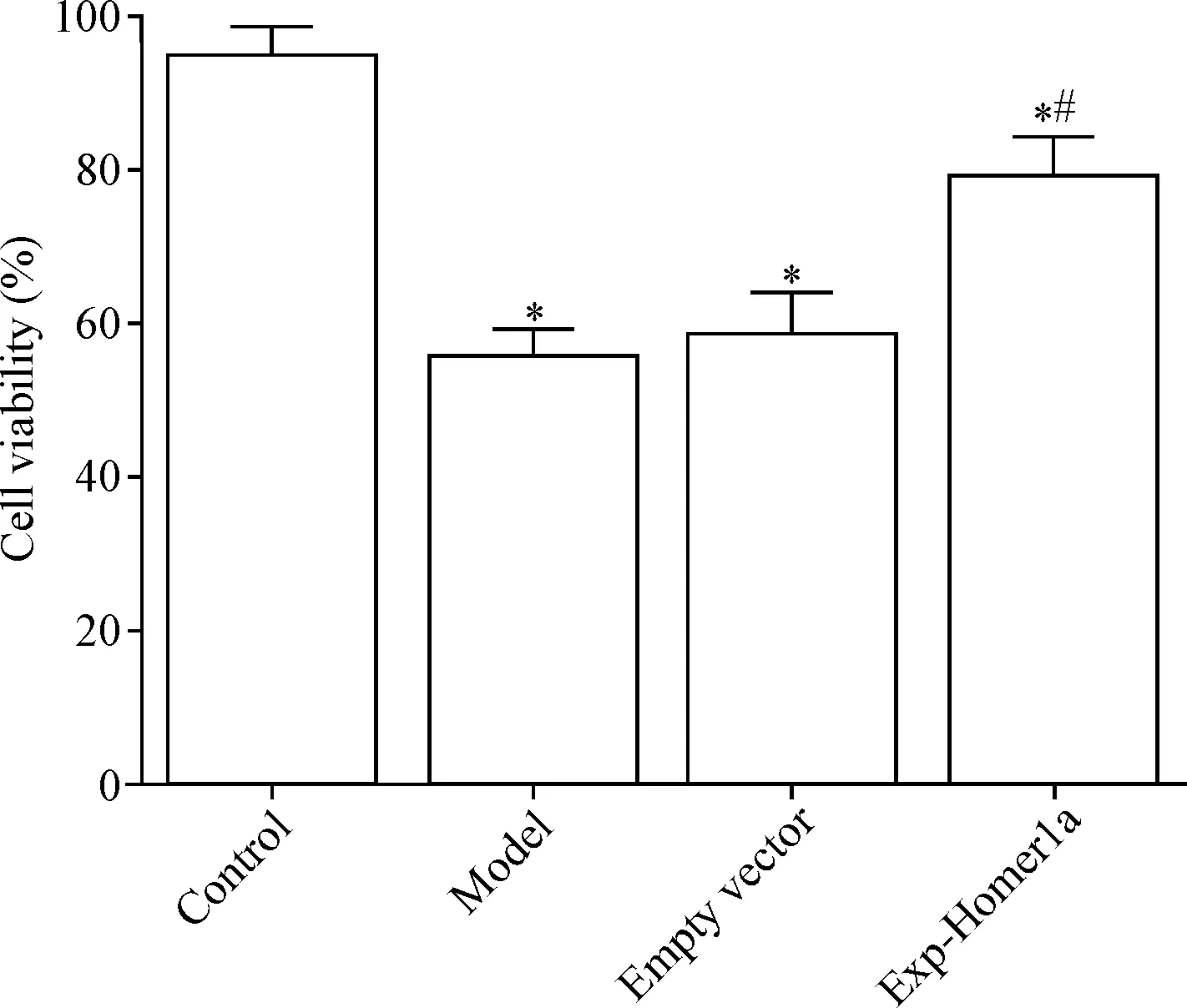
Figure 3. The neuronal viability was detected by MTT assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图3 MTT检测各组神经元活力
4 过表达Homer1a可降低机械性损伤神经元的凋亡率
在神经元机械性损伤模型中过表达Homer1a后,流式细胞术检测各组神经元凋亡情况以及Wes-tern blot检测各组神经元凋亡相关蛋白的表达,结果显示,与对照组比较,模型组神经元中cleaved caspase-3和Bax的表达水平显著升高(P<0.05),Bcl-2的表达水平显著降低(P<0.05),细胞凋亡率显著升高(P<0.05);与模型组比较,Exp-Homer1a组神经元中cleaved caspase-3和Bax的表达水平明显降低(P<0.05),Bcl-2的表达水平显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),见图5。
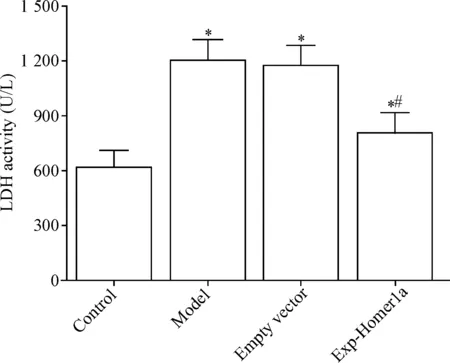
Figure 4. LDH activity in the supernatant of neurons. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图4 各组神经元上清液中LDH活性
5 过表达Homer1a可促进机械性损伤神经元中AMPKα蛋白的表达
与对照组比较,模型组p-AMPKα表达水平升高;与模型组比较,Exp-Homer1a组p-AMPKα表达水平显著升高(P<0.05),见图6。
讨 论
在哺乳动物中,Homer蛋白家族由Homer1、Homer2和Homer3三种亚型及其剪切体组成,属于突触后致密物质家族的重要成员,主要分布在中枢神经系统中,参与神经元多种生理病理过程[12]。当神经元兴奋性增强时,Homer1a的表达迅速上升,可调控突触功能[13]。研究表明,过表达Homer1a可增强大鼠海马的突触传递及细胞内Ca2+内流[14]。在重型颅脑损伤大鼠脑组织海马区,Homer1a表达显著增加,且在损伤6 h后出现最高峰[15]。本研究结果表明,机械性损伤的神经元中Homer1a的mRNA和蛋白表达水平均显著高于正常神经元,且过表达Homer1a可激活AMPKα的磷酸化,提高机械性损伤神经元存活率。
LDH是参与机体能量代谢的一种重要的酶,广泛存在于各种组织器官细胞的胞质中,细胞受损后LDH被释放到胞外。研究表明神经系统损伤后,脑脊液中LDH水平升高,与神经系统损伤程度呈正相关,因此,LDH释放能精确地反映神经元损伤状况[16]。神经元损伤时细胞能量代谢障碍、氧自由基释放增多会促进细胞中促凋亡因子Bax和Bad等的释放,抑制抑凋亡因子Bcl-2的释放,激活线粒体凋亡通路,最终使caspase-3切割活化,导致细胞凋亡[17]。本研究表明,过表达Homer1a能显著降低机械性损伤神经元中LDH活性,降低cleaved caspase-3和Bax的表达水平,升高Bcl-2的表达水平,有效抑制神经元凋亡。AMPK在机体正常生理状态下无活性,而当机体出现能量代谢障碍时,AMPK的α亚单位中的第485位丝氨酸、第172和258位苏氨酸等均可发生磷酸化,其中第172位苏氨酸及其磷酸化对AMPK活性和功能的调节起重要作用[18]。电针预处理可使脑缺血再灌注小鼠海马中p-AMPKα的表达升高,可通过抑制细胞氧自由基的产生及Bax合成,增加细胞超氧化物歧化酶生成,增强细胞抗氧化能力,从而清除氧自由基,减少海马神经元细胞的凋亡[19]。本研究结果显示过表达Homer1a可升高机械性损伤神经元中p-AMPKα的表达,提示过表达Homer1a对机械性损伤神经元的保护作用与促进AMPKα磷酸化的激活有关。

Figure 5. Effect of over-expression of Homer1a on neuronal apoptosis induced by mechanical injury. A: the protein levels of cleaved caspase-3, Bax and Bcl-2 were detected by Western blot; B: the apoptotic rate of each group was detected by flow cytornetry. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图5 过表达Homer1a对机械性损伤诱导神经元凋亡的影响
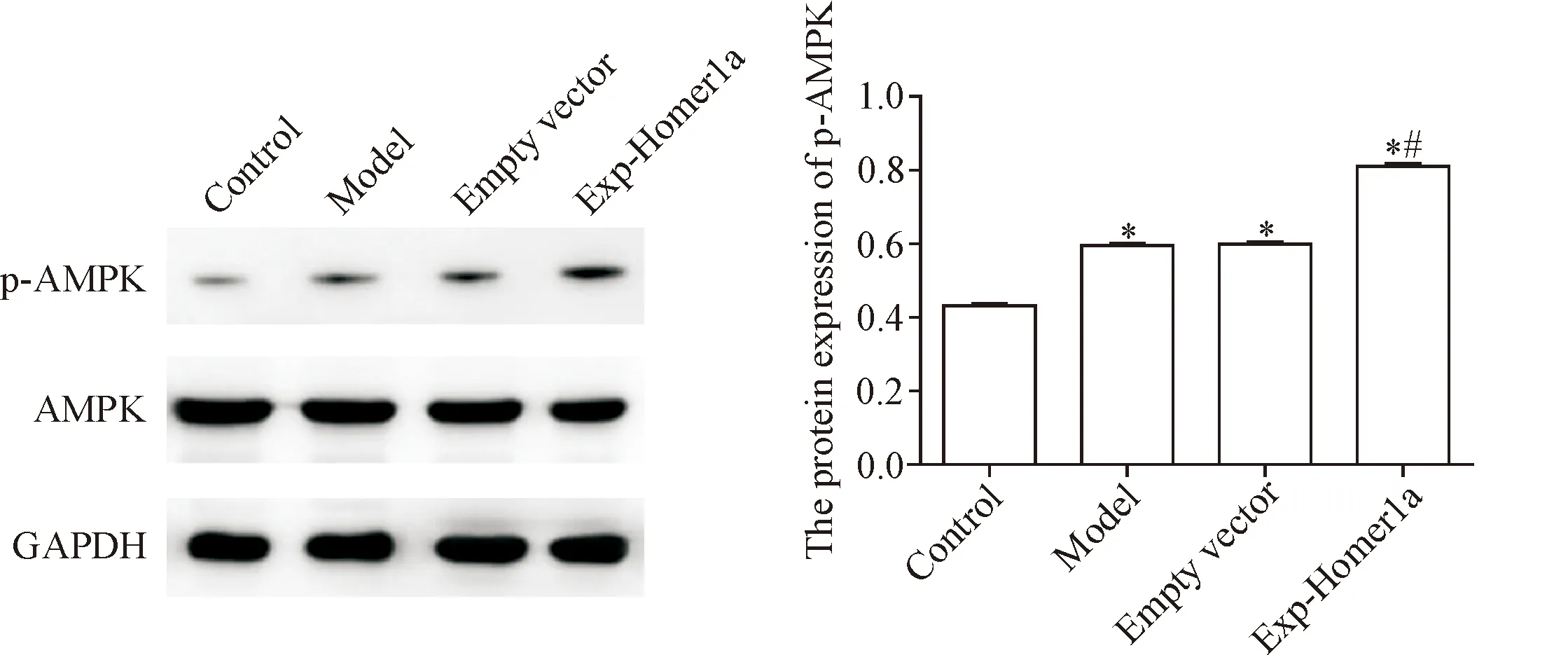
Figure 6. The effect of over-expression of Homer1a on p-AMPKα protein level. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图6 过表达Homer1a对机械性损伤神经元p-AMPKα表达的影响
综上所述,过表达Homer1a对机械性损伤神经元的保护作用,可能与通过促进AMPKα磷酸化,减少cleared caspase-3及Bax的表达,降低神经元LDH的活性有关。

