lncRNA-MIAT在高糖诱导血管平滑肌细胞活力增加中的作用*
王 峥, 胡 芳, 孙 莹, 陈杨丽
(中山大学附属第五医院内分泌与代谢病科, 广东 珠海 519000)
大血管病变是糖尿病患者常见的并发症,也是引起患者死亡和致残的主要因素之一[1]。糖尿病引起的大血管病变是一个复杂的病理生理学过程,其中各种损伤因素造成的血管平滑肌细胞(vascular smooth muscle cells,VSMC)过度增殖是血管粥样硬化形成、血管壁增厚、 管腔狭窄、 血管顺应性降低及血管重构的重要环节[2]。虽然已经明确高血糖是引起VSMC过度增殖的因素之一,但其具体的分子生物学机制还有待进一步研究。近期研究显示,长链非编码RNA心肌梗死相关转录本(long non-coding RNA myocardial infarction associated transcript,lncRNA-MIAT)在糖尿病引起的血管病变中扮演重要角色,参与调控血管内皮细胞的功能[3]。但lncRNA-MIAT是否在高糖引起的VSMC细胞活力异常中发挥调控作用还未见报道。另一方面,本研究通过生物信息学预测发现微小RNA-145(microRNA-145, miR-145)可能受lncRNA-MIAT的调控,而microRNA-145被证明是调控VSMC活力及增殖的重要分子[4]。因此本研究假设lncRNA-MIAT可以通过调控microRNA-145参与高糖引起的VSMC活力异常,并设计体外实验加以验证,现报道如下。
材 料 和 方 法
1 主要试剂
清洁级SD大鼠(雌雄不限,体质量200 g左右),由中山大学实验动物中心提供,动物合格证号为SCXK(粤)2016-0029。DMEM培养基、胎牛血清、Lipofectamine 2000试剂盒、Lipofectamine RNAiMAX、TRIzol试剂和TaqManTMAdvanced miRNA cDNA合成试剂盒均购自赛默飞世尔科技(中国)有限公司;SYBR® Premix Ex TaqTM购自宝生物工程(大连)有限公司;pcDNA3.1-MIAT真核表达质粒、microRNA-145模拟序列(miR-145 mimic)、microRNA-145抑制序列(miR-145 inhibitor)及无关序列均购自广州锐博生物;CellTiter-Blue试剂盒和双萤光素酶报告基因质粒及双萤光素酶报告基因检测系统购自上海普洛麦格生物产品有限公司;microRNA-145和U6的引物购自QIAGEN。
2 方法
2.1 大鼠主动脉VSMC的分离及培养 大鼠经腹腔注射50 mg/kg戊巴比妥钠进行麻醉,无菌条件下剪开腹腔和胸腔,取出主动脉,体视显微镜下分离取出血管中膜组织,充分剪碎获取的中膜组织。将剪碎的组织置入含20%胎牛血清的DMEM培养基中,于37 ℃、5% CO2培养箱中竖直放置5 h,待组织黏附后,平放细胞培养瓶,继续培养。每3 d换液1次,当组织块周围细胞融合达到80%左右时常规传代,取2代后的细胞进行鉴定,确认为血管平滑肌细胞后进行后续实验操作。非高糖处理的细胞进行常规培养(培养基葡萄糖浓度为5 mmol/L),需进行高糖处理的细胞培养于葡萄糖浓度为25 mmol/L的培养基中。
2.2 细胞的体外转染 通过向VSMC转染pcDNA3.1-MIAT真核表达质粒和MIAT小干扰RNA(MIAT small interfering RNA,MIAT-siRNA)分别实现细胞内lncRNA-MIAT的过表达和沉默。通过向VSMC转染miR-145 mimic和miR-145 inhibitor分别实现细胞内microRNA-145的过表达和沉默。质粒的转染采用Lipofectamine®2000试剂进行,同时使用pcDNA3.1空质粒作为转染对照。MIAT-siRNA、microRNA模拟序列及抑制序列的转染采用Lipofectamine®RNAiMAX试剂。使用转染无关序列的细胞作为转染对照。
2.3 细胞分组 根据是否进行高糖刺激及转染处理的不同,将细胞分为非高糖培养(non-high glucose)组和高糖培养(high glucose)组; 非高糖培养组再分为3个亚组,包括阴性转染对照(negative transfection control)亚组、转染pcDNA3.1-MIAT亚组及pcDNA3.1-MIAT+miR-145 mimic共转染亚组;高糖培养组也分为3个亚组,包括阴性转染对照亚组、转染MIAT-siRNA亚组及MIAT-siRNA+ miR-145 inhibitor共转染亚组。
2.4 RT-qPCR实验 使用TRIzol试剂提取各组细胞样本中的总RNA。mRNA的反转录采用PrimeScriptTMRT 试剂盒。反转录结束后,对cDNA的进行定量扩增,试剂盒选用SYBR® Premix Ex TaqTM,标准化采用GAPDH。MicroRNA的反转录采用TaqManTMAdvanced miRNA cDNA合成试剂盒,反转录结束后使用miScript SYBR Green PCR 试剂盒对cDNA进行荧光定量扩增,标准化采用U6。获取循环阈值(cycle threshold,Ct)之后采用2-ΔΔCt法进行计算目的基因的相对水平。lncRNA-MIAT的上游引物序列为5’-ATCCTCGAGACAAAGAGCCCTCTGCACTAG-3’,下游引物序列为5’-ATCGGATCCGAGCAAATGGAGACAAAGGAC-3’;GAPDH的上游引物序列为5’-CATGTTCGTCATGGGGTGAACCA-3’,下游引物序列为5’-AGTGATGGCATGGACTGTGGTCAT-3’。 MicroRNA-145及U6均采用商品化的miScript引物。
2.5 细胞活力实验 将各组细胞以每孔5 000个的密度种植于96孔板,于种植后24 h及72 h分别使用CellTiter-Blue试剂盒测定各组细胞573 nm波长处的吸光度(A)值,并根据公式计算72 h时点相对于24 h时点的细胞活力相对变化。细胞相对活力(%)=72 hA值/24 hA值×100%。
2.6 生物信息学分析及双萤光素酶报告基因实验 使用miRcode lncRNA-microRNA互作预测系统预测lncRNA-MIAT与microRNA-145的结合能力,寻找两者可能互补结合的区域。为验证生物信息学分析的结果,采用双萤光素酶报告基因实验确认lncRNA-MIAT与microRNA-145的结合能力:首先构建不含任何突变的野生型lncRNA-MIAT萤光素酶报告基因质粒,命名为pmirGro-MIAT-WT;同时对lncRNA-MIAT中上述生物信息学预测到的结合区域进行突变,构建突变型lncRNA-MIAT萤光素酶报告基因质粒,命名为pmirGro-MIAT-MUT,使用microRNA-145 mimic(同时使用无关序列作为阴性对照)与上述2种萤光素酶报告基因质粒共转染VSMC,随后采用双萤光素酶报告基因检测系统测定转染后细胞的相对萤光素酶活性。
3 统计学分析
统计学分析采用R语言,所有数据以均数±标准差(mean±SD)的形式表示。两组间的均数差异比较采用独立样本t检验;多组间均数差异的比较采用单因素方差分析,随后采用Bonferroni校正的t检验进行两两比较。以P<0.05为差异具有统计学意义。
结 果
1 高糖刺激引起大鼠VSMC中lncRNA-MIAT的增高及microRNA-145水平的降低
非高糖培养组细胞lncRNA-MIAT的相对水平为1.00±0.02,高糖培养组的lncRNA-MIAT相对水平为2.26±0.15,较非高糖培养组显著升高(P<0.01)。非高糖培养组细胞microRNA-145的相对水平为1.00±0.05,高糖培养组的microRNA-145相对水平为0.61±0.09,较非高糖培养组显著降低(P<0.01),见图1。该结果提示高糖刺激可以引起lncRNA-MIAT水平的升高,但是会抑制microRNA-145的表达。

Figure 1. The changes of lncRNA-MIAT and microRNA-145 le-vels in the VSMC cultured in non-high glucose and high glucose media. Mean±SD.n=5.**P<0.01vsnon-high glucose group.
图1 非高糖培养及高糖培养后的血管平滑肌细胞lncRNA-MIAT和microRNA-145水平的变化
2 lncRNA-MIAT通过调控microRNA-145促进大鼠VSMC活力
对于非高糖培养的VSMC,与阴性转染对照亚组相比,转染pcDNA3.1-MIAT亚组72 h的细胞相对活力显著升高(P<0.01)。对于高糖培养的VSMC,与阴性转染对照亚组相比,转染MIAT-siRNA亚组72 h的细胞相对活力显著降低(P<0.01)。高糖培养组的阴性转染对照亚组的细胞相对活力显著高于非高糖培养组的阴性转染对照亚组(P<0.01)。更为重要的是,在非高糖培养组中,pcDNA3.1-MIAT+miR-145 mimic共转染亚组的细胞相对活力显著低于转染pcDNA3.1-MIAT亚组(P<0.01);在高糖培养组,MIAT-siRNA+ miR-145 inhibitor共转染亚组的细胞相对活力显著高于转染MIAT-siRNA亚组(P<0.01),见图2、3。上述结果提示高糖处理可诱导VSMC活力,lncRNA-MIAT具有促进VSMC活力的作用,而microRNA-145具有抑制VSMC活力的作用,lncRNA-MIAT对VSMC活力的调控依赖于micro-RNA-145的水平。
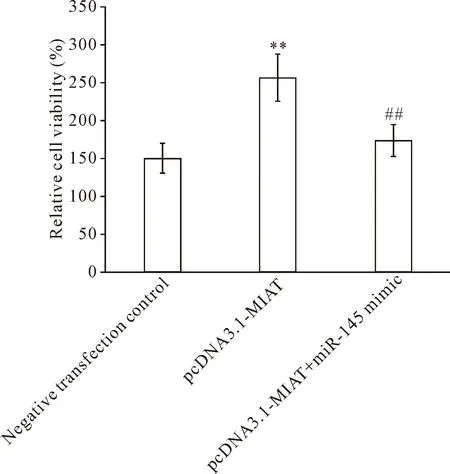
Figure 2. The viability changes of VSMC cultured in non-high glucose medium after transfection. Mean±SD.n=5.**P<0.01vsnegative transfection control group;##P<0.01vspcDNA3.1-MIAT group.
图2 非高糖处理培养的血管平滑肌细胞经转染处理后的细胞活力变化

Figure 3. The viability changes of VSMC cultured in high glucose medium after transfection. Mean±SD.n=5.**P<0.01vsnegative transfection control group;##P<0.01vsMIAT-siRNA group.
图3 高糖培养的血管平滑肌细胞经转染处理后的细胞活力变化
3 lncRNA-MIAT负向调控microRNA-145
RT-qPCR结果显示, 对于非高糖培养的VSMC,与阴性转染对照亚组相比,转染pcDNA3.1-MIAT亚组的microRNA-145相对水平显著降低(P<0.05)。对于高糖培养的VSMC,与阴性转染对照亚组相比,转染MIAT-siRNA亚组的microRNA-145相对水平显著升高(P<0.05),见图4、5。该结果提示lncRNA-MIAT可以抑制microRNA-145的表达。miRcode lncRNA-microRNA互作预测系统的结果提示, lncRNA-MIAT与microRNA-145存在互补结合的区域。双萤光素酶报告基因实验的结果显示,相对于共转染microRNA-145 mimic与pmirGLO-MIAT-MUT质粒的细胞,共转染microRNA-145 mimic与pmirGLO-MIAT-WT质粒的细胞相对萤光素酶活性显著降低(P<0.01),见图6。该结果提示lncRNA-MIAT确实可以与microRNA-145直接靶向结合,可能以“核酸海绵”的形式抑制microRNA-145的表达。
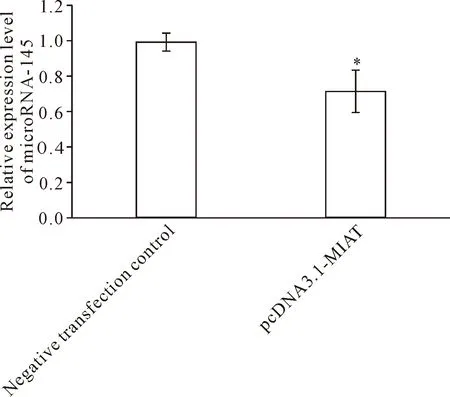
Figure 4. MicroNRA-145 level in VSMC cultured in non-high glucose medium after lncRNA-MIAT over-expression. Mean±SD.n=5.*P<0.05vsnegative transfection control group.
图4 非高糖培养的血管平滑肌细胞中过表达lncRNA-MIAT后的microRNA-145水平
讨 论
糖尿病患者的大血管病变主要以动脉粥样硬化为主,超过80%左右的糖尿病患者的死亡原因与动脉粥样硬化引起的心脑血管事件相关[5-6]。糖尿病患者罹患动脉粥样硬化的风险显著提高且病变较非糖尿病患者来说更加弥漫复杂,预后更差[7]。糖尿病患者高血糖、高胰岛素血症及血脂蛋白代谢紊乱等损伤因素造成的VSMC增殖过度是血管内膜增厚、新生内膜形成、纤维帽子形成及管腔狭窄的主要原因,被认为是糖尿病患者动脉粥样硬化形成的重要病理生理学环节[8-9]。因此采用干预手段防止VSMC的增殖过度可能对糖尿病大血管病变的防治具有重要意义。高血糖是糖尿病患者的共同标志性的特征,且被证实是糖尿病患者发生动脉粥样硬化的一个独立风险因素[10-11],因此探讨高糖引起VSMC过度增殖的机制并设计干预措施的临床意义更为重大。
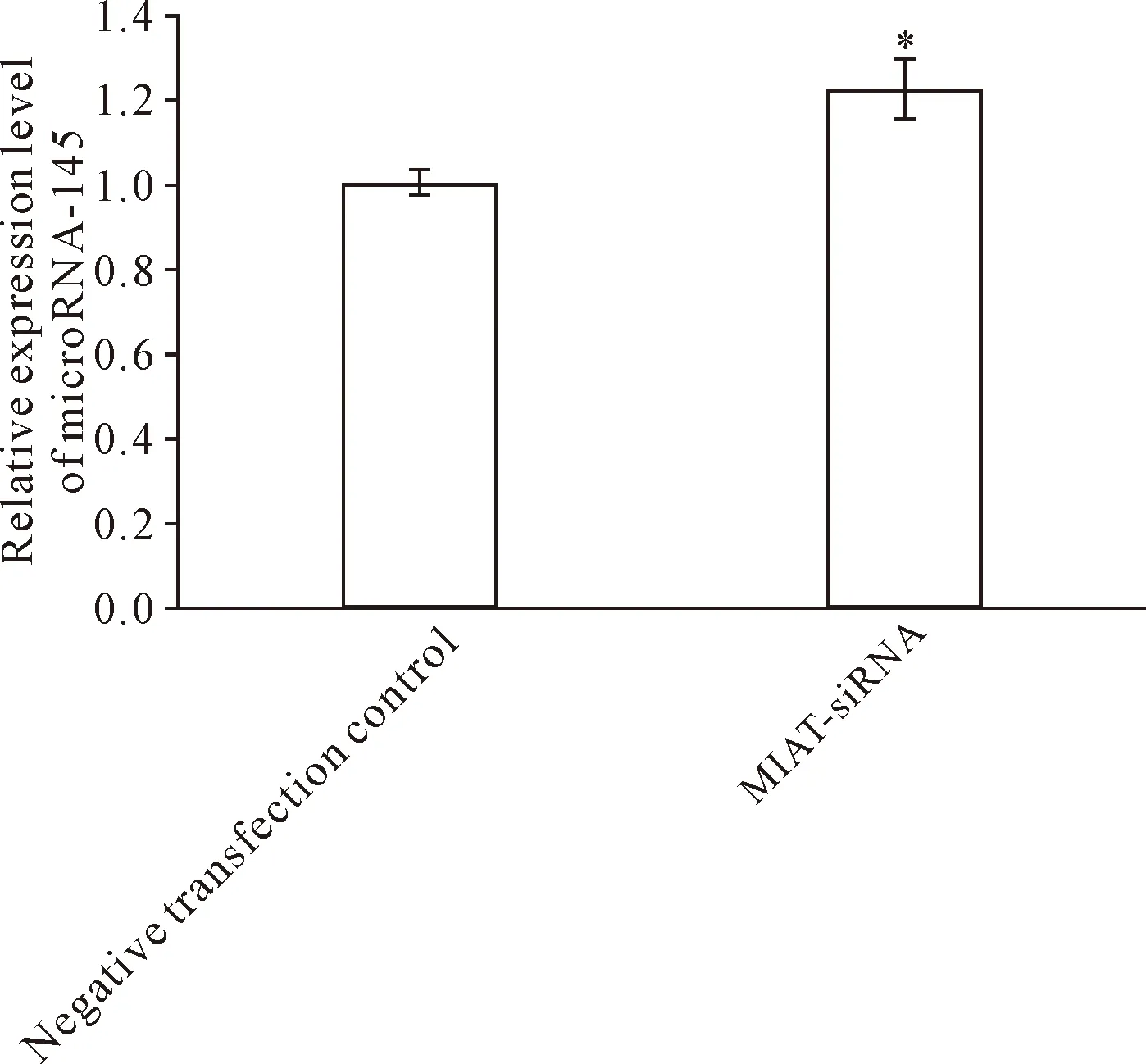
Figure 5. MicroNRA-145 level in VSMC cultured in high glucose medium after lncRNA-MIAT silencing. Mean±SD.n=5.*P<0.05vsnegative transfection control group.
图5 高糖培养的血管平滑肌细胞中沉默lncRNA-MIAT后的microRNA-145水平
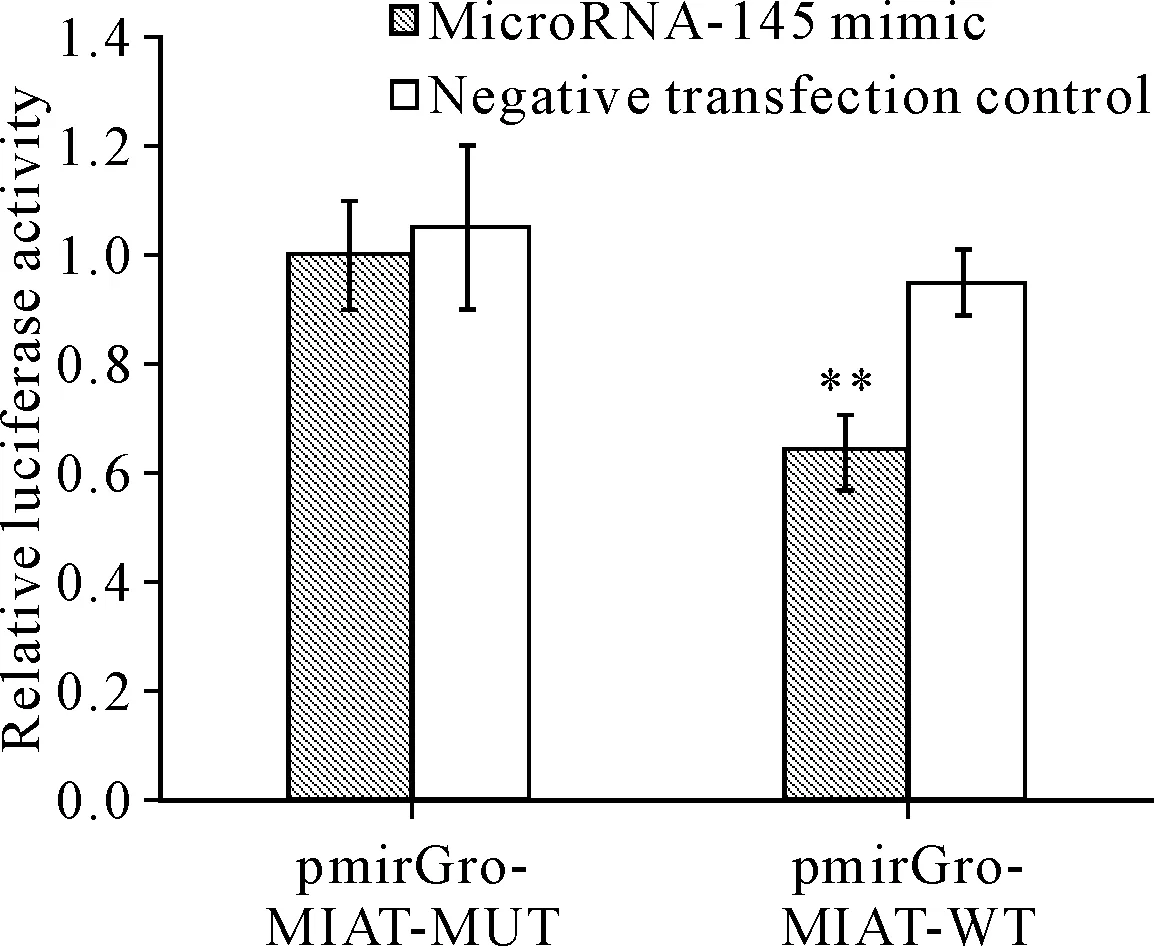
Figure 6. Relative luciferase activity changes of the VSMC detected by dual-luciferase reporter assay. Mean±SD.n=5.**P<0.01vspmirGro-MIAT-MUT.
图6 双萤光素酶报告基因实验中细胞的相对萤光素酶活性变化
lncRNA是一类转录本超过200个核苷酸单位的非编码RNA,虽不编码蛋白质,但在染色质重构、转录调控、转录后调控及蛋白质代谢等方面均发挥重要的作用,因此参与各种疾病的调控[12-13]。本研究主要关注lncRNA-MIAT在高血糖引起的VSMC过度增殖中扮演的角色。lncRNA-MIAT已经被证实参与糖尿病并发的血管病变。如Yan等[3]的研究发现,在糖尿病大鼠模型的视网膜微血管组织中存在lncRNA-MIAT的高表达,在高糖环节培养的血管内皮细胞中也存在lncRNA-MIAT高表达且可以促进血管内皮细胞的功能紊乱。但是还没有研究证实lncRNA-MIAT在是否参与糖尿病患者大血管的病变,且没有研究表明其是否与高糖下VSMC的增殖过度有关。本研究通过体外细胞实验发现,高糖刺激后的大鼠VSMC出现了lncRNA-MIAT的高表达,而敲减细胞内lncRNA-MIAT的表达后,高糖刺激诱导的细胞活力增高作用被减弱。上调非高糖培养环境下VSMC的lncRNA-MIAT后,我们发现细胞的活力增加。因此本研究认为lncRNA-MIAT具有促进VSMC活力的作用,可参与高糖引起的VSMC活力异常。
lncRNA发挥调控作用的机制比较复杂,其中一个较为重要的机制是竞争性内源RNA学说,即lncRNA可以作为“核酸海绵”,吸附相应的可与之互补的microRNA,导致该microRNA的游离分子减少,间接导致该microRNA的靶基因水平发生改变[14]。基于这个学说,本研究认为lncRNA-MIAT可能通过某个microRNA分子发挥作用。通过生物信息学分析我们发现,lncRNA-MIAT可以和若干microRNA分子互补,这些microRNA中包括microRNA-145。之所以进一步关注microRNA-145,是因为已经有研究证实microRNA-145是VSMC中含量最丰富的micro-RNA,不但可以调控VSMC的表型也可以调控其增殖和迁移。有研究指出,高血糖可以抑制VSMC的microRNA-145表达,而microRNA-145本身具有抑制VSMC增殖的作用,因此microRNA-145很可能参与糖尿病引起的血管病变,特别是参与该过程中VSMC的损伤[15]。在生物信息学分析的基础上,本研究通过转染改变了VSMC的lncRNA-MIAT水平,同时检测了microRNA-145的表达变化,结果提示lncRNA-MIAT能够抑制microRNA-145的水平。进一步的双萤光素酶报告基因实验表明lncRNA-MIAT确实可以和microRNA-145互补结合。此外,本研究也发现microRNA-145在高糖刺激的VSMC中低表达,且确实发挥抑制VMSC活力的作用,与既往研究一致。综合这些结果,我们认为lncRNA-MIAT可以通过调控microRNA-145来实现对高糖刺激下VMSC活力的影响。当然,根据竞争性内源RNA学说,lncRNA-MIAT如能对microRNA-145实现调控,则同时能改变microRNA-145靶基因的水平,但本研究没对这些microRNA-145的靶基因进行探讨,这是本研究的缺陷。一些报道证实,microRNA-145参与调控VSMC功能的靶基因主要有MMP-9、KLF4、KLF5、ELK1、肌动蛋白调节蛋白基因、血管紧张素转换酶等。未来研究可以着眼于探讨lncRNA-MIAT对上述基因的调控。
总之,本研究的结果提示lncRNA-MIAT可能通过抑制microRNA-145促进VSMC的活力,这可能是高血糖导致VSMC活力增加的一个机制。靶向抑制lncRNA-MIAT可能有利于糖尿病大血管病变的防治。

