Let-7a-3p靶向IGF1R抑制人肺癌A549细胞中肿瘤干细胞的活性*
吴源周, 王秋平, 肖 丹, 朱亚如, 方 舜△
(南方医科大学珠江医院 1心胸外科, 2病理科, 广东 广州 510280)
肺癌患者术后的复发和转移是影响肺癌患者整体预后的重要因素,也是导致肺癌进展、致死的主要原因,严重影响患者的疗效和生存质量[1]。目前研究表明,肿瘤干细胞(cancer stem cells,CSCs)的激活和增多过程在肺癌等恶性肿瘤的侵袭转移和复发中具有重要作用,因此探寻肺癌干细胞调控的相关分子,开发可以有效抑制肺癌CSCs的治疗手段,对抑制肺癌的复发转移,改善肺癌总体疗效具有重要的临床应用价值[2]。本团队前期研究发现,let-7a-3p可能具有对肿瘤干细胞的确切抑制效果,有望成为肺癌的恶性肿瘤治疗的有效手段[3]。然而,let-7a-3p对肺癌干细胞是否具有确切的抑制效果仍不明确,而且,其抑制肿瘤的起效机制也尚不明确[4]。何晓燕等[5]研究提示,let-7a-3p的同源类似物let-7a能显著抑制肺癌细胞在裸鼠体内的生长能力。这让我们对进一步探讨let-7a-3p在肺癌中的作用及其机制产生了兴趣。Let-7a-3p是一种来自let-7a-1或let-7a-3干环左臂的成熟微小RNA(microRNA,miRNA,miR)。另外,也有报道认为,let-7a-3p也是let-7a-2的成熟miRNA之一,所以也被称为let-7a-2-3p。 所以,let-7a前体经一种核糖核酸内切酶(Dicer酶)进一步加工,转化为成熟的let-7a双链体,随后由真核翻译起始因子Argonaute 3(Ago3)介导产生let-7a-3p。本团队对let-7a-3p的靶基因进行生物信息学预测后发现,与多种恶性肿瘤生物学行为相关的胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)可能是其在肺癌细胞中的作用靶蛋白。本研究首先比较了肺癌细胞与正常支气管上皮细胞中let-7a-3p表达水平的差异,进而采用let-7a-3p模拟物(let-7a-3p mimics)转染人肺癌细胞系A549细胞,观察其对肺癌细胞中CSCs功能和比例的影响,并通过研究其对CSCs相关功能蛋白及IGF1R蛋白表达水平的影响,进一步明确其分子生物学机制。
材 料 和 方 法
1 材料
人肺癌细胞株A549、NCI-H1299、SPC-A1、H1650和HCC-827及人正常支气管上皮细胞株BEAS-2B购自美国模式培养物集存库(American Type Culture Collection,ATCC)。DMEM高糖培养基和胎牛血清购自GIBCO;转染试剂脂质体2000购自Invitrogen;Real-time PCR逆转录-聚合链酶反应试剂盒购自TaKaRa;兔抗人IGF1R、NANOG、OCT4、和GAPDH抗体购自Abcam;let-7a-3p mimics及其阴性对照(negative control mimic)、let-7a-3p及内参照U6的PCR引物购自广州亚科生物技术有限公司;双萤光素酶检验试剂盒、野生型的WT-IGF1R-3’-UTR载体、3’-UTR定点突变后的MT-IGF1R-3’UTR载体及IGF1R过表达质粒购自购自广州松杨生物技术有限公司。
2 方法
2.1 miRNA转染和转染前后各组细胞系中let-7a-3p水平的RT-qPCR检测 以含10%胎牛血清的DMEM高糖培养基常规培养A549、NCI-H1299、SPC-A1、H1650、HCC-827和BEAS-2B细胞。按照转染试剂脂质体2000试剂说明书,在细胞融合度约60%~70%时以miRNA mimics终浓度为75 nmol/L转染let-7a-3p mimics和negative control mimic,分别作为let-7a-3p组和negative control组, 转染48 h;以未转染的A549细胞作为对照(non-transfected)组。提取各组总细胞RNA,逆转录合成cDNA。以U6 作为内参照,进行RT-qPCR检测。PCR条件按照课题组既往报道方法进行,所得数据用2-ΔΔCt法进行分析计算。Let-7a-3p的上游引物序列为5’-GCGCGTAGTCTGAGAGGTTG-3’, 下游引物序列为5’-CCAGGGAGTGTCCGAGGT-3’;U6的上游引物序列为5’-CTCCGGCGCTTAGCACA-3’,下游引物序列为5’-AACTTACGAATCGCTTGCGT-3’。
2.2 瘤球形成实验检测肿瘤干细胞特性 分别取转染后各组肺癌A549细胞,胰酶消化,反复PBS洗涤离心后,采用DMEM高糖培养基重悬制成1×108/L的单细胞悬液。取低吸附6孔板,每孔加入细胞悬液2 mL细胞悬液,同前培养条件培养。12 d后计数培养板中出现的悬浮、透亮细胞球数量。每组细胞镜下随机计数3个视野。对每组3个视野瘤球数量的平均值进行统计比较。
2.3 流式细胞术检测肿瘤干细胞比例 同前法,取转染后各组肺癌A549细胞,胰酶消化,反复PBS洗涤离心后,PBS重悬制成1×108/L的单细胞悬液。同本团对研究报道方法[3],加入CD133-FITC 荧光抗体避光孵育0.5 h 后,流式细胞术检测CD133 阳性细胞率。
2.4 Let-7a-3p靶基因预测 运用生物信息学方法在miRBase数据库中搜索let-7a-3p的序列, 进而分析let-7a-3p序列的特征并预测其可能的靶基因[6]。
2.5 Western blot法检测细胞蛋白表达的变化 肺癌细胞分组转染后48 h,按照既往报道方法[3]收集细胞,提取总蛋白,用Western blot法检测IGF1R、NANOG和OCT4的蛋白水平,以GAPDH为内参照。
2.6 双萤光素酶实验检测let-7a-3p与IGF1R的关系 采用野生型的IGF1R psiCHECKTM-2载体及定点突变后的IGF1R psiCHECKTM-2载体,分别和let-7a-3p mimics一起通过脂质体共转染,转染48 h后行双萤光素酶活性检测[3]。
2.7 IGF1R过表达对let-7a-3p抑制CSCs的拮抗作用 采用IGF1R过表达质粒转染let-7a-3p组A549细胞系,并通过Western blot检测IGF1R过表达后let-7a-3p组细胞中相关蛋白的表达情况。
2.8 建立皮下移植瘤模型,观察let-7a-3p对体内肿瘤细胞的抑制作用 同本课题组前期研究报道的方法[7],将经过慢病毒包装的let-7a-3p质粒和经过慢病毒包装的negative control对照质粒感染肺癌A549细胞。经嘌呤霉素筛选,建立稳定转染细胞系。无免疫力的BALB/c裸鼠饲养于南方医科大学实验动物中心SPF环境下,动物合格证号为SCXK (粤) 2012-0002。分别收集3组对数生长期的细胞1×106个,于裸鼠左胁部皮下注射建立皮下移植瘤,设定21 d为观察终点,取出移植瘤进行观察。
3 统计学方法
采用SPSS 16.0软件进行分析。实验数据用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析(one-way ANOVA),方差分析后各组均数间的两两比较采用Bonferroni校正的t检验。以P<0.01为差异具有统计学意义。
结 果
1 肺癌细胞系和正常支气管上皮细胞系中let-7a-3p表达水平的比较
采用RT-qPCR法检测肺癌细胞系A549、NCI-H1299、SPC-A1、H1650和HCC-827及正常支气管上皮细胞系BEAS-2B中let-7a-3p表达水平后发现,肺癌细胞系中let-7a-3p表达水平均明显低于正常支气管上皮细胞系(P<0.01),见图1。
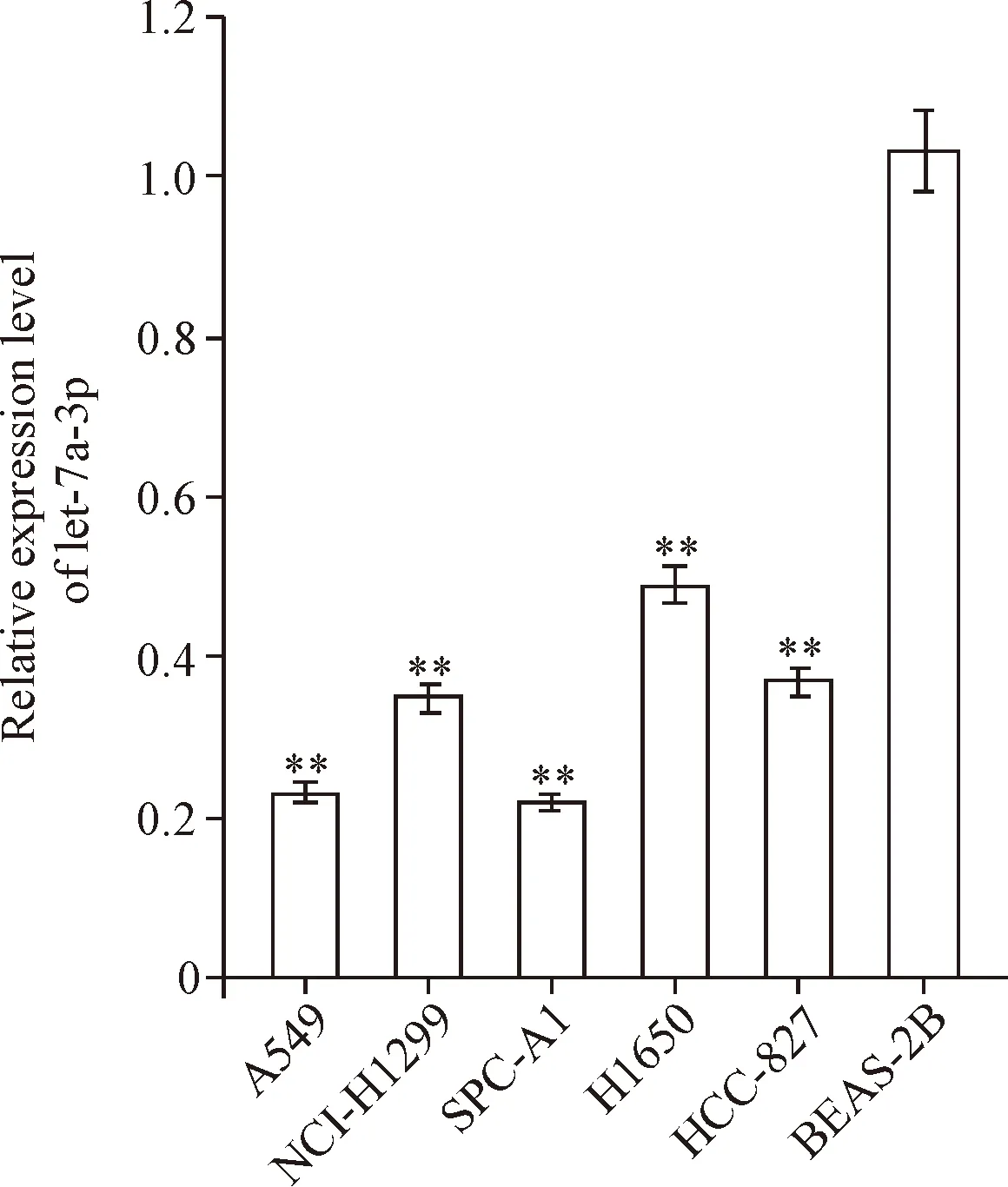
Figure 1. Relative expression level of let-7a-3p in the lung can-cer cell lines and normal bronchial epithelial cell line was detected by RT-pCR. Mean±SD.n=3.**P<0.01vsBEAS-2B cells.
图1 肺癌细胞系和正常支气管上皮细胞系中let-7a-3p表达水平检测
2 转染后A549细胞let-7a-3p表达水平的变化
分组转染A549细胞48 h后,分别检测3组细胞中let-7a-3p的表达水平,结果显示let-7a-3p组的let-7a-3p表达水平明显上调(P<0.01),而negative control组的let-7a-3p表达水平与non-transfected组的差异没有统计学显著性,见图2。
3 Let-7a-3p对A549细胞中的肿瘤干细胞潜能的影响
瘤球形成实验发现,经过12 d的培养,可观察到悬浮、透亮细胞球形成。研究发现let-7a-3p组瘤球数量明显低于non-transfected组(P<0.01),而negative control组与non-transfected组之间瘤球数量的差异无统计学显著性,见图3。
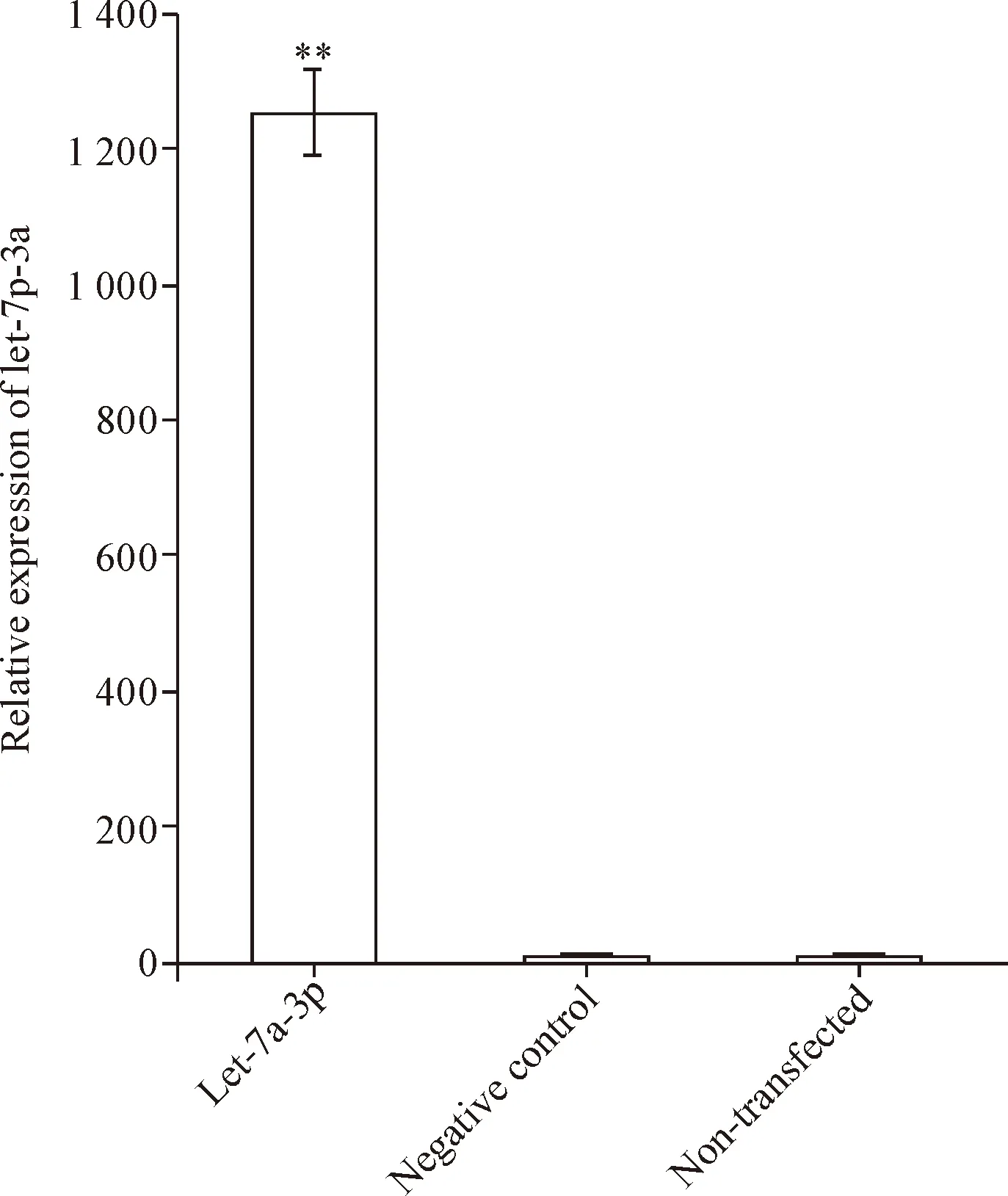
Figure 2. The expression levels of Let-7a-3p in the A549 cells after transfection. Mean±SD.n=3.**P<0.01vsnon-transfected group.
图2 转染后A549细胞中的let-7a-3p水平
4 Let-7a-3p对A549细胞中肿瘤干细胞比例的影响
流式细胞术检测发现, let-7a-3p组的CD133+细胞比例[(0.32±0.03)%]明显低于non-transfected组[(2.37±0.36)%,P<0.01],而negative control组的CD133+细胞比例[(2.42±0.45)%]与non-transfected组之间的差异无统计学显著性(P>0.05),见图4。
5 Let-7a-3p对A549细胞中CSCs相关功能蛋白表达的影响
Western blot实验显示,与non-transfected组相比,let-7a-3p组NANOG蛋白和OCT4蛋白表达量明显降低(P<0.01),而negative control组与对照组之间的蛋白表达的差异无统计学显著性,见图5。
6 Let-7a-3p靶基因的预测及与靶基因相互作用关系的双萤光素酶实验检测
miRBase生物信息学预测结果表明,let-7a-3p与IGF1R的3’-UTR部分互补,IGF1R可能是let-7a-3p的靶基因,见图6。进一步构建3’-UTR定点突变型MUT-IGF1R-3’UTR载体和野生型WT-IGF1R-3’UTR载体,在let-7a-3p共转染条件下,进行双萤光素酶检验,结果显示let-7a-3p能明显抑制野生型WT-IGF1R-3’UTR载体的发光强度(P<0.01),而无法抑制3’UTR定点突变型MUT-IGF1R-3’UTR载体的发光强度,说明IGF1R为let-7a-3p的下游靶基因,见图7。
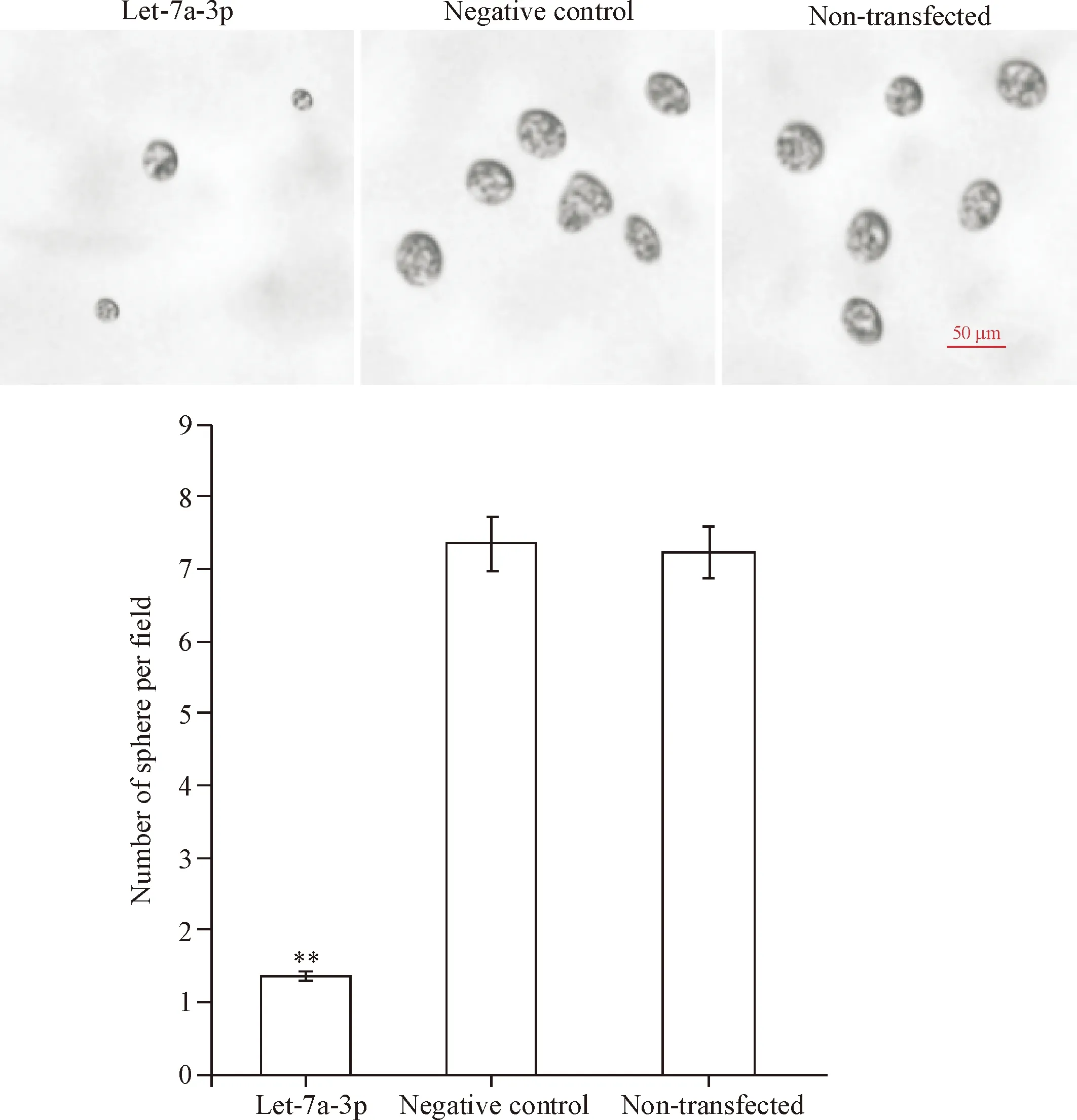
Figure 3. Sphere formation capacity in various groups. Mean±SD.n=3.**P<0.01vsnon-transfected group.
图3 不同处理组细胞单克隆瘤球形成能力的比较
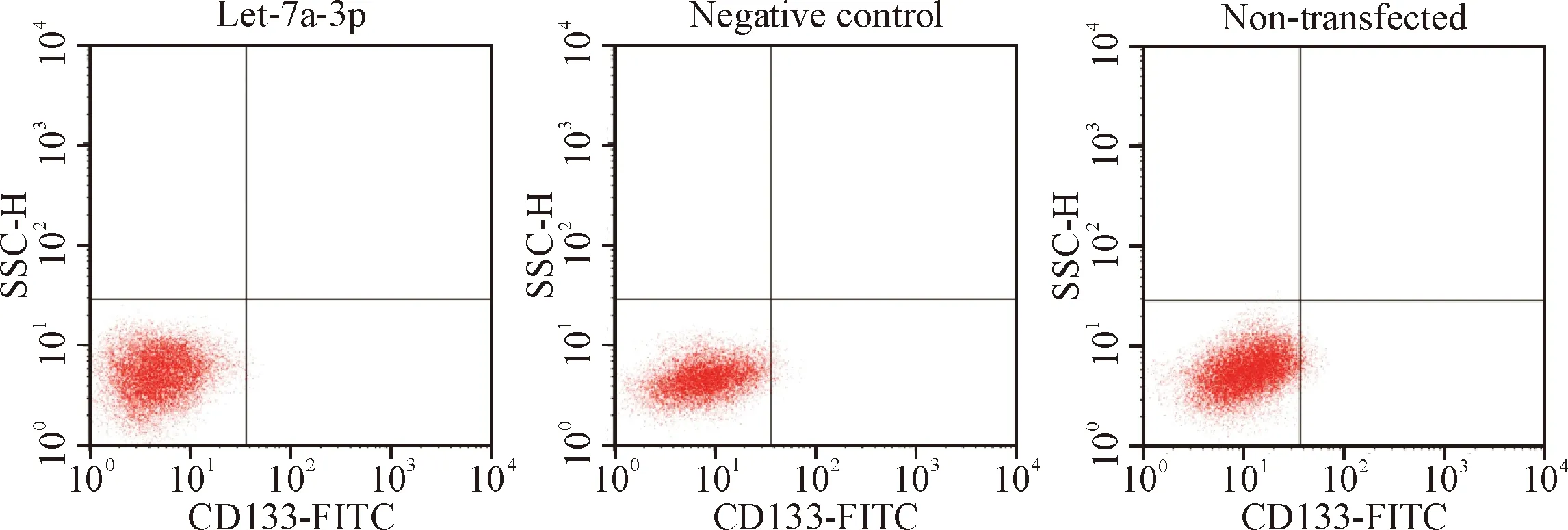
Figure 4. The proportion of CD133+cells in different treatment groups.
图4 不同处理组CD133+细胞比例的比较
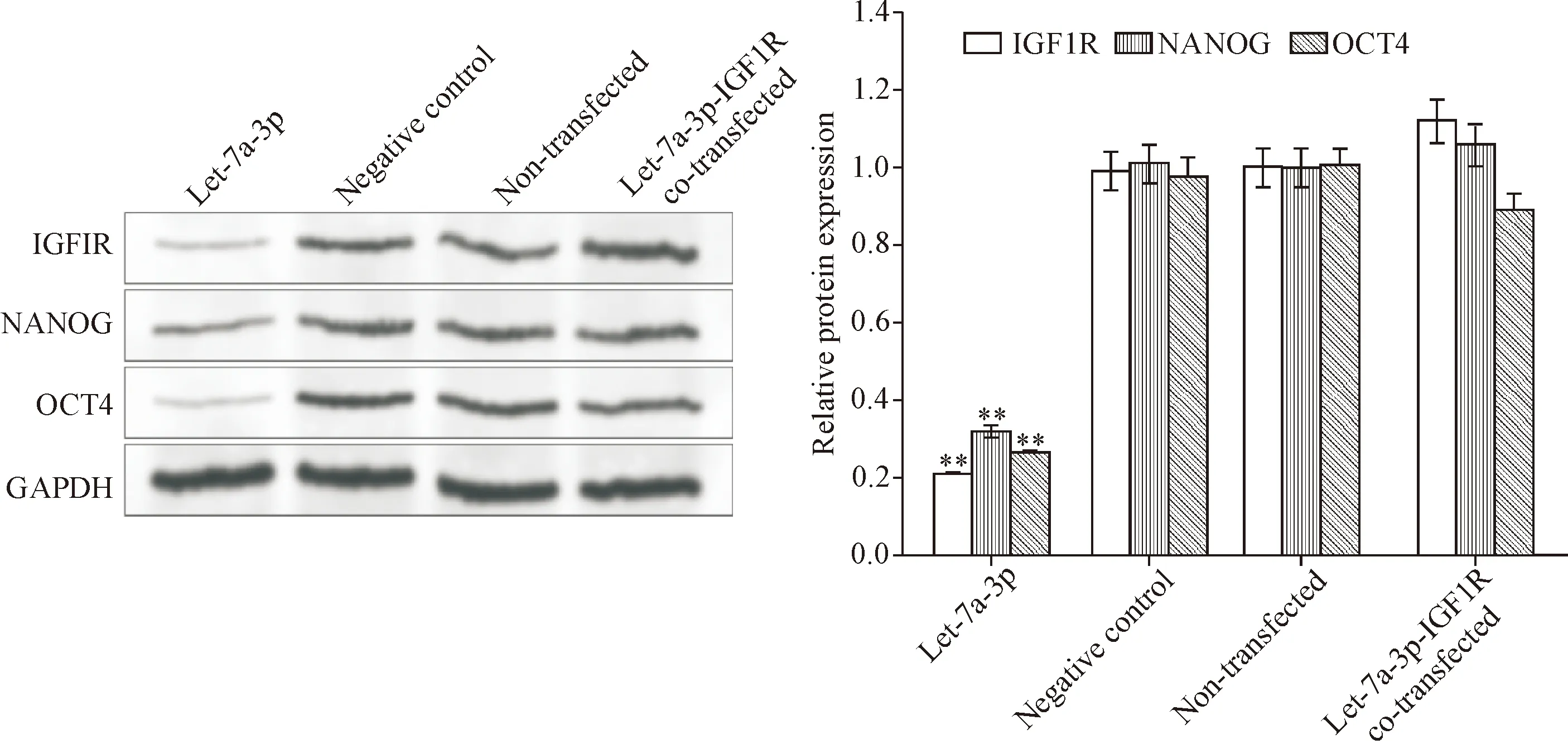
Figure 5. The effect of let-7a-3p on the protein expression of CSCs-related functional proteins in the A549 cells. Mean±SD.n=3.**P<0.01vsnon-transfected group.
图5 Let-7a-3p对A549细胞CSCs相关功能蛋白表达的影响

Figure 6. Target gene of let-7a-3p predicted by bioinformatic method.
图6 生物信息学预测let-7a-3p的靶基因
7 Let-7a-3p对A549细胞IGF1R蛋白表达水平的影响
转染试剂脂质体2000转染含有绿色荧光蛋白表达序列的IGF1R过表达质粒载体48 h后,采用流式细胞术检测绿色荧光蛋白阳性细胞比例为(87.52±3.06)%,与文献报道的比例[8]接近,显示转染成功。进一步的Western blot结果显示,与non-transfected组相比, let-7a-3p组的IGF1R蛋白表达量明显降低,而negative control组与对照组之间的IGF1R蛋白表达水平的差异无统计学显著性;IGF1R蛋白表达量的Western blot结果与let-7a-3p的PCR结果表现出负向相关关系,这说明let-7a-3p抑制IGF1R蛋白表达的效果显著;并且,由图5可见,经过IGF1R质粒共转染之后,let-7a-3p对NANOG和OCT4等肿瘤干细胞标志物的抑制作用受到明显的拮抗,见图5。
8 Let-7a-3p对A549细胞体内皮下移植瘤生长能力的影响
第21 天时切取皮下移植瘤进行观察,可见let-7a-3p组的皮下移植瘤明显小于non-transfected组(P<0.01),而2个对照组之间肿瘤大小的差异无统计学显著性,见图8。这表明升高let-7a-3p的表达水平可以抑制A549细胞皮下成瘤的增生能力。
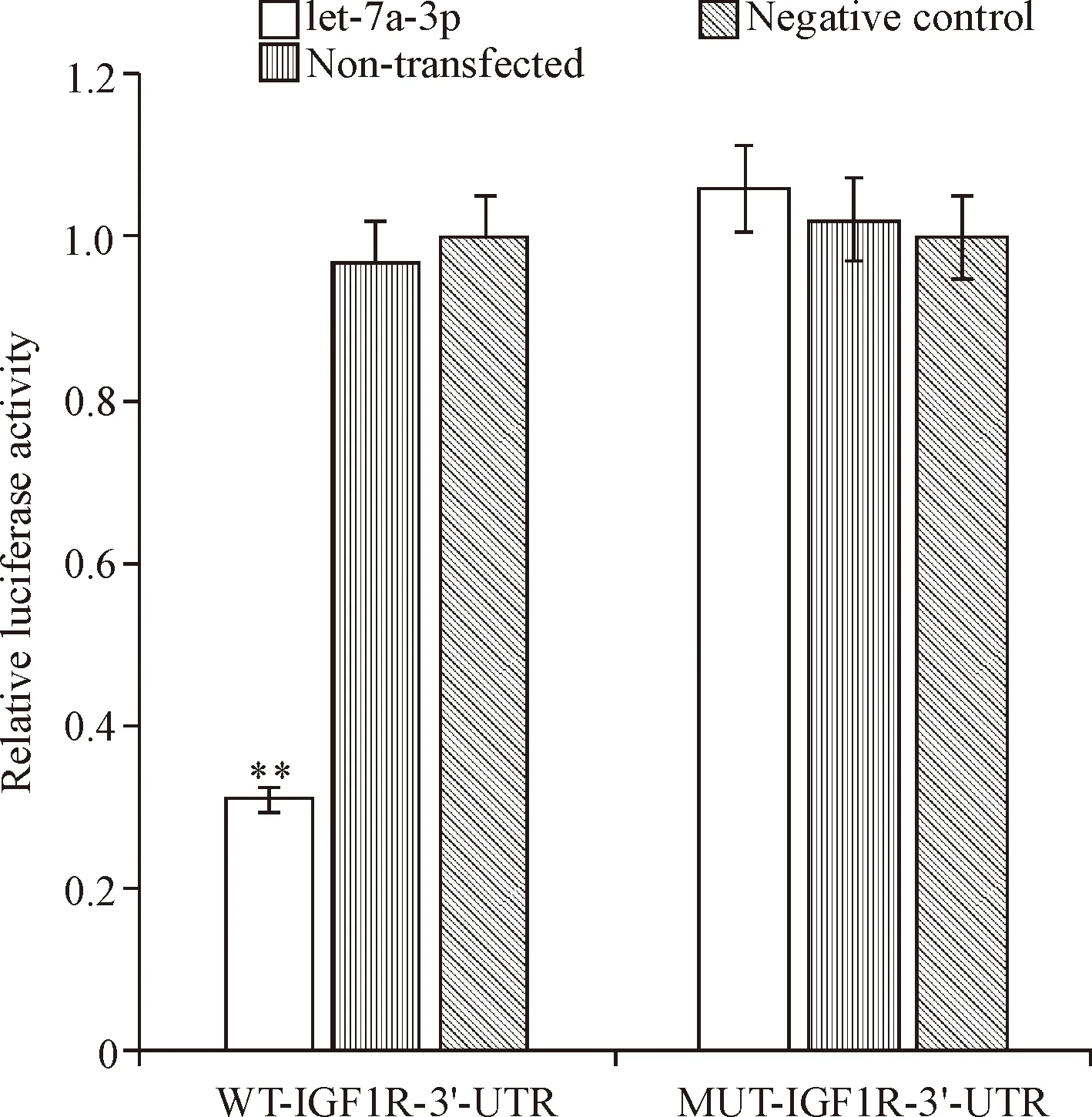
Figure 7. The relative luciferase activity. Mean±SD.n=3.**P<0.01vsnon-transfected group.
图7 Let-7a-3p与IGF1R相互作用关系的萤光素酶活性检测
讨 论
miRNA为相对保守的内源性非编码RNA,参与调控人类基因组中半数以上功能基因的表达。miRNA可以结合到靶蛋白mRNA的3’-UTR,引起靶mRNA的降解,进而抑制目的蛋白的翻译。目前研究显示,miRNA参与所有恶性肿瘤的发生、发展、侵袭和转移等过程[4]。不同的miRNA在肿瘤的生物学过程中发挥“癌miRNA”或“抑癌miRNA”的功能。Let-7a在目前抑癌miRNA研究中受到关注[3-4]。
肺癌的侵袭、转移和复发是目前肺癌患者综合治疗失败甚至致死的主因,如何有效抑制肺癌细胞的侵袭、转移和复发一直是肺癌研究的重要方向[1]。目前肿瘤干细胞理论认为,肿瘤干细胞是恶性肿瘤组织中存在的一小群具有干细胞特性的细胞,是肿瘤细胞中具有无限增殖和转移潜能的重要亚群,是恶性肿瘤侵袭转移和复发的重要始动因素[9]。如果能够对肺癌干细胞进行有效的基因治疗抑制,可望实现良好的治疗效果。 本团队在前期研究中证实,miRNA let-7a可以抑制CD133+肝癌干细胞活性,实现对肝癌干细胞增殖转移潜能的高效抑制[3]。所以,在后续研究中,我们希望验证let-7a对肺癌肿瘤干细胞的作用及其起效机制,以开发有效的肺癌干细胞抑制手段。

Figure 8. The effect of let-7a-3p on the volume of A549 cell subcutaneously transplanted tumors. Mean±SD.n=3.**P<0.01vsnon-transfected group.
图8 Let-7a-3p对A549细胞皮下移植瘤体积的影响
本研究证实,let-7a-3p在多种肺癌细胞中的表达量明显低于肺正常细胞系。该结果与既往相关研究报道相符。进而,我们采用let-7a-3p mimics转染的方法,成功地提高了肺癌细胞中let-7a-3p的水平。进而发现let-7a-3p水平的升高可通过对肺癌干细胞标志物NANOG和OCT4表达水平的抑制,实现对肺癌干细胞的单克隆瘤球形成能力的抑制和肺癌干细胞比例的下调,表明let-7a-3p mimic具有抑制肺癌干细胞的潜能。
进而,我们对其抑制肺癌干细胞潜能的机制进行深入探索。通过生物信息学预测发现,let-7a-3p与IGF1R蛋白可能存在靶向调控关系,且其热稳定型和基因保守性较高。但是该靶向调控关系在肺癌细胞中是否存在,仍需要进一步的研究证明。IGF1R是一种跨膜酪氨酸受体蛋白[10],它通过与其配体胰岛素样生长因子特异性结合诱导细胞有丝分裂,进而在肿瘤细胞中,产生对增殖、凋亡、血管生成及侵袭转移有关的调控作用[11]。IGF1R与前列腺癌、乳腺癌和肺癌等恶性肿瘤密切相关[12-13]。我们采用构建3’-UTR突变的真核载体,进行萤光素酶活性检测发现,let-7a-3p确实通过靶向IGF1R蛋白的3’-UTR区产生作用,且let-7a-3p对肺癌干细胞中肺癌干细胞标志物NANOG和OCT4表达水平的抑制作用,可以被IGF1R的真核异位表达有效拮抗。同时,我们在体内实验研究中初步证明了let-7a-3p在体内对A549细胞的抑制作用。前述研究说明,在肺癌细胞中,IGF1R为let-7a-3p直接的下游靶基因,且其靶向调控作用最终产生了对肺癌干细胞的调控作用。
综上所述,let-7a-3p可能通过降低下游靶基因IGF1R水平影响肺癌干细胞相关标志物表达,进而实现对人肺癌A549细胞干性的抑制。该miRNA有可能成为高效肺癌基因治疗的靶点。

