CD137信号通过有氧糖酵解途径促进小鼠肺动脉内皮细胞增殖*
蒋美萍, 陈 蕊, 刘培晶, 严金川
(江苏大学附属医院心内科, 江苏 镇江 212001)
肺动脉高压(pulmonary hypertension,PH)是一种病因复杂的肺血管疾病,以肺外周小血管重塑、闭塞,肺血管阻力进行性增加为特征,最终形成右心室肥大和右心衰竭。肺动脉高压的病理特征表现为内皮细胞、平滑肌细胞和外膜成纤维细胞的过度增殖和凋亡耐受,导致肺血管管壁不断增厚,肺血管重塑[1]。内皮细胞的功能障碍是肺动脉高压的重要启动因素[2]。
细胞在氧气充足条件下的能量供应仍主要依赖效率较低的糖酵解途径,并产生大量乳酸,为细胞增殖合成DNA等提供大量底物,这一现象被称为“Warburg效应”,即有氧糖酵解[3]。近年来,研究人员发现小鼠肺动脉内皮细胞(pulmanory artery endothelial cells,PAECs)的类肿瘤细胞增殖与其葡萄糖能量代谢异常密切相关,主要表现为细胞有氧糖酵解增加,线粒体氧化磷酸化减少及乳酸产量增加。肺血管内皮细胞线粒体氧化磷酸化的抑制直接导致了线粒体依赖的凋亡,继而上调糖酵解从而促进了细胞促增殖表型。在PH模型动物中应用糖代谢调节药物二氯乙酸盐(dichloroacetate,DCA)可减轻肺血管重构,缓解PH[4]。因此,PAECs葡萄糖能量代谢异常可能是PH肺血管重构的重要病理机制之一。目前研究已经发现缺氧诱导因子(hypoxia-inducible factor,HIF)的异常活化、骨形态发生蛋白受体2(bone morphogenetic protein receptor 2,BMPR2)的突变及陷窝蛋白1(caveolin-1)的缺失均可抑制线粒体的氧化磷酸化,促进PAECs有氧糖酵解过程[5]。然而,引起PAECs有氧糖酵解增强的原因及具体机制目前仍不清楚。
CD137是肿瘤坏死因子(tumor necrosis factor,TNF)受体超家族成员,主要表达在活化的免疫细胞表面,在炎症刺激下也可表达于平滑肌细胞和内皮细胞[6]。细胞表面CD137与其配体CD137L结合后激活CD137-CD137L信号(CD137信号),参与机体免疫炎症、心血管疾病及肿瘤的发生[7-8]。研究发现,激活的CD137信号能够促进CD8+T细胞有氧糖酵解,进而促进T淋巴细胞增殖,抑制细胞凋亡[9],这提示CD137信号可能通过介导细胞有氧糖酵解代谢,调控细胞增殖;然而,CD137信号是否参与肺高压内皮细胞增殖、异常代谢等功能障碍目前尚不清楚。本研究以小鼠PAECs为研究对象,探讨CD137信号是否通过调控有氧糖酵解途径影响小鼠PAECs增殖。
材 料 和 方 法
1 细胞和主要试剂
小鼠肺动脉内皮细胞购自中国科学院。DMEM高糖培养基购自维森特生物技术(南京)有限公司;胰酶和胎牛血清购自Gibco;CD137L重组蛋白购自生工生物科技有限公司;TNF-α购自PeproTech;2-脱氧葡萄糖(2-dexyglucose,2-DG)、内皮素1(endothelin-1, ET-1)和5-羟色胺(5-hydroxytryptamine,5-HT)购自Sigma;己糖激酶2(hexokinase 2,HK2)试剂盒和6-磷酸果糖激酶(6-phosphofructokinase,PFK)试剂盒购于苏州科铭生物技术有限公司;葡萄糖含量检测试剂盒及乳酸含量检测试剂盒购于北京索莱宝科技有限公司;CCK-8试剂盒购自南京诺唯赞生物科技有限公司;EdU细胞增殖检测试剂盒购自上海碧云天生物技术有限公司;抗CD137、HK2、6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3(6-phosphofructo-2-kinase/fructose-2,6-diphosphatase 3,PFKFB3)和c-Myc抗体购自Abcam;抗β-actin抗体购自康为公司;c-Myc抑制剂10074-G5购自TargetMol。
2 主要方法
2.1 细胞培养与实验分组 用含10%胎牛血清的DMEM高糖培养基培养小鼠PAECs,待细胞融合至60%进行干预。将细胞分组如下:(1)空白对照(control)、同型对照(isotype control)组(不加任何刺激,待收集离心后与CD137同型抗体避光孵育30 min)、TNF-α刺激组(终浓度10 μg/L)、ET-1刺激组(终浓度10 mmol/L)和5-HT刺激组(终浓度1 μmol/L),均刺激细胞24 h。(2)待细胞融合至60%,加入炎症因子TNF-α(终浓度10 μg/L)刺激24 h后(诱导刺激细胞表达CD137),分为对照组、CD137激动剂(CD137 agonist)组[加入CD137L重组蛋白(终浓度5 mg/L,激动CD137-CD137L信号)]、c-Myc抑制剂组[予c-Myc抑制剂10074-G5(DMSO溶解,终浓度10 μmol/L)预处理细胞30 min后,再加入CD137L重组蛋白(终浓度5 mg/L)]和二甲基亚砜(dimethyl sulfoxide,DMSO)组[加入与c-Myc抑制剂组等量DMSO预处理细胞30 min,再加入CD137L重组蛋白(终浓度5 mg/L);主要观察溶解c-Myc抑制剂10074-G5的DMSO是否对实验有影响]。(3)待细胞融合至60%后进行干预,加入炎症因子TNF-α(终浓度10 μg/L)刺激24 h后分为对照组、CD137激动剂组[加入CD137L重组蛋白(终浓度5 mg/L,激动CD137-CD137L信号)]和2-DG组[予糖酵解抑制剂2-DG(双蒸水溶解,终浓度10 mmol/L)预处理细胞30 min后,再加入CD137L重组蛋白(终浓度5 mg/L)]。
2.2 流式细胞术检测PAECs膜表面CD137蛋白的表达水平 收集TNF-α(10 μg/L)、ET-1(10 mmol/L)和5-HT(1 μmol/L)刺激24 h后的PAECs,胰酶消化后收集细胞,离心去上清,然后以磷酸盐缓冲液洗涤,分别与藻红蛋白(P-phycoerythrin, PE)标记的CD137抗体(0.3 μL, 1×106个细胞)及同型抗体室温避光孵育30 min,筛网过滤后,取细胞悬液用AccuriTMC6型流式细胞仪进行表型分析,荧光信号强度代表PAECs膜表面CD137蛋白的表达水平。
2.3 Western blot检测各组PAECs中CD137总蛋白及糖酵解酶的蛋白水平 收集对数生长期的细胞,加入RIPA裂解液,置于冰上裂解1 h,4 ℃、15 000×g离心15 min,收集上清,100 ℃变性8 min。取等量蛋白样本,10% SDS-PAGE分离蛋白后,以350 mA恒流90 min转印至聚偏二氟乙烯膜。将膜置于5%脱脂奶粉的TBST(NaCl+KCl+Tris+Tween-20,pH 7.4)室温封闭1 h。再分别用相应的兔抗小鼠CD137(11 000)、HK2(11 000)、PFKFB3(11 000)、c-Myc(11 000)及β-actin(11 000)抗体,4 ℃孵育过夜;次日用TBST洗涤3次,每次15 min, 采用HRP标记的山羊抗兔IgG(15 000)和山羊抗鼠(15 000)37 ℃孵育1 h,TBST洗涤3次,每次15 min,ECL显色系统定影显色,运用LANE-1D软件扫描条带灰度值,计算目的蛋白与β-actin灰度值比值,即为各蛋白相对表达水平。
2.4 葡萄糖含量检测试剂盒和细胞乳酸含量检测试剂盒检测各组葡萄糖及乳酸水平 收集对数生长期的细胞至离心管内,离心后弃上清,每500 万细胞加入 1 mL蒸馏水,超声波破碎细胞(冰浴,功率 20%,超声 3 s,间隔 10 s,重复 30 次),95 ℃水浴 10 min(盖紧,防止水分散失),冷却后,8 000×g,25 ℃离心 10 min,取上清液备用,按加样表加样后于505 nm处测吸光度(A)值,根据公式计算出各组细胞葡萄糖水平。收集对数生长期的细胞至离心管内,离心后弃上清,每500万细胞加入1 mL提取液一),冰浴超声波破碎细胞(功率300 W,超声3 s,间隔7 s,总时间3 min),于4 ℃、12 000×g离心10 min,取0.8 mL上清液,加入0.12 mL提取液二,12 000×g离心10 min后取上清待测,按加样表加样后于570 nm处检测各组吸光值,根据公式计算各组乳酸水平。
2.5 HK2试剂盒和PFK试剂盒检测糖酵解酶活性 收集对数生长期的细胞至离心管内,离心后弃上清,每500万细胞加入1 mL提取液,超声波破碎细胞(冰浴,功率20%,超声3 s,间隔10 s,重复30次),8 000×g、4 ℃离心10 min,取上清冰上待测,按照试剂盒加样表加样后于340 nm处检测各组吸光度(A)值。根据公式计算各组HK2和PFKFB3酶活性。
2.6 CCK-8 试剂盒检测PAECs的活力 制作标准曲线,将胰酶消化的PAECs接种于96孔板,每孔约2 000个细胞,培养24 h后换含有0.1%血清培养基同步化1 d,使绝大多数细胞处于G0期,进行相应药物干预;停止细胞干预,向每孔加入10 μL CCK-8溶液,不要在孔中生成气泡,将培养板置于37 ℃培养箱内孵育4 h,用酶标仪测定450 nm处的吸光度(A)值。
2.7 EdU法检测PAECs增殖 将上述2.1(3)各组PAECs换无血清培养基同步化2 h,加入EdU工作液至终浓度为10 μmol/L,37 ℃孵育2 h,孵育完成后吸尽DMEM,加入4%多聚甲醛室温固定15 min,吸尽固定液,3% BSA清洗3遍,加入1 mL 0.3% Triton X-100,室温孵育15 min,吸尽通透液,用3% BSA清洗3遍,加入反应体系(1× click reaction buf-fer 430 μL,CuSO420 μL,Azide 555 1 μL,click additive solution 50 μL),室温避光孵育30 min,吸尽反应体系,用3% BSA清洗3遍,加入110稀释的DAPI染液。荧光显微镜下观察并拍照。
3 统计学处理
用GraphPad Prism 5.0统计软件分析。每组实验重复3次,数据均采用均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),多组间多重比较采用Bonferroni-t检验。以P<0.05为差异有统计学意义。
结 果
1 CD137在活化的小鼠PAECs中表达增加
流式细胞术显示,TNF-α、ET-1和5-HT刺激24 h后, 内皮细胞CD137的荧光强度均高于对照组(P<0.05),见图1A。Western blot结果示,与对照组相比,TNF-α、ET-1和5-HT刺激24 h后,内皮细胞CD137总蛋白水平均高于对照组(P<0.05),见图1B。
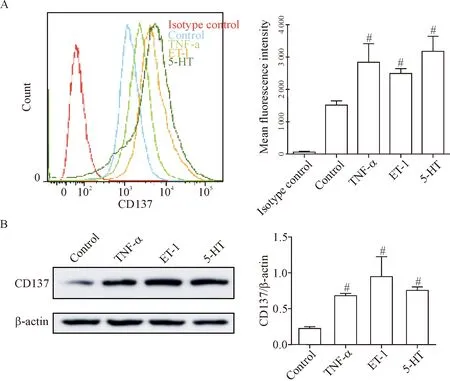
Figure 1. The expression of CD137 was increased in activated PAECs. The membrane CD137 (A) and total CD137 (B) were increased after stimulated with TNF-α, ET-1 and 5-HT. Mean±SD.n=3.#P<0.05vscontrol group.
图1 CD137在活化的PAECs表达增加
2 激活CD137信号后,小鼠PAECs有氧糖酵解水平增加
乳酸检测结果显示,CD137激动剂组乳酸产量明显高于对照组(P<0.05),见图2A。葡萄糖检测结果示,CD137激动剂组葡萄糖消耗明显高于对照组(P<0.05),见图2B。
糖酵解酶活性显示,CD137激动剂组糖酵解酶HK2和PFKFB3酶活性显著高于对照组(P<0.05),见图2C。Western blot结果显示,CD137激动剂组糖酵解酶HK2和PFKFB3蛋白表达水平高于对照组(P<0.05),见图2D。
3 CD137信号通过c-Myc调控有氧糖酵解
c-Myc与细胞代谢改变和细胞增殖有着明确联系。Western blot结果显示,CD137激动剂组c-Myc蛋白表达水平明显高于对照组(P<0.05),见图3A。预孵c-Myc特异性抑制剂10074-G5后,糖酵解酶HK2和PFKFB3酶活性较CD137激动剂组显著下降(P<0.05),见图3B。预孵c-Myc特异性抑制剂10074-G5后,糖酵解酶HK2和PFKFB3蛋白表达水平明显低于CD137激动剂组(P<0.05),见图3C。 DMSO组HK2和PFKFB3酶活性及蛋白表达水平与CD137激动剂组相比差异均无统计学意义。
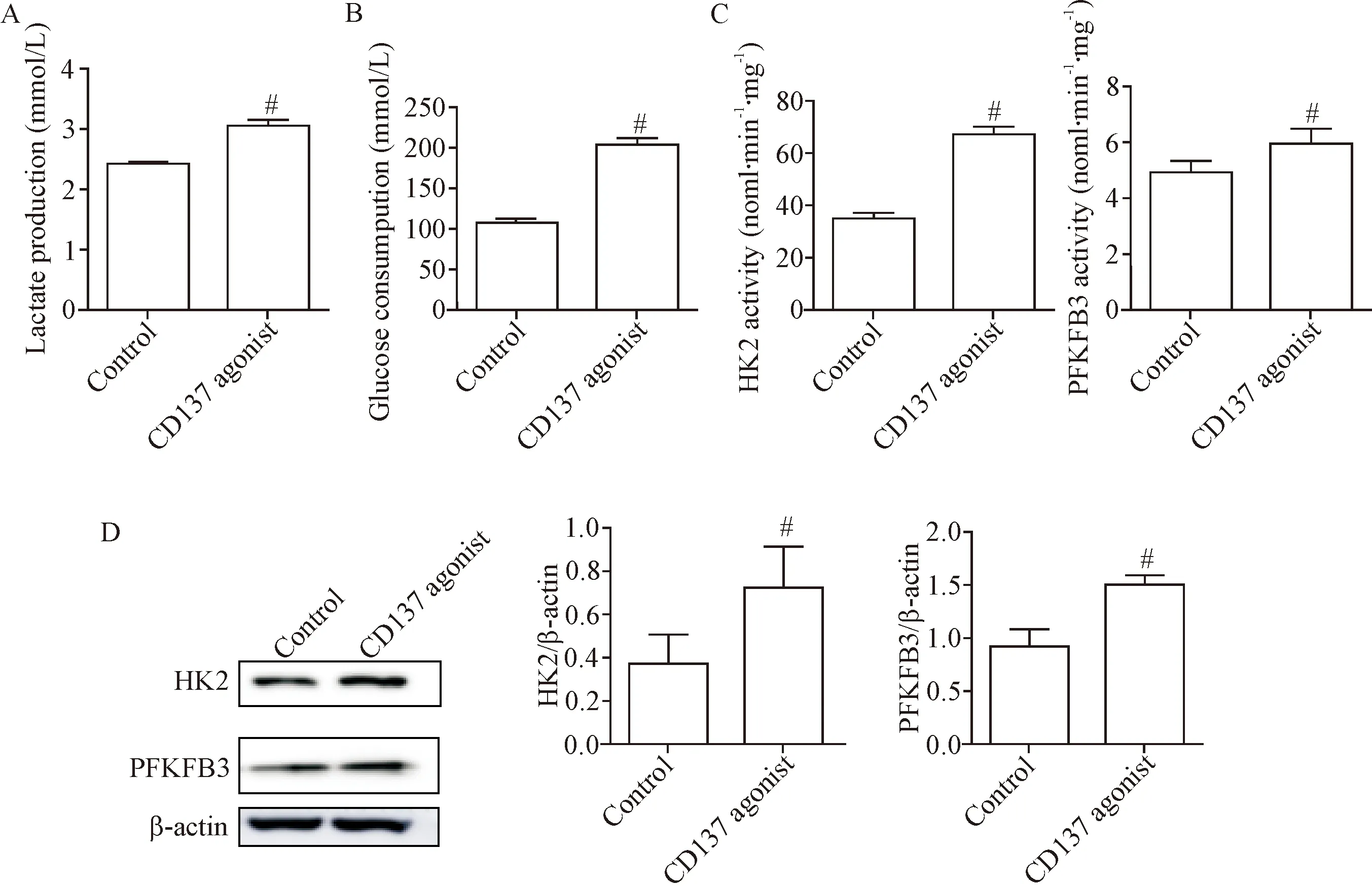
Figure 2. The aerobic glycolysis level was up-regulated in mouse PAECs after activation of CD137 signaling. A: lactate production; B: glucose consumption; C: the enzyme activity of HK2 and PFKFB3; D: the protein expression of HK2 and PFKFB3. Mean±SD.n=3.#P<0.05vscontrol group.
图2 激活CD137信号后,小鼠PAECs有氧糖酵解水平增加
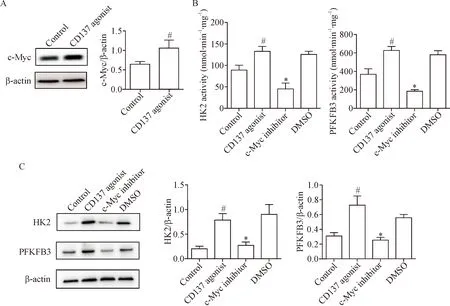
Figure 3. CD137 signaling regulated aerobic glycolysis by up-regulation of c-Myc. A: the expression of c-Myc; B: the enzyme activity of HK2 and PFKFB3; C: the protein expression of HK2 and PFKFB3. Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05vsCD137 agonist group.
图3 CD137信号通过c-Myc调控有氧糖酵解
4 激活CD137信号促进PAECs增殖,抑制糖酵解后其促增殖作用被抑制
CCK-8检测结果表明,CD137激动剂组细胞A值显著高于对照组,但是加入糖酵解抑制剂2-DG后,CD137L重组蛋白的促细胞增殖作用减弱,A值明显下降(P<0.05),见图4A。
EdU检测结果发现,CD137激动剂组红色荧光明显强于对照组(P<0.05),加入糖酵解抑制剂2-DG后红色荧光明显减少(P<0.05),显著抑制了CD137信号的促增殖作用,见图4B。以上结果表明,激活CD137信号会促进PAECs增殖,而2-DG可抑制CD137信号的促细胞增殖作用。
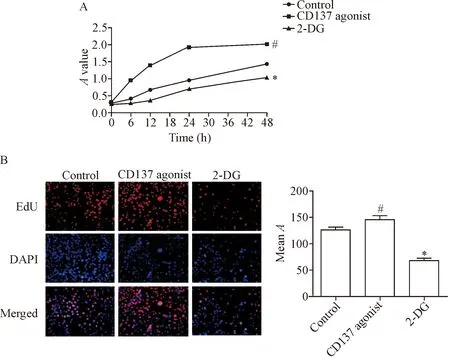
Figure 4. The activation of CD137 signaling promoted the proliferation of the PAECs, whereas glycolysis inhibitor 2-DG blocked the proliferation-enhancing effect of CD137 signaling. A: CCK-8 assay for cell viability; B: EdU staining for proliferation (×200). Mean±SD.n=5.#P<0.05vscontrol group;*P<0.05vsCD137 agonist group.
图4 CD137信号激活促进PAECs增殖,抑制糖酵解后促增殖作用被抑制
讨 论
PH是一种发病机制十分复杂的疾病,目前病因尚未完全了解。研究显示,肺动脉内皮细胞损伤,内皮功能障碍是PH的重要启动因素[2]。PAECs是肺血管内层的单层扁平细胞,分泌多种血管活性物质,维持血管正常的功能。缺氧、炎症、血流剪切力以及遗传因素都能引起肺血管内皮细胞损伤,最终导致其功能障碍[10]。损伤的内皮细胞发生凋亡,并且以旁分泌方式向周围分泌介质,诱导周围PAECs发生表型转变,形成过度增殖和凋亡耐受表型,最终形成特征性的“丛状损伤”,引起肺小血管闭塞重塑,导致严重的PH[11]。研究表明,即使在氧气供应充足的情况下,PAECs的能量来源主要依赖于有氧糖酵解;而当PAECs受损发生类肿瘤样增殖时,其有氧糖酵解反应大大增强[4]。因此,寻找及干预PAECs异常糖代谢的触发因素,是治疗肺高压的一个潜在新靶点。
炎症共刺激分子CD137是肿瘤坏死因子超家族成员,细胞表面CD137与其配体CD137L或活化型CD137单抗结合,激活CD137信号通路,通过复杂的调控机制,诱导内皮细胞功能紊乱,并且以CD137信号通路为靶点的人源化单抗已进入临床试验阶段[7]。正常的内皮细胞几乎不表达CD137,本研究发现在未活化的小鼠PAECs表达较低的CD137蛋白,而刺激因子TNF-α、ET-1和5-HT刺激后CD137表达明显上调。因此,我们选择炎症因子TNF-α诱导PAECs的CD137表达后,加入CD137L重组蛋白激活CD137信号,观察PAECs功能变化。
我们前期研究证实,激活的CD137信号通路能通过Smad1/5-NFATc1信号促进小鼠脑动脉内皮细胞增殖迁移[12]。本研究中激活CD137信号后,PAECs葡萄糖消耗增加,细胞外乳酸水平升高,有氧糖酵解酶HK2和PFKFB3酶活性和蛋白水平均明显增加,提示激活CD137信号通路能促进PAECs的有氧糖酵解。同时细胞增殖实验显示,激活的CD137信号能促进PAECs增殖,而有氧糖酵解抑制剂2-DG能抑制CD137信号的促增殖作用。因此,本研究在体外证实,激活CD137信号通路能上调PAECs有氧糖酵解水平,进而促进细胞增殖。Choi等[9]发现,激活的CD137信号通路可促进活化CD8+T细胞的糖酵解及脂肪酸代谢,促进CD8+T细胞增殖,抑制其凋亡。CD137信号是否也影响PAECs的脂酸代谢有待进一步研究。
原癌蛋白c-Myc是myc基因家族的重要成员之一,其在细胞周期、细胞增殖及凋亡和细胞代谢过程中发挥重要作用[13]。研究表明,c-Myc可通过直接增强糖酵解酶基因转录或通过核蛋白剪接因子的受控表达促进RNA剪接,增强肿瘤细胞的有氧糖酵解[14]。本研究表明,激活CD137信号通路可上调PAECs的c-Myc蛋白表达。为进一步验证c-Myc参与CD137信号的促糖酵解作用,我们采用c-Myc抑制剂10074-G5沉默c-Myc。实验结果表明,预孵10074-G5再激活CD137信号,有氧糖酵解关键酶PFKFB3和HK2的酶活性及蛋白水平均显著下降,提示c-Myc参与CD137信号的促糖酵解作用。因此,本研究在体外实验中证实CD137信号可能通过上调c-Myc表达,促进PAECs有氧糖酵解。然而CD137信号如何上调PAECs的c-Myc表达则需要进一步研究。
综上所述,本研究表明活化的PAECs中CD137信号分子表达增加;激活CD137信号能上调c-Myc蛋白水平,增强细胞有氧糖酵解,从而促进PAECs增殖。

