对虾养殖水体中一株降解氨氮芽孢杆菌的分离鉴定及其发酵配方的优化
陈锦豪,郑锦滨,史天一,李天骄,王攀攀,毛 勇,2*,苏永全,王 军
(1.厦门大学海洋与地球学院,福建 厦门 361102;2.厦门大学近海海洋环境科学国家重点实验室,福建 厦门 361102)

近年来,由于对虾集约化养殖业的快速发展,过高的养殖密度、过量的投喂、盲目施肥加之增氧能力不足[1]导致大量饵料残渣及粪便没有及时处理而逐渐沉积于池塘底部,从而引起养殖水体日渐富营养化,主要表现为可溶性无机氮NO3-N、NO2-N等有害氮源的增加,养殖水质恶化造成水中有害菌增生,导致养殖病害频繁爆发[4]。相关报道表明养殖过程中优良的水质理化条件及健康的微生物群落结构有利于对虾的健康生长[5-6]。
微生态制剂是益生菌的统称,是可用于水产养殖的活菌制剂[7]。它不但能改善养殖动物肠道微生物群落环境、增强消化酶活力、促进生长,还能降低养殖环境中氨氮、亚硝酸盐等有害物质的含量,减少养殖生产对水域环境造成的污染;同时,由于具有无毒副作用、无耐药性、无残留、生产成本低、应用效果显著等诸多特点,其成为水产养殖中不可替代的改良剂[8-9]。
本研究针对对虾养殖池塘中有害氮源的主要产生者——残余饵料及饵料浸出物,在(28±1)℃下从对虾养殖池塘中分离筛选能有效降解水体氨氮的芽孢杆菌,同时,采用单因素实验对筛选出的芽孢杆菌进行发酵配方优化,挑选低廉高产的培养基配方,以期为微生态制剂在水产养殖中的实际应用及其在养殖生产中的扩培方式提供新的选择和理论参考。
1 实验材料
1.1 实验样品
实验样品为对虾养殖池塘水样,于2018年6月采自福建省东山县茂鑫水产有限公司对虾养殖池塘,养殖对象为凡纳滨对虾苗种(Litopenaeusvannamei),体长(0.60±0.05) cm,采集水温约28℃。具体采集方法:当养殖池塘稳定正常水色(茶褐色)时,于池塘内设置5个采样点,用容积为1 L的采水器分别采集水样(水下约20 cm),将所采水样等量混合后取部分水样于无菌器皿中,不做任何处理直接置于4℃备用。
1.2 实验药品与培养基配制
实验药品:葡萄糖、可溶性淀粉、红糖、木薯粉、牛肉膏、酵母浸出物、胰蛋白胨、蛋白胨、豆粕、氯化铵(以上药品分别采购于北京索莱宝科技有限公司与江苏绿荫生物科技有限公司)。
实验试剂:革兰氏染色试剂盒、芽孢染色试剂盒、3%接触酶试剂盒、葡萄糖发酵管、木糖发酵管、甘露醇发酵管、阿拉伯糖发酵管、厌氧培养袋、淀粉水解生化管、明胶生化管、pH 5.7生化管、7%氯化钠生化管、V-P试剂盒、V-P半固体琼脂、柠檬酸盐生化管、丙酸盐生化管、硝酸盐还原试剂盒、硝酸盐肉汤、卵磷脂琼脂平板、溶菌酶生化管、血琼脂平板(以上试剂均采购于青岛海博生物科技有限公司)。
分离培养基:2216E固体培养基(青岛海博),1 L超纯水,121℃灭菌20 min后倒平板备用。
纯化培养基:2216E液体培养基(青岛海博),1 L超纯水,分装于100 mL锥形瓶,121℃灭菌20 min备用。
对虾饲料(广东恒源饲料)。
饲料浓缩培养基(参照赵坤等[10]):取对虾饲料30 g(研成细粉),加入1 L冷却灭菌海水,震荡混匀后于超净台浸泡48 h。取上清饵料浸出液高速离心2~3次后取上清液,后用隔膜真空泵(天津津腾)于0.45 μm滤膜下抽滤2~3次,调节pH 至7.8,分装于100 mL锥形瓶,121℃灭菌20 min备用。
菌种活化培养基:牛肉膏5 g,胰蛋白胨10 g,氯化钠5 g,琼脂粉15 g,1 L超纯水,调节pH 7.0~7.2,121℃灭菌20 min后倒平板备用。
种子培养基:牛肉膏5 g,胰蛋白胨10 g,氯化钠5 g,1 L超纯水,调节pH 7.0~7.2,分装于100 mL锥形瓶,121℃灭菌20 min备用。
发酵培养基:葡萄糖/红糖/可溶性淀粉/木薯粉5 g,酵母浸出物/蛋白胨/豆粕/氯化铵10 g,氯化钠5 g,1 L超纯水,调节pH 7.0~7.2,分装于100 mL锥形瓶,121℃灭菌20 min备用。
2 实验方法
2.1 芽孢杆菌的分离纯化
将制备好的样品接种于5 mL无菌离心管中,摇匀后于90℃恒温水浴锅中水浴20 min[11],尽可能地除去其他微生物。水浴后立刻将水样稀释为10-1、10-2、10-3等浓度,各取200 μL水样采用涂布平板法[12]分别涂布于分离培养基,每个梯度设3个重复,28℃恒温培养24 h,挑取菌落形态不同的单菌落于分离培养基上划线培养,重复3~5次,纯化菌株,最后将各菌株接种于纯化培养基中,加入30%甘油保种[13]并编号。
2.2 芽孢杆菌的筛选
芽孢杆菌的筛选参照赵坤等[10]的方法并略作修改,具体如下:取500 μL之前保种的各菌株,接种于装有3 mL纯化培养基的无菌离心管中进行菌种活化,将活化后的菌液于90℃恒温水浴锅中水浴20 min[11],水浴后将菌液采用涂布平板法[12]进行划线培养,28℃下培养5 d,挑取单菌落根据常见细菌鉴定手册[14]中革兰氏染色及芽孢染色法对菌株进行染色检测,选取革兰氏阳性,有芽孢的菌株进行后续实验。
2.3 菌株降解氨氮实验
2.3.1 菌含量测定
将各菌株接种于纯化培养基中,28℃活化24 h,用稀释平板法[12]计算活化后的菌体含量用于后续实验。
2.3.2 菌株氨氮降解实验
降解实验参照赵坤等[10]的方法并略作修改,具体如下:以饲料浓缩培养基作为菌株降解溶液,体积为100 mL,以不加菌的饲料浓缩培养基作为对照组,筛选的不同菌株作为不同的处理组,每个处理组设置3个重复。向各处理组加入初始浓度为1×106cfu/mL[15]的菌液,对照组与处理组摇床振荡(28℃,160 r/min)培养,每日定时取3个重复样并使用多功能酶标仪(Infinite M200 Pro ,瑞士Tecan)进行细菌生长曲线的测定;另取1 mL降解液8 000 r/min离心10 min后取上清,采用氨氮测定仪(原理为纳氏试剂比色法)立即测定上清液中总氨氮(TAN)含量,连测6 d(包括初始样),根据所得氨氮浓度计算出每日各菌株对氨氮的降解率[100%×(氨氮浓度-初始氨氮浓度/初始氨氮浓度)],筛选对氨氮降解效果好的菌株进行后续研究。
2.4 筛选菌株鉴定
2.4.1 菌株形态学生理生化鉴定
菌株的形态学及生理生化特性鉴定参照东秀珠等[14]的方法及我国枯草芽孢杆菌检测标准(GB/T 26428—2010),鉴定项目包括菌落形态观察、革兰氏染色、芽孢染色、接触酶反应、葡萄糖发酵、D-甘露醇发酵、D-木糖发酵、L-阿拉伯糖发酵、厌氧生长、淀粉水解、明胶液化、pH 5.7生长、7%氯化钠生长、V-P反应、柠檬酸盐利用、丙酸盐利用、硝酸盐还原、卵磷脂酶反应、溶菌酶耐性、溶血反应。
2.4.2 菌株分子鉴定
采用细菌基因组DNA抽提试剂盒(上海生工)提取菌株DNA作为PCR模板,PCR扩增引物参考张欢欢[16]的研究,采用通用引物27F与1492R。PCR反应体系包括(25 μL):2×EasyTag Mix (北京全式金)12.5 μL、灭菌的去离子水(ddH2O)9.5 μL、正向引物(10 μM)1 μL、反向引物(10 μM)1 μL、模板DNA(100~120 ng/μL)1 μL。反应条件:95℃ 5 min,95℃ 30 s,55℃ 30 s,72℃ 2 min,循环 35次,72℃ 10 min,16 ℃ 90 min。使用1.0%的琼脂糖凝胶电泳对PCR产物进行检测,将片段大小与预测相一致的PCR产物送至上海生工生物工程有限公司进行16S rDNA测序。
菌株16S rDNA所测序列在GenBank数据库中利用BLAST进行同源性比对,使用MRGA7.0软件,运用Kimura2-Parameter Distance模型,将比对所得序列与相关菌株序列构建Neighbor-Joning系统发育树。
2.5 筛选菌株生长曲线测定
菌株生长曲线采用多功能酶标仪(Infinite M200 Pro,瑞士Tecan)进行测定,将菌株活化后按1%的比例接种于纯化培养基,摇床振荡(28℃,160 r/min)培养36 h,每隔2 h取3个重复样测定OD600值,以平均值绘制菌株生长曲线,确定菌株最佳生长周期[17]。
2.6 筛选菌株发酵配方的优化
2.6.1 菌株活化、种子液制备及发酵培养
菌株发酵配方优化实验参照郑强等[18]的方法并在实验过程中有所改进,具体如下:在无菌条件下将菌株接种于菌种活化培养基,28℃恒温培养箱中活化24 h,挑选生长良好的单菌落于菌种活化培养基中划线培养(28℃,24 h),重复2~3次,保证菌种纯化。
将活化后的菌株挑单菌落接种于种子培养基中,恒温振荡(28℃,160 r/min)培养24 h。
以种子培养液为出发培养基,将培养好的种子液以2%的接种量接种于发酵培养基,发酵培养基以种子培养基为基础,将碳源牛肉膏依次替换为葡萄糖/红糖/可溶性淀粉/木薯粉;将氮源胰蛋白胨依次替换为酵母浸出物/蛋白胨/豆粕/氯化铵;无机盐氯化钠保持不变,共16种配方,每种配方3个重复,振荡培养(28℃,160r/min)48 h。
2.6.2 菌含量测定方法
培养结束后,采用稀释平板法[12]计算每种配方的菌含量,将重复样取平均后得出每种配方的含菌数。
2.7 数据处理与分析
数据统计分析采用SPSS18.0 for Windows软件进行处理,实验数据以平均值±标准偏差(Mean±SD)表示。采用单因素方差分析(One-Way ANOVA)和多重比较(LSD、Duncan)对比分析各处理组之间的差异,当P<0.05时认为各处理组间差异显著。
3 实验结果与分析
3.1 芽孢杆菌的分离纯化与筛选
实验经分离纯化共获得6株细菌,再通过革兰氏染色、芽孢染色检测后共筛选出5株芽孢杆菌,分别编号DS1、DS2、DS3、DS4、DS5。
3.2 芽孢杆菌降解氨氮的能力
将筛选所得芽孢杆菌经饲料浓缩培养基培养5 d,共获得6 d的数据(包括初始样),根据所得氨氮浓度计算芽孢杆菌对氨氮的降解率(%),结果见表1、表2与图1。结合表1、表2数据可以看出,5 d后DS1、DS2、DS3、DS4等4株菌对氨氮没有任何降解效果,与对照组相比反而使氨氮浓度有着显著不同程度的升高,统计分析表明差异显著(P<0.05),尤其是DS4菌株,5 d后氨氮浓度达到(185.33±6.18)mg/L,相比初始浓度升高了近360%,分析原因可能是菌株没有利用氨氮的能力或者利用氨氮的能力很弱,导致氨氮的降解量无法抵消菌株利用有机物所产生的氨氮;菌株DS5在5 d内对氨氮有显著的降解作用(P<0.05),在第4天达到最大氨氮降解率(36.41±0.07)%,且从第3天开始氨氮降解率一直稳定在36%左右。由图1也可看出,随着菌株DS5的生长,氨氮浓度逐渐降低,菌株在0~2 d期间生长最快,之后逐渐进入平台期,生长放缓,氨氮浓度在0~2 d期间降解最快,之后3 d逐渐稳定在26 mg/L左右,与最初2 d氨氮浓度差异显著(P<0.05),说明菌株DS5具有较强的氨氮降解能力并且具有稳定性,因此选择菌株DS5进行后续鉴定。
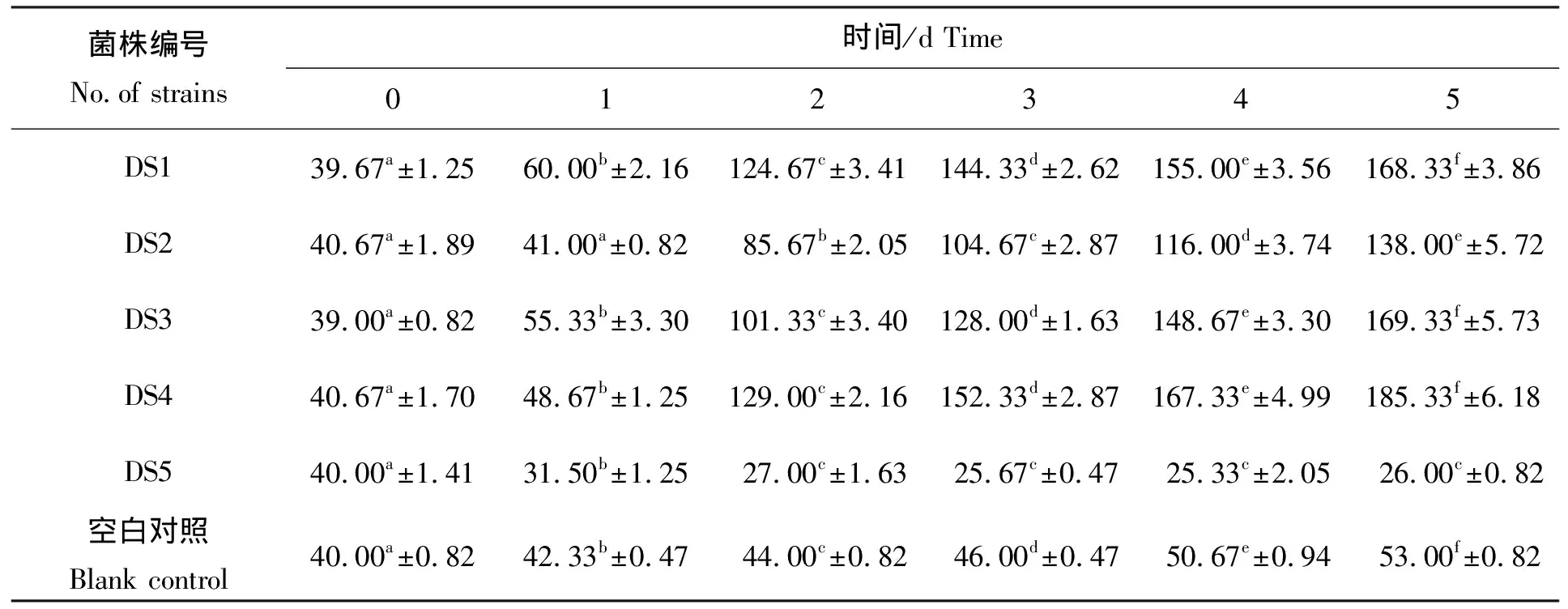
表1 不同时间芽孢杆菌对氨氮的降解浓度
注:表格中同一类型数据带有不同字母表示数据之间相互差异显著(P<0.05),含有相同字母表示数据之间相互差异不显著(P>0.05)。以下同此。
Notes:The data of the same type with different letters indicated significant differences in the form between each other(P<0.05),and with the same letters indicated there was no significant differences in the form between each one(P>0.05).The same as below.

表2 不同时间芽孢杆菌对氨氮的降解率
注:带“-”的数据表示所测氨氮浓度低于初始浓度,其余则表示所测氨氮浓度高于初始浓度。
Notes:The data with “-” indicated that the concentration of ammonia nitrogen was lower than the initial concentration,and the rest indicated that the concentration of ammonia nitrogen was higher than the initial concentration.
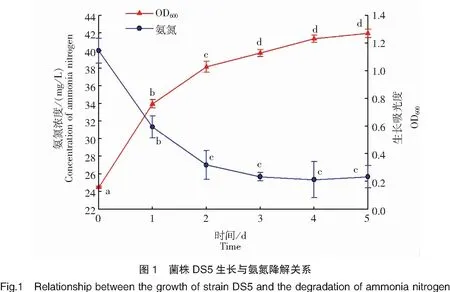
3.3 筛选菌株鉴定
3.3.1 菌株形态学及生理生化鉴定
经初步鉴定,菌株DS5为杆状,有芽孢,于2216E平板上28℃培养2~3 d,菌落呈灰白色、不透明、表面粗糙、扁平、近圆形;菌株生理生化特性见表3,其中,7%氯化钠生长、V-P反应、硝酸盐还原、D-甘露醇发酵及丙酸盐利用等测定结果均符合国标(GB/T 26428—2010)中枯草芽孢杆菌的鉴定标准。
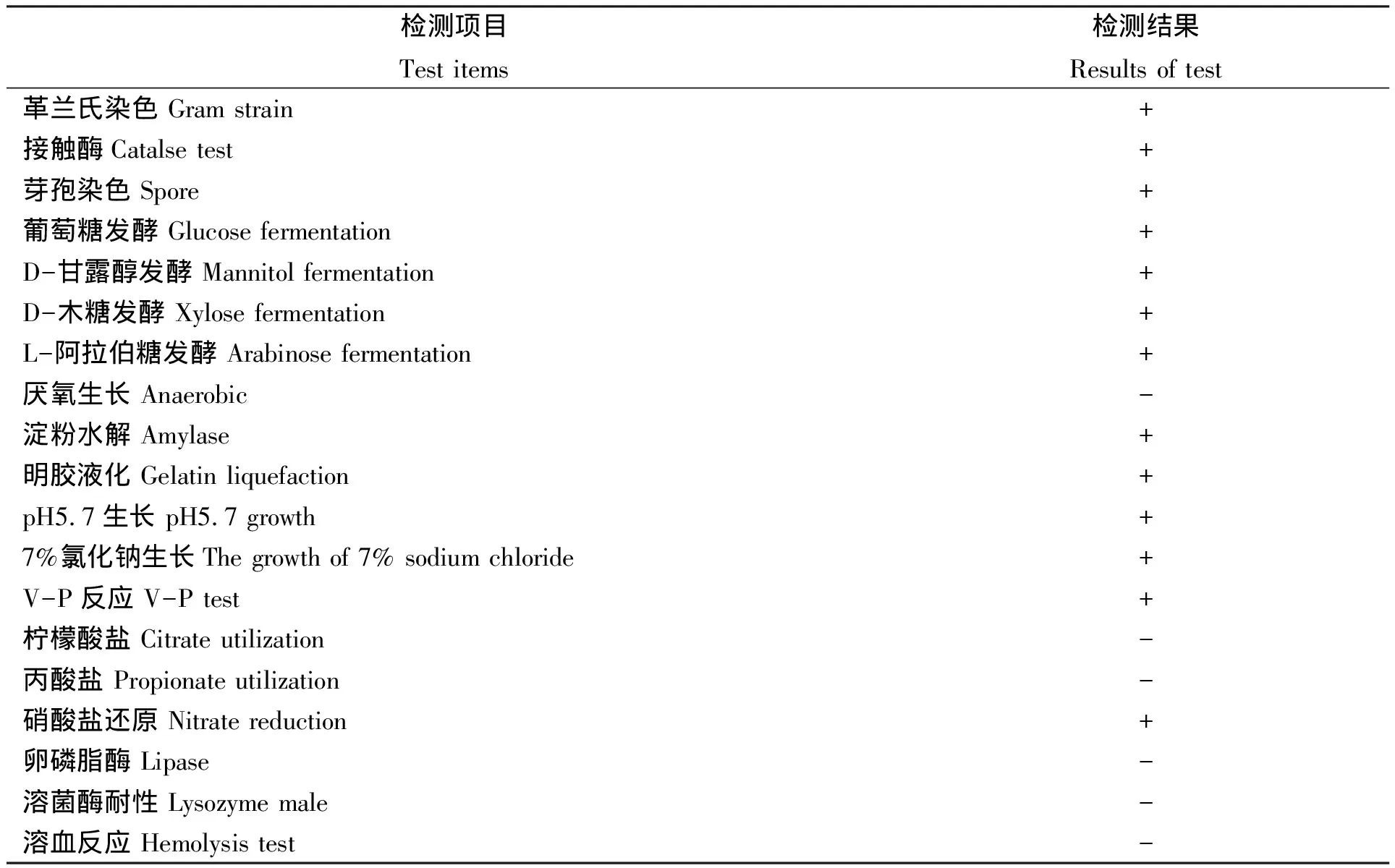
表3 菌株DS5生理生化特性
注:“+”:阳性反应;“-”:阴性反应。
Notes:+ was positive reaction,- was negative reaction.
3.3.2 菌株分子鉴定
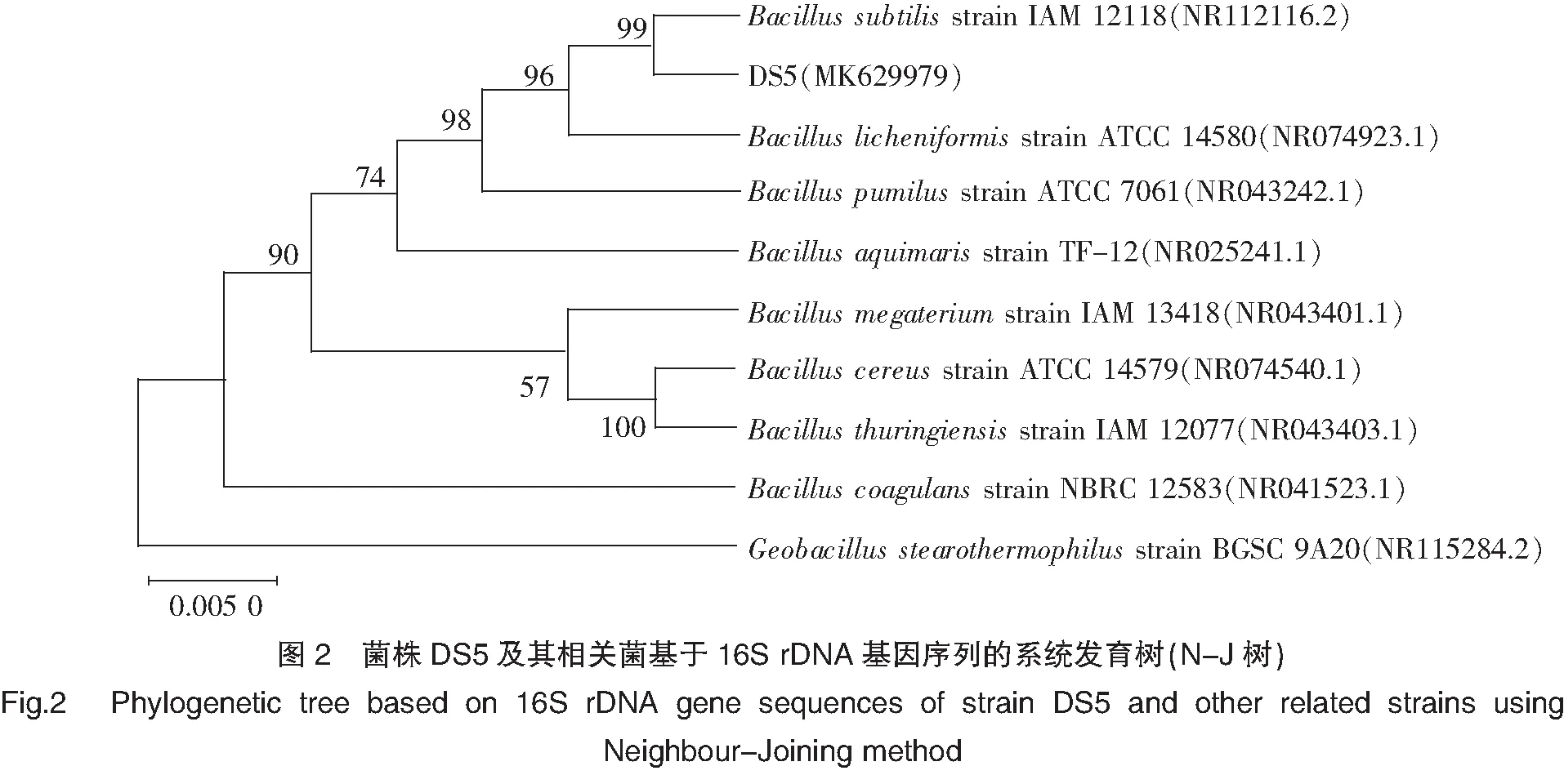
经鉴定,与菌株DS5(16S rDNA测序全长为1 420 bp,已在GenBank中注册,登录号:MK629979)序列同源性较高的均为芽孢杆菌属(Bacillus)细菌,与相关菌株16S rDNA序列构建系统发育树见图2。如图所示,菌株DS5与模式菌株枯草芽孢杆菌Bacillussubtilisstrain IAM 12118(NR112116.2)聚为一支,序列相似性达99%,结合该菌形态学、生理生化特性鉴定,初步将菌株DS5鉴定为枯草芽孢杆菌(Bacillussubtilis)。
3.4 筛选菌株生长曲线
菌株DS5生长曲线如图3所示,菌株DS5在0~4 h处于生长延滞期,4 h开始进入指数生长期,生长加快,尤其是在6~14 h期间生长最快,直至24 h生长速度放缓,开始进入稳定期和衰退期。
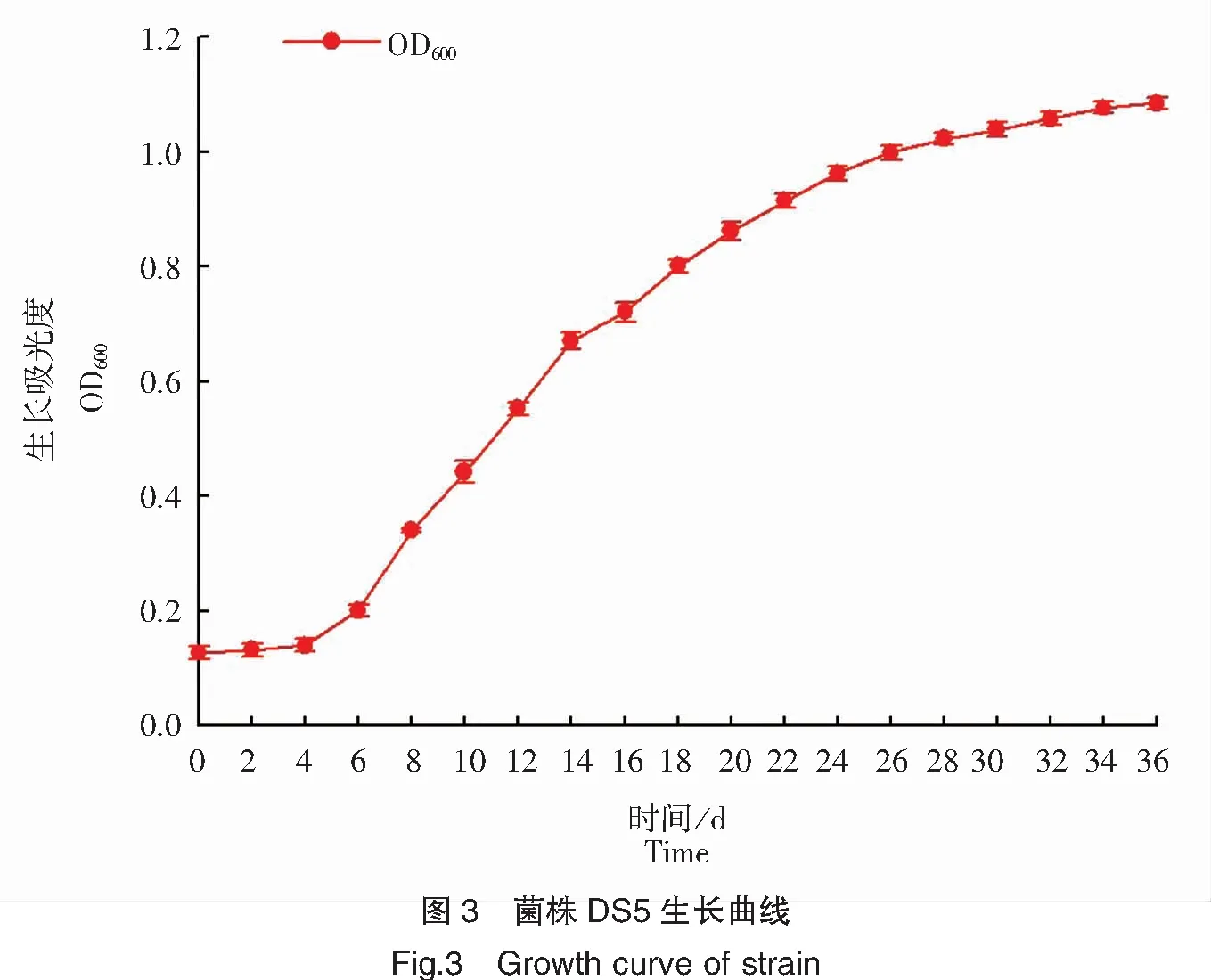
3.5 筛选菌株发酵配方优化
菌株DS5发酵配方优化结果见表4。
由表4可见,16种配方组合的菌含量均低于对照组,差异显著(P<0.05),其中,葡萄糖-豆粕组含量最高,达(7.03±0.30)×1010cfu/mL,葡萄糖-氯化铵组最低,为(2.00±0.41)×104cfu/mL,同一碳源和同一氮源不同组合之间大部分也有差异(P<0.05),说明不同配方组合对菌的生长有影响。其中,4种碳源与氯化铵的组合与其他组相比菌含量均较低(P<0.05),说明在氮源为氯化铵时,菌株生长较弱。
但值得一提的是,当氮源为氯化铵时,红糖-氯化铵组菌含量明显高于其余3组,达(3.34±0.19)×109cfu/mL,其余三组菌含量均不超过1×106cfu/mL,说明在氮源为氯化铵时,红糖作为碳源的效果要优于其他碳源。
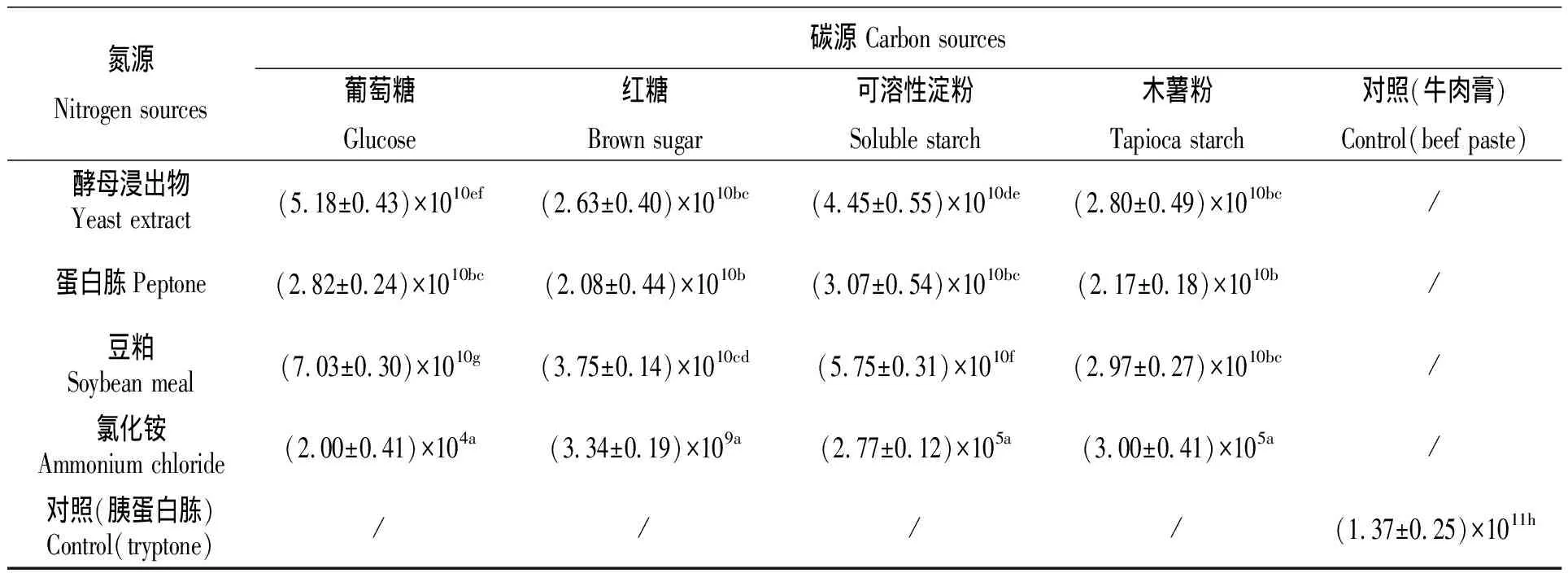
表4 不同碳源与氮源组合时枯草芽孢杆菌数
4 讨论
4.1 芽孢杆菌的分离筛选与氨氮降解实验
益生菌(Probiotic)作为目前国际对微生态制剂分类中重要的一部分,包括芽孢杆菌属(Bacillus)、乳酸菌属(Lactobacillus)、光合细菌(Photosynthetic bacteria)、硝化细菌(Nitrifying bacteria)等,已被广泛应用于水产养殖中[19-20]。其中,芽孢杆菌作为最早应用于水产养殖中的益生菌[21],其抗逆性强、繁殖迅速、功能多样,在水产养殖中已经得到广泛研究与应用[22]。安健等[23]从对虾池塘中筛选到一株好氧反硝化细菌—凝结芽孢杆菌(Bacilluscoagulans),并研究了其亚硝酸盐氮降解性能;Zokaeifar等[24-25]分离到2株能够显著降解水体氨氮、亚硝酸盐的枯草芽孢杆菌(Bacillussubtilis);闫法军等[26]在低温下从刺参养殖池塘中分离到一株能显著降解水体氨氮的芽孢杆菌属细菌(Bacillusspp.)Y11;易弋等[27]从鲤鱼(Cyprinidae)、草鱼(Ctenopharyngodonidellus)混养池中分离出一株能显著降解水体氨氮的巨大芽孢杆菌X1,在菌株活化与未活化状态下对氨氮的降解率分别达97.7%与98.4%;王娟等[28]从凡纳滨对虾养殖池中分离出一株巨大芽孢杆菌Zjs05,其可将有机氮转化为氨氮,又能将氨氮继续降解。可见,芽孢杆菌能够通过降解水中氨氮含量以净化水质、修复养殖环境,从而改善养殖生物的生存环境,提高养殖生物的生长性能及改善健康状况。
Ninawe等[22]和Verschuere等[29]研究认为从养殖水生环境中分离的益生菌在水产养殖中的应用效果会更好,Sharifuzzaman等[30]和Zhou等[31]也证实了从养殖环境中分离出的益生菌具有良好的益生效果。据研究[32],凡纳滨对虾(Litopenaeusvannamei)的适宜生长温度在18~35℃之间,高于35℃或低于18℃均会影响对虾正常生长。综上,本文选择在(28±1)℃下从凡纳滨对虾养殖池塘中筛选具有能显著降解水体氨氮能力的“土著”菌,通过革兰氏染色、芽孢染色,初步筛选出5株芽孢杆菌;再通过氨氮降解实验筛选出一株能有效降解氨氮的芽孢杆菌DS5,在初始氨氮浓度约为40 mg/L时(表1),5 d内氨氮降解率最高达到(36.41±0.07)%且持续稳定在36%左右(表2),从降解的量来看,略高于高海英等[33]分别从淡水和海水虾池底泥筛选出的耐盐芽孢杆菌T301,其在初始氨氮浓度为20 mg/L时,3 d内对氨氮降解率分别为55.18%和52.00%;低于罗毅志等[34]从淡水养殖环境分离的地衣芽孢杆菌(Bacilluslicheniformis)DSY002-2001,在初始氨氮浓度为100 mg/L时,24 h内该菌氨氮降解率达35.5%。结合菌株DS5形态学观察、生理生化指标鉴定及其16S rDNA序列所构建的系统发育树,将菌株DS5初步鉴定为枯草芽孢杆菌。
4.2 筛选芽孢杆菌发酵配方优化
碳源和氮源是微生物细胞和代谢产物的重要营养物质,是维持微生物正常生长繁殖的重要成分,也是发酵培养基的重要组成部分。发酵培养基配方是影响微生物发酵的重要因素之一,不同细菌对各种营养物质的需求量不同[35]。本实验研究了不同碳源与氮源发酵培养基配方对筛选出的枯草芽孢杆菌DS5菌含量的影响,在碳源的研究中,选择了单糖、二糖及多糖,其对枯草芽孢杆菌DS5生长影响的综合排序为葡萄糖>可溶性淀粉>红糖>木薯粉;在氮源的研究中,选择了有机氮与无机氮,其对枯草芽孢杆菌DS5生长影响的综合排序为豆粕>酵母浸出物>蛋白胨>氯化铵。秦艳等[36]研究表明葡萄糖能显著提高含菌数,且就效果而言,二糖和单糖优于多糖,与本研究结论略有不同,分析原因可能是菌株的不同导致对配方的利用效果不同,本实验中菌株DS5能够较好地利用可溶性淀粉;此外,实验过程中发现,除红糖-氯化铵培养基颜色偏红外,其余3种碳源与氯化铵组成的培养基颜色均为白色透明,说明有色培养基可能会对芽孢杆菌的生长产生影响。
氮源研究结果表明,有机氮源对菌株DS5生长的影响显著大于无机氮源,尤其是当氮源为豆粕时的4种配方组合含菌数均显著高于各自同一类型下其余氮源配方组合(P<0.05),这与刘辉等[37]研究发现一致,表明豆粕是影响芽孢杆菌菌数生长较为显著的因素。此外,豆粕虽然营养价值较高,但存在多种抗营养因子[38],且其影响对豆粕营养成分的消化、吸收与代谢,又因大豆蛋白分子结构复杂[39]、分子量大[40],导致豆粕中蛋白质消化率低,利用困难,造成资源浪费[41-43]。研究表明[44-45],枯草芽孢杆菌能够降解豆粕中的大分子蛋白质和胰蛋白酶抑制剂等抗营养因子,提高豆粕生物利用度及营养价值利用率,实现其高值化利用,也与本实验研究结果一致。另外,值得一提的是,虽然当氮源为氯化铵时的4种配方组合的菌含量均显著低于其余各组(P<0.05),但对这4种组合单独进行单因素方差分析,结果显示红糖-氯化铵组显著高于其他3组,菌含量达到(3.34±0.19)×109cfu/mL,差异极显著(P<0.01)。说明当氮源为氯化铵时,以红糖作为碳源的效果明显优于其他碳源,分析原因可能是红糖作为未加工彻底的二糖,含有多种维生素和微量元素,营养物质较于其他碳源更丰富,当芽孢杆菌无法有效利用所加氮源时,可以充分利用红糖中的其他营养物质进行生长。
在菌株实际发酵培养过程中,降低培养基成本,提高单位面积培养液中含菌数至关重要。因此,从节约成本的角度考虑,红糖价格比葡萄糖、可溶性淀粉低了近1倍,与木薯粉相近;豆粕价格比酵母浸出物、蛋白胨低了20~40倍,比氯化铵低了近2倍。从含菌量的角度考虑,红糖-豆粕培养基虽显著低于葡萄糖-豆粕、可溶性淀粉-豆粕培养基(P<0.05),但只低了近1倍,并略高于木薯粉-豆粕培养基。
本文所筛选出的菌株DS5为海生“土著”菌,早已适应海水中的生存环境,而海水中的无机盐主要为氯化钠,故本实验没有从无机盐的角度进行筛选。同时,氯化钠与红糖、豆粕价格接近,成本较低,因此,综合成本、含菌数等指标,选择5‰葡萄糖-10‰豆粕-5‰氯化钠作为菌株DS5的最优发酵培养基配方。
5 结论
本文从对虾养殖池塘中分离出一株能够显著降解养殖水体氨氮并能持续保持水体氨氮稳定在较低浓度的枯草芽孢杆菌,并研究了其降解规律,为微生态制剂在水产养殖过程中处理氮源污染的实际应用提供新的选择;同时,对该菌发酵培养的配方进行初步探索,综合考虑成本、含菌数等,最终筛选出5‰葡萄糖-10‰豆粕-5‰氯化钠作为该菌的最优发酵培养基配方,为该菌在实际水产养殖过程中的扩培方式提供一定的理论基础。

