常压室温等离子体和紫外诱变选育腺苷高产菌株
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
腺苷(Adenosine)全称为9-β-D-呋喃核糖基腺嘌呤,也称作腺嘌呤核苷[1-2],是一种具有重要生理、生化功能的内源性嘌呤核苷[3-4]。利用生物合成法中的微生物发酵生产腺苷有很大的优势[3]。早期,施庆珊等[5]对营养缺陷型的产腺苷菌株做了诱变研究,王小茹等[6]通过选育抗代谢类似物8-氮鸟嘌呤提高了腺苷的产量。目前利用发酵法生产腺苷的主要目的是通过诱变手段来提高产量。ARTP中富含的氮分子二正系统、氮分子一负系统、激发态氦原子、氢原子、氧原子和OH等活性能量离子,会对微生物菌株、植物和动物的遗传物质造成损伤,并能够诱发细胞启动SOS修复机制[7]。而SOS修复是一种高容错率的修复,修复过程中会产生种类丰富的错配位点,最终稳定遗传。ARTP诱变具有低成本、操作方便等优点。与传统诱变方法相比,ARTP诱变对遗传物质的损伤机制多种多样,因而获得突变型的多样性也随之增多,ARTP诱变的特点在应对微生物的诱变育种时显示出独特的优势。ARTP诱变对环境无污染,无论用何种气体放电,均无有害气体产生,且放电过程中没有核聚变和裂变等反应,存在的仅是从几十纳米波长到紫外光线、可见光线甚至更强的光线产生,这种长波的光线与辐射射线不同,其对人体损伤较小。紫外诱变使DNA分子形成嘧啶二聚体,二聚体出现会减弱双键间氢键的作用,并使双链结构发生扭曲,阻碍碱基间的正常配对,从而有可能引起突变或死亡[8]。另外二聚体的形成,会妨碍双链的解开,进而引起碱基转换、颠换、移码突变或缺失。次黄嘌呤是合成腺苷的重要前体,6-巯基嘌呤(6-MP)的化学结构与次黄嘌呤相似,两者唯一的不同是次黄嘌呤分子中6位C上的羟基被巯基取代,6-MP则通过竞争性抑制次黄嘌呤-鸟嘌呤磷酸核糖转移酶,使5-磷酸核糖-1-焦磷酸(PRPP)分子中的磷酸核糖不能向鸟嘌呤及次黄嘌呤转移,从而阻断嘌呤核苷酸的补救合成途径。6-MP可在体内经酶的作用磷酸核糖化生成6-MP核苷酸,并以这种形式抑制肌苷酸(IMP)转变为腺苷酸(AMP)及鸟苷酸(GMP)的反应[9]。由于6-MP核苷酸结构与IMP相似,因此能反馈抑制PRPP酰胺转移酶从而干扰磷酸核糖胺的形成,阻断嘌呤核苷酸的从头合成途径。笔者通过对腺苷产生菌枯草芽孢杆菌进行ARTP诱变和紫外-LiCl诱变并结合腺苷合成前体次黄嘌呤的结构类似物6-MP抗性理性来筛选腺苷高产菌株。
1 材料与方法
1.1 材 料
1.1.1 实验菌种
枯草芽孢杆菌B.subtilis4.8(命名为BS-0)。
1.1.2 培养基
固体培养基(100 mL):葡萄糖1 g,蛋白胨1 g,酵母膏1 g,牛肉膏1 g,尿素0.5 g,氯化钠0.25 g,琼脂粉2 g,pH 7.2。
种子培养基(100 mL):葡萄糖1 g,蛋白胨1 g,酵母膏1 g,牛肉膏0.3 g,尿素0.5 g,氯化钠0.25 g,泡敌0.03 g,pH 7.2。
发酵培养基(100 mL):葡萄糖12 g,酵母膏1.6 g,磷酸二氢钾0.3 g,七水硫酸镁0.1 g,尿素0.5 g,氯化钾0.2 g,硫酸铵1.5 g,一水硫酸锰0.001 g,硫胺素0.015 g,豆饼分水解液1.5 g,泡敌0.03 g,消后pH 7.0。
1.2 实验方法
1.2.1 菌种的活化及保种
击破安瓿管后用0.5~1.0 mL无菌水溶解枯草芽孢杆菌冻干粉并混匀,取适量溶解混匀后的冻干粉用V(质量分数为30%的甘油)∶V(冻干粉)=1∶1混匀后保存于-80 ℃冰箱中。用接种环蘸取适量混匀后的冻干粉液在斜面培养基上划线,35 ℃培养1~2 d,4 ℃冰箱中保存待用,保存期限不超过15 d。
1.2.2 摇瓶种子及菌悬液的制备
用接种环无菌操作挑取斜面培养基中的单菌落接入30 mL种子培养基,于37 ℃,220 r/min摇床中振荡培养至对数期。
取1 mL对数期菌液5 000 r/min离心1 min,取上清,用等量生理盐水垂悬洗涤沉淀,稀释,使OD600至0.6~0.8。
1.2.3 抗性浓度选择
取100 μL菌悬液涂布在质量浓度为0,0.20,0.40,0.60,0.75,0.78,0.80 g/L的6-MP的固体培养基中,35 ℃培养1~2 d,观察含不同6-MP浓度平板上菌落生长情况,计数并记录未长菌落的平板中含有的6-MP最低浓度,该浓度即为枯草芽孢杆菌的最低致死浓度[10]。
1.2.4 发酵培养条件
取对数期的种子液以6%的接种量接入到发酵培养基中,每组3个平行,控制摇床温度为37 ℃,转速240 r/min,连续培养3 d,测定其腺苷产量。
1.2.5 腺苷含量的测定
取发酵液煮沸5 min,冷却至室温后3 000 r/min离心10 min,精密量取5 μL离心上清加入到5 mL浓度为0.1 mol/L,pH为3的盐酸溶液中混匀,测其260 nm处的吸光度。
1.2.6 ARTP诱变处理
ARTP诱变:准备6个1.5 mL的EP管,每管加入990 μL无菌生理盐水,将EP管标记后卡在ARTP诱变仪卡槽内,紫外照射20 min以使待诱变环境处于无菌状态。紫外灭菌结束后取10 μL菌悬液均匀铺在ARTP载片上,用尖头镊子将铺有菌液的载片转移至凹槽中,每个载片对应一个EP管。设置诱变时间为0,15,30,45,60,75,90 s,放电功率为120 W,气流量为10 SLM。全部诱变结束后,载片落入EP管中,将EP管在漩涡振荡仪中振荡洗脱1~2 min以洗掉载片上的菌体,将含有菌液的EP管放置于-4 ℃冰箱中低温保持2 h,使其自生不能对突变产生修复[11-12],之后进行适当稀释并取100 μL分别涂布于无6-MP抗性的固体培养基和6-MP质量浓度为0.78 g/L的固体培养基中,每组3个平行,35 ℃培养1~2 d,分别计算致死率和正突变率,表达式为
致死率=(1-B/A)×100%
正突变率=C/B×100%
式中:A为照射0 s平板上菌落数均值;B为各照射时间无抗性平板上菌落数均值;C为各照射时间含最低致死浓度6-MP抗性平板上菌落均值。
1.2.7 紫外-LiCl诱变
取5 mL菌悬液和无菌磁力转子置于无菌平皿中,用磁力搅拌器使菌悬液始终处于被搅拌状态,保持紫外灯对含菌悬液和磁力转子的平皿垂直照射距离为20~30 cm[12],在照射时间为0,40,80,120,160,200,240 s时快速取菌液1mL并置于暗处,待诱变结束后在红光下对诱变过的菌液进行10倍梯度稀释[13],适当稀释后分别取100 μL涂布于LiCl质量分数为0.4%的无6-MP抗性的固体培养基和LiCl质量分数为0.4%,6-MP质量浓度为0.8 g/L的固体培养基中(LiCl均在固体培养基冷却至60 ℃左右时加入,待混匀后倒平板),每组3个平行,35 ℃避光培养1~2 d。致死率及正突变率[14-15]的算法参考1.2.6。
1.2.8 ARTP结合紫外-LiCl诱变
将菌悬液进行ARTP诱变处理后低温放置2 h,并培养4 h后进行紫外诱变、稀释并涂布于LiCl质量分数为0.4%的无6-MP抗性的固体培养基和LiCl质量分数为0.4%,6-MP质量浓度为0.85 g/L的固体培养基中,每组3个平行,35 ℃避光培养1~2 d。
1.2.9 腺苷高产菌的发酵筛选
初筛:挑取抗性正突变菌落和对照菌落接种于种子培养基,37 ℃,220 r/min振荡培养至对数期后以6%的接种量转接到24孔板的发酵培养基中,每组3个平行,37 ℃,240 r/min振荡培养3 d后,测其腺苷产量,测定方法参考1.2.5。
复筛:挑取初筛产量高的菌株接种于种子培养基,37 ℃,220 r/min振荡培养至对数期后以6%的接种量转接到摇瓶发酵培养基中,每组3个平行,37 ℃,240 r/min振荡培养3 d后,测其腺苷产量,测定方法参考1.2.5。
1.3 稳定性试验
对诱变筛选后的高产量菌株进行种子活化和摇瓶发酵培养后测其腺苷产量,传代考察其稳定性。
2 结果与分析
2.1 抗性浓度测定
以对照组即6-MP抗性浓度为0的平板上菌落的大小和数目为菌落生长状况标准,将含不同6-MP抗性浓度的实验组平板上的菌落生长状况与之比较。由表1可知,随着抗性浓度的增大,枯草芽孢杆菌单菌落数逐渐减少,菌落大小也明显受6-MP浓度影响,当6-MP质量浓度增大到0.75 g/L时,单菌落较少且体积小,6-MP质量浓度增大到0.78 g/L时菌落已全部致死,故选择0.78 g/L的6-MP为最低致死浓度。

表1 不同质量浓度6-MP对腺苷产生菌生长影响的情况1)Table 1 Effects of different concentrations of 6-MP on the growth of adenosine producing bacteria
注:1)+++表示多,++表示一般,+表示稀少,-表示无;***表示大,**表示中等,*表示小,空白处表示平板上无菌落生长,因此对单菌落大小不作描述。
2.2 ARTP诱变筛选
2.2.1 ARTP诱变致死率及正突变率
ARTP诱变致死情况如表2所示,该腺苷产生菌对ARTP比较敏感。诱变60 s时致死率已达到83%,当诱变时间为90 s时已完全致死。
统计诱变后在6-MP质量浓度为0.78 g/L的抗性平板上长出的菌株,结合对照组菌落数,得出诱变时间和正突变率的关系,由表2可知短时间的ARTP处理并不能得到较高的致死率和正突变率,诱变60 s时正突变率达16%,60 s后致死率持续增大但正突变率则大幅减少。
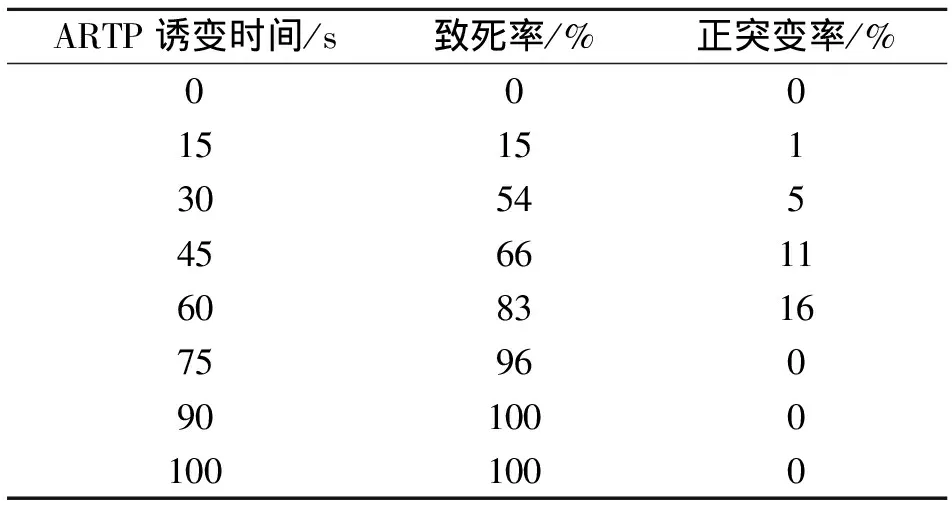
表2 ARTP诱变时间与致死率和正突变率的关系

表3 ARTP诱变菌株的腺苷产量Table 3 Adenosine yield of ARTP-mutated strain
2.2.2 ARTP诱变菌株的发酵筛选
多次诱变挑取诱变后的正突变菌株37 ℃,240 r/min发酵3 d后测其腺苷产量,得到10株比出发菌株BS-0产量高的菌株,高产菌株编号和产量如表3所示。其中第1轮诱变得到5株高产菌株A-1,A-3,A-7,A-13和A-33,第2轮得到5株高产菌株A-2-4,A-2-12,A-2-17,A-2-18和A-2-20。其中ARTP第1轮诱变的A-7和第2轮诱变的A-2-12较出发菌株腺苷产量有明显提高,A-2-12产量达19.297 g/L。
2.3 紫外诱变
2.3.1 紫外诱变致死率和正突变率
紫外诱变中加入助诱变剂LiCl诱变效果更好,以ARTP诱变的高产菌株A-2-12为出发菌株进行紫外诱变,在固体培养基中加入质量分数为0.4%的LiCl,致死率和正突变率如表4所示。0~160 s内致死率较低,且无正突变菌株产生。正突变率出现在诱变200 s和240 s时,其中诱变时间为240 s的正突变率高达18.52%,其诱变致死率达83%。
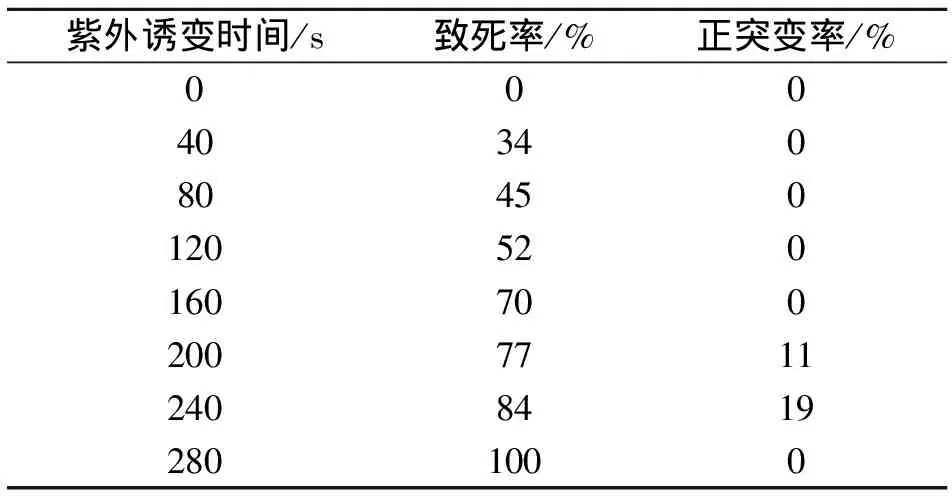
表4 紫外诱变致死率和正突变率Table 4 Fatality rate and positive mutation rate of UV mutagenesis
2.3.2 紫外诱变菌株的发酵筛选
经紫外和助诱变剂LiCl处理得到57株正突变株,编号为Z-L-1至Z-L-57,对正突变株进行发酵得到10株产量比出发菌株A-2-12产量高的菌株,产量如表5所示,其中Z-L-5和Z-L-19产量均高于19.880 g/L。
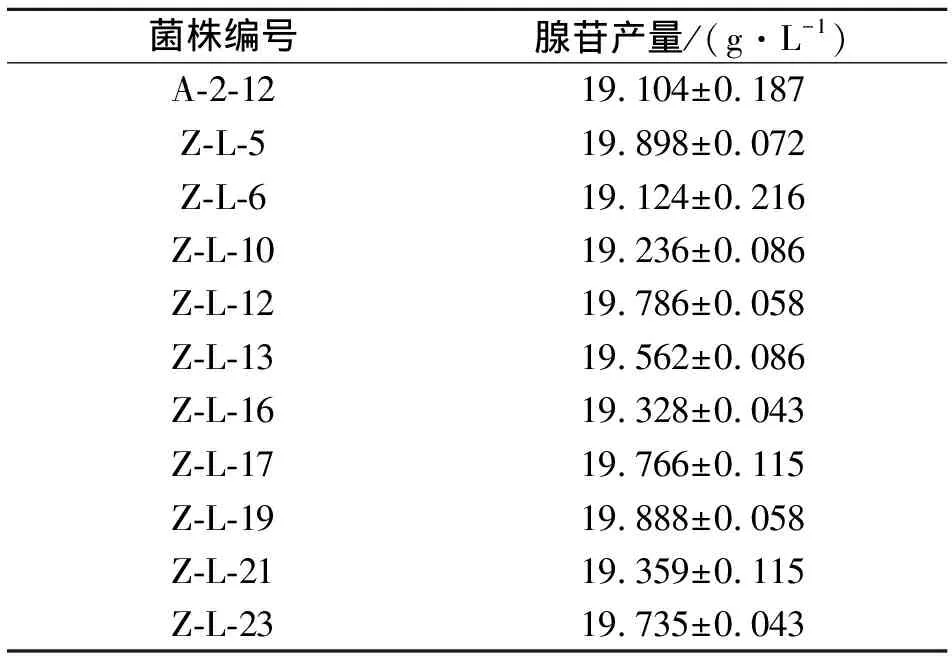
表5 紫外诱变菌株的腺苷产量Table 5 Adenosine yield of UV-mutated strain
2.4 ARTP复合紫外诱变
将Z-L-5和Z-L-19菌株混合接种命名为Z-L-H,以Z-L-H为出发菌株进行ARTP和紫外复合诱变。查L9(34)设计表设计3因素3水平的正交实验来提高正突变,正交因素水平如表6所示,依据表6的条件进行实验进而得到表7的正交实验结果。

表6 复合诱变正交实验设计Table 6 Design of compound mutagenesis orthogonal experiment
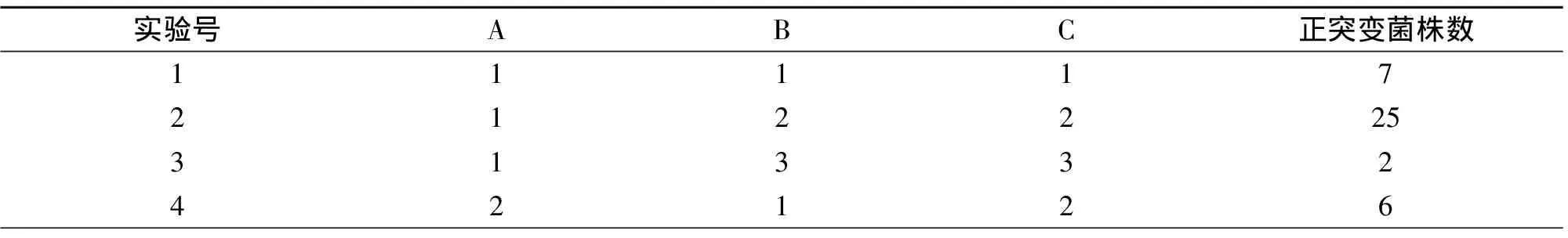
表7 复合诱变正交实验结果1)Table 7 Results of compound mutagenesis orthogonal experiment
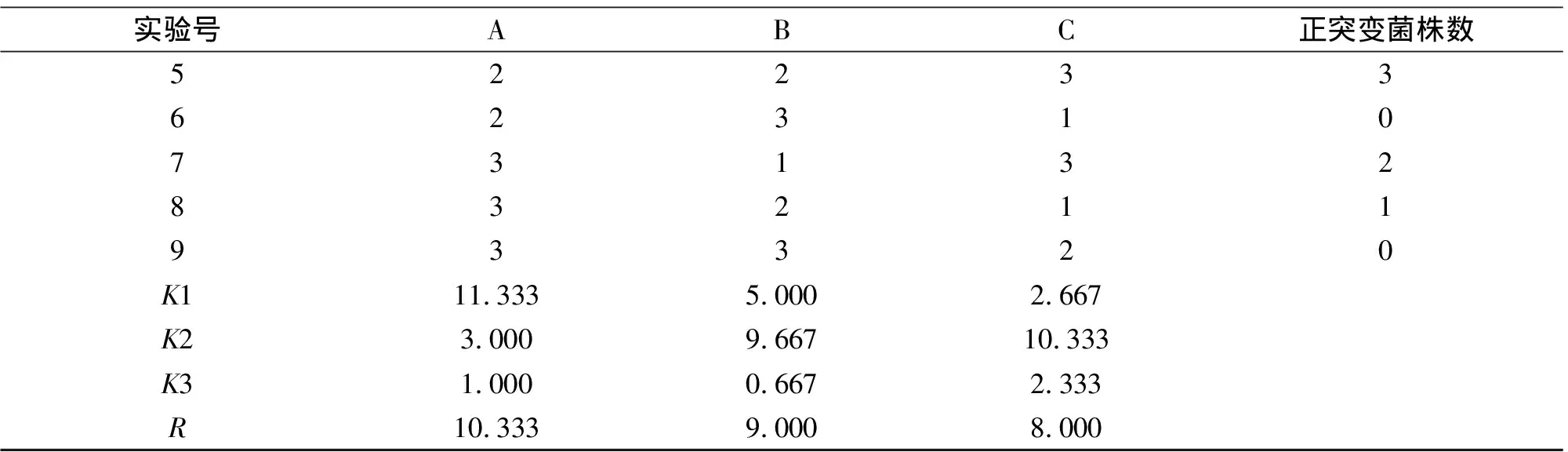
续表7
注:1) 表中空白处表示非因素列,不作正交分析。
由表7可知,对正突变影响的大小顺序是ARTP诱变>紫外诱变>LiCl浓度,最佳处理条件选择ARTP诱变60 s低温处理2 h,经4 h培养后紫外诱变240 s稀释涂布于LiCl质量分数为0.4%的平板和抗性平板中。对复合诱变抗性平板上的46个单菌落编号,依次为A-Z-L-1至A-Z-L-46,产量如表8所示,得到8株高产菌株,其中A-Z-L-2产量达20.560 g/L。
2.5 稳定性试验
对诱变筛选后的5株高产量菌株A-2-12,Z-L-5,Z-L-19,A-Z-L-2和A-Z-L-15进行种子活化和摇瓶发酵培养后测其腺苷产量,传代考察其稳定性,稳定性情况如表9所示。

表8 复合诱变菌株腺苷产量Table 8 Adenosine yield of the complex mutagenesis strain

表9 稳定性试验Table 9 Stability test
由表9可知,传代中5株菌株产量均低于第1代的腺苷产量,随着传代次数的增加各菌株产量下降幅度不等,只有A-Z-L-2产量相对稳定,传代6次后产量依然能达到20.512 g/L,因此如何提高菌种的稳定性还有待研究。
3 结 论
通过对腺苷产生菌枯草芽孢杆菌进行ARTP诱变,UV-LiCl以及组合诱变并结合腺苷合成前体次黄嘌呤的结构类似物6-MP抗性理性筛选,获得了1株腺苷高产菌株A-Z-L-2,传代6次后其腺苷产量达到20.512 g/L,较出发菌株腺苷产量提高了16.12%,该菌株具有较好的传代稳定性。目前腺苷高产菌株大多是经过化学或者物理诱变所得,用一般的诱变剂进一步处理时很难再筛选出更高产量的菌株,不但较难发生正突变,而且菌种极易发生退化。其主要原因是菌株的遗传标记不能稳定传代,培养条件或保种条件不当易造成菌种回复突变,从而导致产量下降。有研究表明选育黄嘌呤或鸟嘌呤缺陷型有利于降低回复突变率[16],通过增加遗传标签提高遗传稳定性是腺苷发酵的一个研究方向。研究者可以利用新的诱变手段,提高诱变效率,也可以通过分子手段[17-18]改善腺苷产生菌。

