高糖诱导心肌细胞miR-26a/miR-197表达促进细胞凋亡的机制研究
刘祖霞,张斌,汪伟,张康林,黄军利,朱小山,杨峰
糖尿病(DM)是现今对人类生命健康造成威胁的重要疾病之一,糖尿病心肌病(DCM)是一种常见的DM患者主要心脏并发症之一,与DM患者心血管疾病的高发病率和高死亡率相关[1]。研究发现,DCM的致病机制与心肌细胞凋亡、糖毒性、氧化应激等密切相关[2]。高糖条件可增加氧化应激压力,引起细胞线粒体膜电位异常,导致细胞凋亡[3]。因此,降低高糖诱导的心肌细胞凋亡对于DM的治疗具有重要意义。
MicroRNA(miRNA)是生物体内的一类非编码小分子RNA,长约22个核苷酸,可通过与靶mRNA结合,抑制其翻译,在转录后水平对基因表达进行负调控[4]。在各种组织与器官中miRNA有广泛表达,参与多种细胞生理及病理过程的调节。研究发现,多个miRNA参与DCM的生理及病理过程,如miR-206[5]、miR-29[6]。miR-26a和miR-197均为microRNA家族成员,H2O2诱导的心肌细胞miR-26a表达升高,过表达miR-26a可促进心肌细胞的凋亡[7]。高糖诱导的心肌细胞miR-197表达升高[8],提示miR-26a和miR-197在DCM发生发展中可能有重要作用。因此本研究旨在miR-26a/miR-197表达抑制对高糖诱导的心肌细胞活力和凋亡率的影响及机制。
1 材料方法
1.1 试剂和仪器胎牛血清、DMEM培养基、葡萄糖均购自美国Gibco;MTT试剂购自美国Sigma;Annexin V-FITC/PI细胞凋亡试剂盒、BCA试剂盒均购自上海生工;β-catenin、PCNA、Bax抗体均购自美国Abcam;酶标仪购自美国Bio-Rad;流式细胞仪购自美国BD。
1.2 细胞及培养大鼠H9c2心肌细胞购自美国ATCC。细胞在37℃、5%CO2培养箱中,用含血清的DMEM培养液培养,细胞达80%以上生长密度时消化传代。实验为生长至对数期的细胞。
1.3 实验分组H9c2心肌细胞分为6组处理,即低糖组(LG组):含有5.5 mmol/L的Glu普通培养液培养细胞;LG+miRcramble组:5.5 mmol/L的Glu处理细胞后瞬时转染miRcramble;高糖(HG)+miRcramble组:25 mmol/L的Glu处理细胞后瞬时转染miRcramble;HG+miR-26a inhibitor组:25 mmol/L的Glu处理细胞后瞬时转染miR-26a inhibitor;HG+miR-197 inhibitor组:25 mmol/L的Glu处理细胞后瞬时转染miR-197 inhibitor;HG+miR-26a/miR-197 inhibitor组:25 mmol/L的Glu处理细胞后瞬时转染miR-26a/miR-197 inhibitor。
1.4 转染转染前1 h接种生长至对数期的H9c2心肌细胞于6孔板,接种浓度为3.6×105个/孔,观察细胞生长状态,当细胞生长融合达80%~90%时转染cramble、miR-26a inhibitor、miR-197 inhibitor,转染参照LipofectamineTM2000(美国Invitrogen)的说明采用瞬时转染。收集转染48 h细胞,用于细胞增殖、凋亡及蛋白表达检测。
1.5 miR-26a和miR-197的表达检测收集各组培养至规定时间的细胞,Trizol法提取细胞总RNA,RNA浓度检测后逆转录试剂盒反转录总RNA为cDNA。用Oligo 6.0软件设计cramble、miR-26a和miR-197及内参基因U6引物。引物由上海生工设计及合成。以cDNA为模板,采用20 μl的反应体系,使用实时荧光定量PCR进行扩增,每孔设置3个重复孔。采用2-△△Ct法计算方法计算miR-26a和miR-197的相对表达量。实验重复3次。
1.6 细胞活力检测H9c2心肌细胞接种于96孔板,接种浓度为105/ml,参照1.3分组处理细胞,每组设置5个重复孔,细胞处理48 h后收集细胞,每孔中加MTT溶液(5 mg/mL)10 μl,于37℃孵育4 h,小心吸弃孔内的溶液,加入150 μl DMSO溶液在每孔中,震摇15 min,490 nm,酶标仪测定吸光度值(A值)。实验重复3次。
1.7 细胞凋亡检测收集1.3分组处理至规定时间的细胞,胰酶消化细胞,制备成单细胞悬液(105/ml),PBS洗涤细胞,1×binding buffer重悬细胞,分别加入250 μg/ml的AnnexinV-FITC和PI各5 ul,混匀后避光反应15~20 min,加入1×binding buffer 400 μl,1 h内上机,流式细胞仪检测。实验重复3次。
1.8 蛋白质印迹在处理至规定时间的细胞中加入细胞裂解液,提取细胞总蛋白,BCA法测定蛋白浓度,10%的SDS-PAGE分离蛋白样品(40 μg),蛋白分离后电转移至PVDF膜,膜用5%的脱脂奶粉封闭2 h,洗膜,4℃孵育1:1000稀释的一抗(β-catenin、PCNA和Bax抗体)过夜,洗膜,加入1:5000稀释的二抗,洗膜,ECL显色,扫描仪扫描胶片,应用gel pro 4.0软件分析目的蛋白与内参GAPDH蛋白的灰度值比值,其比值即为各蛋白的相对表达量。
1.9 靶基因预测通过TargetScan(http://www.targetscan.org/)等靶基因预测软件预测到miR-26a/miR-197与MCL1存在3,-UTR结合位点。因此,构建野生型和突变型的MCL1的3,-UTR荧光素酶报告载体,分别命名为Wt-MCL1和Mut-MCL1,同时共转染miR-NC、Wt-MCL1+miR-26a mimics、Wt-MCL1+miR-197 mimics、Mut-MCL1+miR-26a mimics和Mut-MCL1+miR-197 mimics,通过双荧光素酶报告基因检测试剂盒检测各组细胞中双荧光素酶的活性。
1.10 统计学方法所有实验数据采用SPSS 21.0软件进行分析,计量资料用(±s)表示,多组差异比较采用单因素方差分析,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 高糖诱导的H9c2心肌细胞miR-26a和miR-197的表达高糖诱导的H9c2心肌细胞miR-26a和miR-197的表达检测结果(表1~2),与LG组组比较,LG+miRcramble组miR-26a和miR-197的表达无明显变化(P>0.05),而HG+miRcramble组miR-26a和miR-197的表达均明显升高(P<0.05)。与HG+miRcramble组比较,HG+miR-26a inhibitor组miR-26a的表达明显降低(P<0.05),HG+miR-197 inhibitor组miR-197的表达明显降低(P<0.05)。

表1 高糖诱导的H9c2心肌细胞miR-26a的mRNA表达

表2 高糖诱导的H9c2心肌细胞miR-197的mRNA表达
2.2 抑制miR-26a/miR-197表达对高糖诱导的H9c2心肌细胞活力的影响各组细胞活力检测结果(表3),HG+miRcramble组细胞活力明显低于LG组(P<0.05),而HG+miR-26a inhibitor组和HG+miR-197 inhibitor组的细胞活力均明显高于HG+miRcramble组(P<0.05),低于HG+miR-26a/197 inhibitor组(P<0.05)。
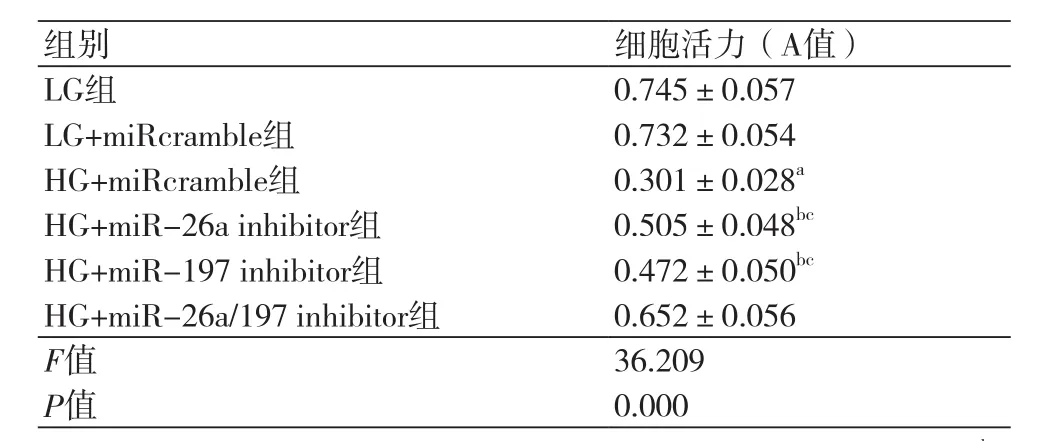
表3 抑制miR-26a/miR-197表达对高糖诱导的H9c2心肌细胞活力的影响
2.3 抑制miR-26a/miR-197表达对高糖诱导的H9c2心肌细胞凋亡的影响流式细胞仪检测的各组细胞凋亡率结果(图1、表4),HG+miRcramble组细胞凋亡率明显高于LG组(P<0.05),而HG+miR-26a inhibitor组和HG+miR-197 inhibitor组的细胞凋亡率均明显低于HG+miRcramble组(P<0.05),高于HG+miR-26a/197 inhibitor组(P<0.05)。

图1 抑制miR-26a/miR-197表达对高糖诱导的H9c2心肌细胞凋亡的影响

表4 抑制miR-26a/miR-197表达并经高糖处理后H9c2心肌细胞的凋亡率
2.4 抑制miR-26a/miR-197表达对高糖诱导的H9c2心肌细胞Wnt信号通路的影响通过Western blotting检测抑制miR-26a/miR-197表达对高糖诱导的H9c2心肌细胞Wnt信号通路关键分子β-catenin及下游增殖相关蛋白PCNA和凋亡相关蛋白Bax的蛋白表达(图2、表5),HG+miRcramble组细胞β-catenin和Bax的蛋白表达均明显高于LG组(P<0.05),PCNA的蛋白表达明显低于LG组(P<0.05),而HG+miR-26a inhibitor组和HG+miR-197 inhibitor组β-catenin和Bax的蛋白表达均明显低于HG+miRcramble组(miR-26a inhibitor:P<0.05;HG+miR-197 inhibitor组:P<0.05),高于HG+miR-26a/197 inhibitor组(miR-26a inhibitor:P<0.05;HG+miR-197 inhibitor组:P<0.05),PCNA蛋白表达明显高于HG+miRcramble组(miR-26a inhibitor:P<0.05;HG+miR-197 inhibitor组:P<0.05),低于HG+miR-26a/197 inhibitor组(miR-26a inhibitor:P<0.05;HG+miR-197 inhibitor组:P<0.05)。

图2 抑制miR-26a/miR-197表达对高糖诱导的H9c2心肌细胞Wnt信号通路的影响

表5 抑制miR-26a/miR-197表达并经高糖处理后H9c2心肌细胞中Wnt信号通路蛋白表达变化
2.5 靶基因预测miR-26a/miR-197的mimics/inhibitor转染H9c2心肌细胞,Western blotting检测细胞中MCL1的蛋白表达,结果表明,转染miR-26a/miR-197的mimics后H9c2心肌细胞MCL1的蛋白表达均明显降低(P<0.05),而转染miR-26a/miR-197的inhibitor后的H9c2心肌细胞MCL1的蛋白表达明显升高(P<0.05)。初步证实miR-26a/miR-197均与MCL1存在靶向关系。共转染结果表明,Wt-MCL1+miR-26a mimics组和Wt-MCL1+miR-197 mimics组的荧光素酶活性均明显低于miR-NC组(P<0.05),而Mut-MCL1+miR-26a mimics组和Mut-MCL1+miR-197 mimics组荧光素酶活性与miR-NC组差异无统计学意义(P>0.05),说明MCL1是miR-26a/miR-197的靶基因(图3,表6~7)。

图3 miR-26a/miR-197的mimics/inhibitor转染对MCL1蛋白表达的影响

表6 转染miR-26a/miR-197的mimics/inhibitor后H9c2心肌细胞中MCL1蛋白表达变化

表7 各组细胞荧光素酶活性检测结果
3 讨论
DCM被认为是独立于高血压及一些已知心脏疾病外的一类心肌疾病,其病理变化包括心肌细胞凋亡率和坏死、心肌肥大、心肌纤维化等,病因及发病机制复杂[9]。人类基因中miRNAs约占3%,不仅可对组织器官形成及细胞的生理过程进行调节,还可影响多种疾病的发生及发展,近年来发现miRNA参与包括心肌细胞凋亡、心肌肥大、心室重塑等多种心血管病的发病机制[10,11]。如miRNA-1[12]、miRNA-133[13]在DCM患者表达增加,miRNA-29[14]在DCM患者表达降低,均在心血管疾病中发挥了重要作用。有研究表明miRNA已广泛应用于DCM治疗。miR-26a和miR-197均为MicroRNA家族成员之一,在DCM中的研究较少。H2O2诱导的心肌细胞miR-26a表达升高,过表达miR-26a可促进心肌细胞的凋亡[7]。高糖诱导的心肌细胞miR-197表达升高[8]。
本研究首先检测了高糖作用下的心肌细胞miR-26a和miR-197的表达,发现二者的mRNA表达均明显升高,将miR-26a/miR-197的抑制物转染H9c2心肌细胞,细胞活力及凋亡率检测结果显示,miR-26a和miR-197的抑制物均可促进心肌细胞的活力,降低细胞凋亡,同时转染miR-26a和miR-197的抑制物对细胞活力及凋亡率作用更明显。提示miR-26a和miR-197在DCM治疗中占据重要作用。已知miRNA是通过调控下游的靶基因表达而行使生物学功能,MCL1是Bcl-2家族成员之一,与该家族中的促凋亡成员结合,通过释放线粒体内凋亡诱导因子及改变线粒体通透性,达到抗凋亡作用[15]。有研究表明,MCL1表达下调可对心肌细胞凋亡起到抑制作用[16]。miR-29a可通过对靶基因MCL1的调控影响心肌细胞凋亡[17],靶基因预测软件发现miR-26a和miR-197均与MCL1的3′UTR有结合位点,通过将miR-26a/miR-197的mimics/inhibitor转染心肌细胞后MCL1表达检测及转染荧光素酶活性检测,发现MCL1与miR-26a和miR-197均存在靶向关系,说明miR-26a/miR-197可靶向MCL1影响DCM的发生发展。
Wnt信号通路是一条重要的信号通路,参与细胞凋亡和分化、生长发育等的调控,在心脏疾病中发挥重要作用[18]。大量研究显示,健康成人心脏中Wnt信号通路是沉默的,而在多种心血管疾病中被持续激活,刺激细胞的凋亡[19,20]。也有研究显示,抑制Wnt信号活性可降低细胞凋亡,改善心功能[21]。PCNA是DNA复制过程中的一个必需物质,与细胞增殖有密切关系,PCNA表达上调可对心肌细胞增殖起促进作用[22]。Bax为Bcl-2家族成员之一,对细胞凋亡起促进作用,在心肌梗死、心肌缺血再灌注损伤等心血管疾病中Bax表达均明显升高,而抑制其表达可降低心肌细胞的凋亡[23,24]。本研究结果显示,miR-26a和miR-197的抑制物均可下调Wnt信号通路β-catenin和Bax表达,上调PCNA表达,同时转染miR-26a/miR-197的抑制物对β-catenin、Bax和PCNA表达影响更明显。提示miR-26a/miR-197可通过下调Wnt信号降低DCM的发生发展。
综上所述,miR-26a/miR-197可通过靶向MCL1促进高糖诱导心肌细胞活力和降低细胞凋亡率,机制可能与抑制Wnt信号通路有关。该研究可能为DM的治疗提供了的一定的理论基础,但本研究仅为体外研究,还需做体内研究以便进一步证实。

