原发性肺浸润型黏液腺癌的多层螺旋CT征象分析
谭小妹 邓 东 韦艳静
(广西医科大学第一附属医院放射科,南宁市 530021)
临床上肺腺癌越来越受到人们重视,进一步了解肺腺癌的影像学特征,有助于肿瘤的定性和分期。原发性肺黏液腺癌(primary pulmonary mucinous adenocarcinoma,PPMA)为腺癌的一种特殊类型[1-2],其临床表现无特异性,极易被误诊为肺炎、肺结核及其他肺部疾病,且当前相关的大宗病例影像学研究较少[3-4]。为提高PPMA的临床影像认识水平,本文回顾性分析了38例经病理检查证实为原发性肺浸润型黏液腺癌(IMA)患者的多层螺旋CT(MSCT)影像学资料。现报告如下。
1 资料与方法
1.1 一般资料 收集2009年4月至2017年9月在我院行CT检查的38例原发性肺IMA患者的临床资料,其中男22例,女16例;年龄30~79岁,中位年龄53.5岁;咳白色黏液痰18例,咳血痰1例,胸痛5例,体检发现5例,其余9例因咳嗽等就诊。所有患者经病理检查确诊,其中手术肺叶切除32例,经皮胸穿刺活检和纤维支气管镜活检2例,经颈部淋巴结活检4例。
1.2 扫描设备与方法 采用Siemens Soma-tom Definition flash 64层双源CT机。扫描条件:120 kV,110 mA;层厚1.5 mm,层距5 mm。观察参数:肺窗宽1 500 HU,窗位600 HU;纵隔窗宽350 HU,窗位40 HU。于患者吸气状态下从肺尖至肺底连续扫描。所有患者CT平扫后增强扫描,采用高压注射器于肘静脉推注对比剂碘海醇85 mL(300 mgI/mL),注射速度为3.0 mL/s,注射开始后20 s、50 s分别扫描。
1.3 图像处理及分析 将扫描获得的图像数据,通过Annet RIS系统V2.10.0传送至MMWP工作站进行后处理:(1)横断位薄层重组,参数为层厚1.5 mm、层距1.5 mm、视野31 cm; (2)多平面重组(MPR),多角度显示病灶。由两名高年资放射诊断医师单独阅片,意见有分歧时通过商讨达成共识。
1.4 观察指标 包括病灶分布、大小、形态(肿块、结节、片状)、瘤肺界面(清晰、不清晰)、边缘形态(分叶、毛刺)、内部结构(空泡征、充气支气管征)、邻近结构改变(胸膜凹陷征)、有无纵隔淋巴结肿大及胸膜、胸壁侵犯,以及CT增强是否均匀。影像学观察指标定义:肿块,指病灶最大直径≥3 cm的边界清楚或模糊的致密影;结节,指最大直径<3 cm的边界清楚的类圆形致密影,其中病灶直径5~10 mm称为小结节,直径<5 mm称为粟粒结节;肺实变是指在病变区密度均匀增加的病灶,可有充气支气管征;充气支气管征是指在病变肺组织区域中见到透亮的支气管影;空泡征是指结节内直径<5 mm的小灶性透光区;胸膜凹陷征是指肺内病灶邻近脏层胸膜,胸膜尖端指向病变且横断面呈喇叭样的凹陷;纵隔淋巴结短径≥1.0 cm时则提示淋巴结肿大。病理检查:采用2011国际肺腺癌新分类[1]进行分析诊断。标本行常规固定并苏木精-伊红(HE)染色、免疫组织化学染色。
2 结 果
2.1 MSCT表现 38例原发性肺IMA患者中,30例原发病灶(结节或肿块、片状)为单发,其中上叶9例,中叶2例,下叶19例。8例原发病灶为多发,其中多发结节伴片状实变影3例,肺内有多发片状实变影5例。
2.2 肺内MSCT征象单发结节或肿块22例(图1a、图1b),肿瘤最大直径为8~71(8.99±1.56)mm,其中9例为不规则肿块状,13例呈结节状(混合磨玻璃结节2例,实性结节11例)。13例瘤肺界面清晰,9例瘤肺界面不清晰。边缘分叶状5例,毛刺状 7例。病变内空泡征且分布于病灶边缘部7例;肿瘤内部见充气支气管征6例;结节或肿块见胸膜凹陷征7例。CT增强扫描肿瘤密度均匀7例,不均匀15例。肺内片状实变影13例(图1c1、图1c2),可单发或多发。实变影可见空气支气管征11例;支气管狭窄、僵直、粗细不均7例;实变肺密度较低,低于同层胸壁软组织密度影,增强扫描实变肺大部分区域未见明显强化3例。两肺多发结节伴片状实变影3例(图1d),结节沿小叶呈中心型分布或沿支气管中心的位置分布,大小不一,边缘模糊,可见支气管血管束增粗、模糊。纵隔或肺门淋巴结肿大10例,CT增强扫描,病变淋巴结呈轻至中等强化。胸膜、胸壁侵犯15例,胸膜腔积液10例。
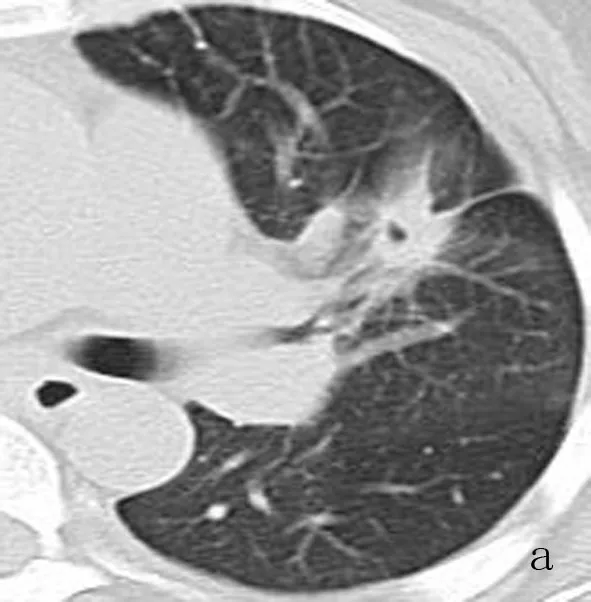


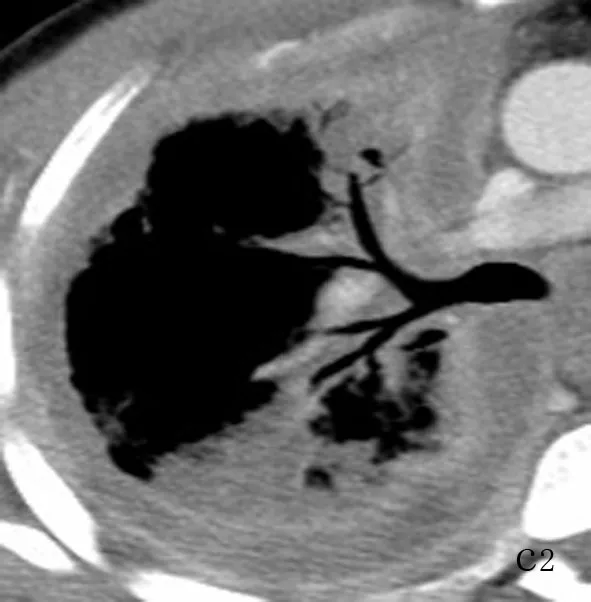

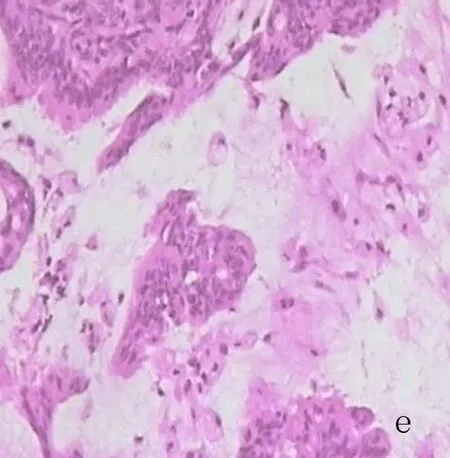
a:女,43岁,左肺上叶上舌段原发性肺IMA,病灶呈结节状,边缘分叶、毛刺,内见小空泡征;b:女,52岁,左肺上叶舌段原发性肺IMA,病灶呈不规则肿块状,边缘光滑;c:男,42岁,右肺叶原发性肺IMA,平扫肺窗示病灶累及大部分右肺,呈大片状,边缘模糊,右侧胸膜腔少量积液,增强扫描静脉期纵隔窗示病灶轻度不均匀强化,内见空气支气管征;d:男,32岁,两肺原发性肺IMA,结节弥漫分布,大小不一,部分病灶相互融合成片状,右侧胸膜腔少量积液;e:女,51岁,原发性肺IMA,病理图示肿瘤细胞呈腺管状,细胞核位于基底部,内见大量黏液(HE×200)
图1 原发性肺IMA的CT及病理表现
2.3 病理检查 38例病例中大体肿物呈灰白色、半透明状,似胶冻。镜下肿瘤细胞排列成细支气管肺泡结构或腺腔,细胞呈柱状或杯状,胞质丰富、透亮呈分泌状,胞核位于基底,细胞异型不明显或轻度,核分裂象罕见,肺泡及腺腔内充满黏液(图1e)。本组有19例行免疫组织化学检查,其中15例CK7阳性,16例TTF-1阳性,12例TTF-1部分阳性,CK20阴性和Napsin-A阳性各10例,CK阳性6例。查阅患者相关病例资料,排除继发性肺黏液腺癌。
3 讨 论
黏液腺癌多见于消化道,原发于肺部的较为少见。原发性肺IMA是肺腺癌的一种特殊类型[5]。本组38例患者均为原发性肺IMA。原发性肺IMA的病理特征为癌组织呈界限不清的灰褐色、柔软、半透明似胶冻状。癌细胞产生的细胞外黏液形成大小不等的黏液池(黏液湖),常可见成堆或散在的癌细胞漂浮在其中[6]。本病好发于中老年,本组患者年龄30~79岁,中位年龄53.5岁,与文献报道的57岁大致相符[7]。本病的临床表现缺乏特异性,主要表现为咳白色黏液样痰、痰中带血、咳嗽、胸闷气短等[8]。本组病例中,咳白色黏液样痰18例,占47.4%,相对其他临床表现出现率较高,此临床症状虽然无特异性,但不排除原发性肺IMA的可能。
本病的影像学表现多样,结合文献[3-4,9]和本组的MSCT表现,肺内病灶主要有以下表现。(1)孤立结节或肿块,除有一般肺癌的CT征象(分叶状、短毛刺、胸膜凹陷等)外,尚有以下几个特点:①瘤肺界面清晰,PPMA病灶大多数边界较清晰。秦冬雪等[4]分析的 28个PPMA病变中,瘤肺界面清晰者22例(78.57%),与本组数据大致相符。②小空泡征出现率高,其病理学特征为肿瘤细胞沿管壁浸润性生长,使管腔形成活瓣样阻塞,气体容易进入肺泡腔但难以出去,致肺泡腔过度充气[10]。本组22例中7例(31.8%)有此征象,多在病变边缘部出现。③肿瘤内细支气管充气征,其病理基础主要是尚未被肿瘤破坏、替代的肺结构[11]。本研究22例单发结节或肿块中,有6例(27.3%)出现此征象。④CT增强肿瘤无或轻度强化,由于肿瘤内含有黏液成分,增强扫描肿瘤密度不均匀出现率高[9]。本组22例中有15例(68.2%)增强时肿瘤表现为不均匀强化,未见或仅见轻度强化密度灶。MSCT表现进一步证实了以上表现,仅不同征象的出现率有所不同。(2)肺内片状实变影,实变型原发性肺IMA是唯一在影像学上表现为非支气管阻塞性的实变肺癌[3,9],其有相对特异的CT表现:①肺段、叶性实变内的充气支气管呈枯树枝状走形。本研究有13例片状实变影,其中有11例(84.6%)可见充气支气管征,大部分支气管狭窄、僵直、粗细不均,其病理是肿瘤细胞沿支气管壁伏壁生长及肺泡腔内黏液挤压。②实变密度常低于肌肉的密度,本组仅有3例(23.1%)。(3)两肺叶多发结节伴片状实变影,结节沿小叶呈中心型分布或沿支气管中心的位置分布,结节大小不一、边缘模糊,可见支气管血管束增粗、模糊。本组出现3例(7.9%),此征象有助于诊断原发性肺IMA。(4)纵隔或肺门淋巴结肿大,病灶相邻的胸膜、胸壁侵犯及胸膜腔积液。原发性肺IMA多发生转移,以淋巴结转移最常见;很少侵犯胸膜,而周围型肺癌胸膜侵犯较常见[4]。本研究中纵隔或肺门淋巴结肿大10例(26.3%),胸膜、胸壁侵犯15 例(39.5%),后者与相关文献报道对比,转移发生率相对高,有待进一步研究。
综上所述,原发性肺IMA的影像表现具有一定特点,正确认识其影像学特征,有助于理解与认识该病变,但确诊需要病理活检,并结合免疫组织化学排除胃肠道转移。

