山奈、白芷和香叶对猪肉加热过程中晚期糖化终末产物含量的影响
陈 铭 吴 帅 黄轶群 牛丽红 樊玉霞,4 赖克强,4
(1.上海海洋大学食品学院,上海 201306;2.长沙理工大学化学与食品工程学院,湖南 长沙 410114;3.鲁东大学食品与工程学院,山东 烟台 264035;4.上海海洋大学食品热加工工程技术研究中心,上海 201306)
食源性晚期糖化终末产物(Advanced glycation end-products,AGEs)是在非酶促反应条件下,主要通过葡萄糖、果糖等还原糖的羰基和蛋白质、多肽、氨基酸或核酸的氨基,经过一系列复杂的反应而产生的一组化学结构稳定的化合物[1-2],如羧甲基赖氨酸(Nε-carboxymethyllysine,CML)、羧乙基赖氨酸(Nε-carboxyethyllysine,CEL)和吡咯素等。食源性AGEs在人体内的积累,与人体的衰老和一些慢性疾病的发生(如阿尔茨海默病、慢性肾病、高血压等)有关[3-4]。因此,膳食中的AGEs含量、形成与控制成为近10年来食品安全领域的研究热点之一。
肉类食品中富含蛋白质和脂肪,有利于AGEs的形成,加之肉类食品往往经较高温度或长时间煮制,极大地促进AGEs的产生[5-6],故而肉类食品中的AGEs含量通常很高,具有潜在的安全隐患。目前,肉类食品AGEs相关的研究较为缺乏,基本还停留在收集数据阶段,主要集中在不同的加工方式(蒸煮、油炸、辐照、烘焙等)及原料组分(包括肉的种类、脂肪和蛋白质含量、酱料、亚硝酸盐和食盐等添加剂)对AGEs含量的影响[6-8],近年来,储藏过程对肉品中AGEs含量及其后续热加工过程中AGEs形成的影响也有报道[8-9]。
香辛料(如八角、香叶、白芷、山奈等)常用于肉品的烹饪及加工中,以赋予其一些特有的风味。有关香辛料的挥发性成分以及香辛料的抗氧化作用方面的研究报道很多,此外,柠檬草、姜黄、咖喱姜、八角、小茴香等香辛料被用来降低牛肉及其制品中杂环胺的含量[10-11]以及猪肉中丙烯酰胺的含量[12]。近几年来,有研究表明,香辛料可以抑制蛋白质的糖化作用,例如,Cazzola等[13]在牛乳清蛋白—葡萄糖模拟体系中加入鼠尾草、辣椒、洋葱、大蒜、迷迭香等,可以抑制30%~75%蛋白质糖化作用;Ramkissoon等[14]在同样的模拟体系中加入百里香、欧芹及其他混合香辛料,可以抑制10%~40% AGEs含量;Hafsa等[15]采用莫邪菊的醇溶性提取物,最高可减少牛乳清蛋白—葡萄糖体系中77.8%的AGEs形成。但是,这些香辛料对AGEs的影响的研究都是采用简单的模拟体系,而且都是采用荧光分光光度法分析添加香辛料的样品与空白对照样品的某一特征波长的荧光强度的相对变化,并未分析具体的AGEs含量。经检索,迄今尚未见常用香辛料对肉品中AGEs含量的影响的研究报道。
本研究拟以猪肉为对象,采用超高效液相色谱—串联质谱联用仪(UPLC-MS/MS)结合CML和CEL的同位素内标物作为AGEs的分析方法,研究山奈、白芷和香叶3种肉品加工中常用食用香料的添加,对猪肉在加热过程中AGEs形成的影响,为最终减低肉制品中AGEs的含量提供试验依据。
1 材料与方法
1.1 材料与仪器
猪肉:里脊肉,上海市浦东新区惠南镇爱森优选店;
香料:香叶、白芷、山奈,购于上海市麦德龙(上海浦东龙阳路店);
浓盐酸、氢氧化钠、氨水、氯仿、硼氢化钠、硼酸、硼砂:分析纯,国药集团化学试剂有限公司;
甲醇、甲酸、乙酸铵:色谱纯,百灵威公司;
AGEs标准品和内标物:d4-CML、d4-CML、CML、CEL(纯度均为98%),加拿大Toronto Research Chemicals公司。
李晓英眼泪横流。倏地,她的右手掌,猛地托住陈山利的后脑,左手拦腰拥住他,将整个身体贴近他,她漆黑的眼瞳,温柔地望向他。他的后颈,被穿过发丝的手按住,唇瓣间传来湿润的触感,被她轻轻含住,缓缓亲吻……
高速组织捣碎机:HGBTWTS3型,美国 Waring Commercial 公司;
真空干燥箱:DZF-6050型,上海精宏真空设备有限公司;
手持式均质机:T10型,德国 IKA 公司;
数显鼓风干燥箱:GZX-9146 MBE型,上海博迅实业有限公司医疗设备厂;
离心机:TDL-5-A型,上海安亭科学仪器厂;
阳离子交换固相萃取小柱:CNWMCX混合型(60 mg/3 mL),上海安谱实验科技股份有限公司;
氮吹仪:DC-12型,上海安谱实验科技股份有限公司;
超高效液相色谱仪:A-30型,美国 PerkinElmer公司;
三重四级杆质谱仪:Qtrap 4500型,美国SCIEX质谱系统公司。
1.2 试验方法
1.2.1 标准溶液的配制 配制标准品和内标的母液CML(100 mg/L)、d4-CML(100 mg/L)、CEL(200 mg/L)、d4-CEL(200 mg/L),放置于4 ℃冰箱保存。将上述CML和CEL母液混合配制成4 mg/L标准液,d4-CML和d4-CEL混合配制成含4 mg/L混合内标液(d4-CML-CEL),并放置在-20 ℃冰箱贮藏。
1.2.2 猪肉的加热处理 去除猪肉里脊表面可见的筋膜,将其切成大约1×1×1 cm3的小方块,按猪肉重量添加1%的白芷、山奈或香叶,用搅拌机混匀。随后称取约13 g的肉糜置于金属铝盒(内径50 mm;内高5 mm)中,在100 ℃油浴锅中加热5,10,20,40,120 min后,取出,在冰水混合物中冷却30 min,收集猪肉样及其汁水于研钵中研磨均匀,放置于自封袋中冰藏,并在60 min内用于AGEs提取。采用不同批次的猪肉重复试验2次。
1.2.3 猪肉中结合态CML和CEL的提取 猪肉中结合态AGEs含量的提取方法参照 Assar 等[16]、Niquet-Léridon 等[17]和Niu等[8]的提取方法,具体的提取过程如下:称取约0.2 g的肉样,加入2 mL硼酸钠缓冲液(0.2 mol/L,pH 9.2)和0.4 mL硼氢化钠溶液,混合后置于0 ℃冰箱中过夜还原12 h;加入4 mL氯仿—甲醇(体积比2∶1),震荡混匀,在5 000 r/min条件下离心10 min,去除脂肪并沉淀蛋白质;去除液态层,向沉淀的蛋白质中加入4 mL盐酸(6 mol/L),然后在110 ℃温度下酸解24 h;将水解液稀释至10 mL容量瓶中,移取2 mL,加入0.2 mL混合内标液d4-CML-CEL (4 mg/L)后,进行真空干燥;用4 mL超纯水重新溶解,并震荡混匀,后经SPE固相萃取净化,将最终洗脱液经氮气吹干后,溶解于2 mL甲醇—水(体积比80∶20)溶液中,再经0.22 μm滤膜过滤后,进行UPLC-MS/MS分析。每个样品进行3次平行试验。
1.2.4 基于UPLC-MS/MS分析样品中的CML和CEL含量 采用PerkinElmer Altus A-30 UPLC色谱仪和 Qtrap 4500三重四级杆质谱仪在正电喷雾电离模式下,对提取液中AGEs含量进行分析。仪器测定条件参照牛丽红[18]的方法,其中,质谱检测的定性定量条件如表1所示,分别采用m/z209→88和m/z223→88作为d4-CML和d4-CEL的定量子离子,m/z205→130和m/z219→130作为CML和CEL的定量离子。标准曲线中 CML、CEL的浓度范围各为20~800 ng/mL。
1.2.5 蛋白质、脂肪、水分的测定 按2007年AOAC标准执行,分别采用凯氏定氮法测定样品中蛋白质含量(AOAC 928.08-2007)、索氏提取法测定脂肪含量(AOAC 991.36-2007)以及烘箱干燥法测定水分含量(AOAC 950.46-2007)。每个样品进行3次平行试验。
1.3 数据处理
除非特别说明,猪肉中AGEs、蛋白质等含量按肉样的重量计算。
采用Microsoft Excel 2013对试验数据进行分析,用以下动力学反应方程式对CML和CEL的形成速率及反应级数进行拟合或计算:
(1)
表1在多反应监测模式下检测CML、CEL、d4-CML和d4-CEL所用的质谱参数
Table 1 Mass parameters in multiple reaction monitoring mode for CML,CEL,d4-CML and d4-CEL

分析物母离子(m/z)子离子(m/z)去簇电压(DP)/V碰撞能(CE)/VCML2051306615846625CEL2191306517846525d4-CML2091346815886825d4-CEL2231347317887325
式中:
k——反应速率常数,mg/(kg·min);
t——反应时间,min;
c——CML或CEL的在时间t时的浓度,mg/kg;
n——反应级数(本试验验证反应级数为0,1,2)。
依照化学方程式(1)所示,分别以c(n=0),lnc(n=1),1/c(n=2)为y轴,时间t为x轴作图,根据其线性的相关系数R2的大小确定反应级数。
2 结果与分析
2.1 加热对猪肉中AGEs含量的影响
试验中所用猪肉样品的水分、蛋白质和脂肪的百分比含量分别为(73.63±0.78)%~(75.38±1.07)%、(22.10±0.78)%~(24.10±0.94)%和(0.52±0.04)%~(3.47±0.29)%。
表2为两不同批次的新鲜猪肉及其在100 ℃下加热后CML和CEL的含量,新鲜猪肉中CML含量为(6.79±0.13)~(7.32±0.46)mg/kg,CEL含量为(2.21±0.12)~(2.80±0.26)mg/kg,与其他研究的结果相似[19-20],随着加热时间的增加,CML和CEL的含量也逐渐增加,尤其是经120 min加热后,猪肉中CML的含量高达(35.60±2.20)~(40.68±5.66)mg/kg,CEL达(13.32±1.49)~(16.85±2.44)mg/kg,比生肉的AGEs含量增加约5~8倍,表明长时间加热对猪肉中AGEs的含量影响很大,远高于已报道的一些经油炸或高温炙烤的高AGEs含量的肉类食品,如在160 ℃下加热72 min的猪肉中,CML含量为26 mg/100 g·蛋白质[19];在140 ℃ 下油炸4 min的猪肉中,CML含量为105 mg/kg·蛋白质[21];在204 ℃下油炸20 min的牛肉和猪肉中,CML含量分别为20.03,17.53 mg/kg[22]。高温条件下,猪肉中的美拉德反应、蛋白质和脂肪氧化反应加速,促进AGEs或其活前体物的形成,从而增加AGEs的含量[19-22]。

表2 生肉及加热处理(100 ℃,5~120 min)后猪肉中的羧甲基赖氨酸(CML)和羧乙基赖氨酸(CEL)含量Table 2 The amounts of Nε-carboxymethyllysine (CML)and Nε-carboxyethyllysine (CEL)in raw and heat treated (100 ℃,5~120 min)pork (n=3)
因生肉本身含有AGEs,加热后猪肉中CML或CEL含量减去生肉中CML或CEL的含量,即为加热过程中猪肉的CML和CEL的生成量,图1为两批猪肉加热过程中CML和CEL的形成量,在加热的前40 min,猪肉中CML和CEL的形成速度快,在40~120 min时,CML和CEL生成速度减慢。猪肉中CML和CEL的形成量与加热时间(0~40 min)的关系基本符合零级反应动力学方程(R2=0.942~0.981)(表3),意味着CML和CEL的浓度对其生成速率无影响,食品中美拉德的反应产物的形成速率大多数都属于零级反应,是由于生成物浓度通常远低于反应物的浓度[20]。在0~40 min时间内,CML的反应速率为0.41~0.56 mg/(kg·min),CEL的反应速度为0.15~0.27 mg/(kg·min),表明CML和CEL在不同的反应时间里的生成速率是不同的,可能是由于CML和CEL的形成途径不尽相同,如其对应的前体物质乙二醛和甲基乙二醛的生成速率不同,进而导致CML和CEL的生成速率不同。Sun等[20]发现牛肉在加热过程(在100 ℃,0~60 min)中也存在相似的规律:其AGEs的形成为零级反应(R2=0.902~0.907),CML的生成速率[0.23 mg/(kg·min)]高于CEL为的生成速率[0.12 mg/(kg·min)]。

图1 猪肉加热过程中(100 ℃,5~120 min)羧甲基赖氨酸 (CML)和羧乙基赖氨酸(CEL)的形成量Figure 1 The amount of Nε-carboxymethyllysine (CML)and Nε-carboxyethyllysine (CEL)in pork formed during heating (100 ℃,5~120 min)
表3不同动力学模型下(n=0,1,2)猪肉中羧甲基赖氨酸 (CML)和羧乙基赖氨酸(CEL)含量变化与加热时间(100℃,0~40 min)的线性相关系数(R2)
Table 3 Correlation of determination(R2)for kinetic models(n=0,1 or 2)of the formation ofNε-carboxymethyllysine(CML)andNε-carboxyethyllysine(CEL)during heating(100℃,0~40 min)
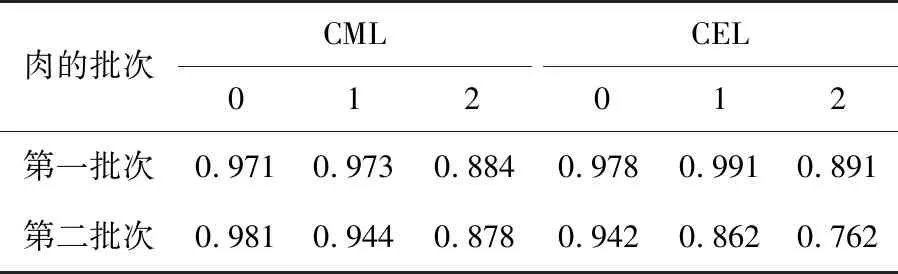
肉的批次CML012CEL012第一批次0.9710.9730.8840.9780.9910.891第二批次0.9810.9440.8780.9420.8620.762
2.2 香料对猪肉加热过程中AGEs含量的影响
表4为2个批次的猪肉分别加入山奈、白芷、香叶在100 ℃条件下加热后结合态CML和CEL的含量,从中可知:与未加香料的猪肉相类似,加热时间越长,加入香料处理的肉中CML和CEL的含量越高,加热的前40 min,CML和CEL的增长速度较快,40~120 min时CML和CEL增长速度较缓慢;加入香料的两批肉样,加热不同时间后产生的CEL均比对应的未加香料的高,尤其是5 min加热处理的样品,其CEL含量平均增加42%(山奈,两批肉样分别为61%和24%)、30%(白芷,两批肉样分别为49%和13%)和34%(香叶,两批肉样分别为49%和20%),不过,加热120 min的样品,加入香料的肉样与未加香料的肉样相比其CEL差别较小,平均增加8~12%;香料对加热过程中CML的形成总体来说影响较小,而且因香料的种类、加热时间、肉的批次的不同而不同,尽管经120 min加热处理后,加入香料的肉样的CML平均增加15%(山奈,两批肉样分别为20%和9%)、23%(白芷,两批肉样分别为37%和8%)和20%(香叶,两批肉样分别为19%和22%),在其他的加热条件下,如加入白芷和香叶加热40 min的肉样,香料的加入可能对CML的形成有一定的抑制作用;对于CML和CEL的总量来说,山奈的加入,使得猪肉在加热过程中(5~120 min)的AGEs含量增加6%~30%,而肉中添加白芷和香叶除了在120 min 加热条件下,使得AGEs总量分别增加19%(白芷,两批分别为27%和10%)和18%(香叶,两批肉样分别为15%和22%)外,在其他的加热条件下对加热过程中AGEs总量的产生的影响趋势不明确。

表4 生肉及含山奈、白芷、香叶的猪肉加热处理(100 ℃,5~120 min)后羧甲基赖氨酸(CML)和羧乙基赖氨酸(CEL)含量Table 4 The amounts of Nε-carboxymethyllysine (CML)and Nε-carboxyethyllysine (CEL)in raw and heat treated (100 ℃,5~120 min)pork added with galangal,angelica root or bay leaves (n=3)
山奈、白芷、香叶中存在一定数量的酚类、黄酮类物质,具有抗氧化性[23-25],另外,一些研究[13-15]表明,富含天然抗氧化剂的香辛料对蛋白质糖化反应有显著的抑制作用,而且,Kim等[26]还发现从白芷中提取的异欧前胡素能够有效地减少牛血清蛋白—葡萄糖果糖体系中16.3% 的吡咯酮含量。但是,本研究在猪肉中直接添加山奈、白芷或香叶粉,对加热过程中CML和CEL的产生不但没有明显的抑制作用,而是显示出一定的促进作用,因AGEs产生途径复杂多样,且目前缺乏香辛料对AGEs变化的影响报道,山奈、白芷、香叶对猪肉加热过程中AGEs形成的潜在促进作用的机理有待进一步明确。
与未加香料的猪肉类似,加入山奈、白芷或香叶后的猪肉在加热过程中(0~40 min),其CML和CEL的形成均为零级反应,CML的和反应速率为0.434~0.531 mg/(kg·min)(R2=0.985~0.992),CEL反应速率为0.249~0.288 mg/(kg·min)(R2=0.984~0.989)。另外,如图2所示,试验中所涉及的所有猪肉样品中CML与CEL含量有较强的线性相关性(R2=0.882)。
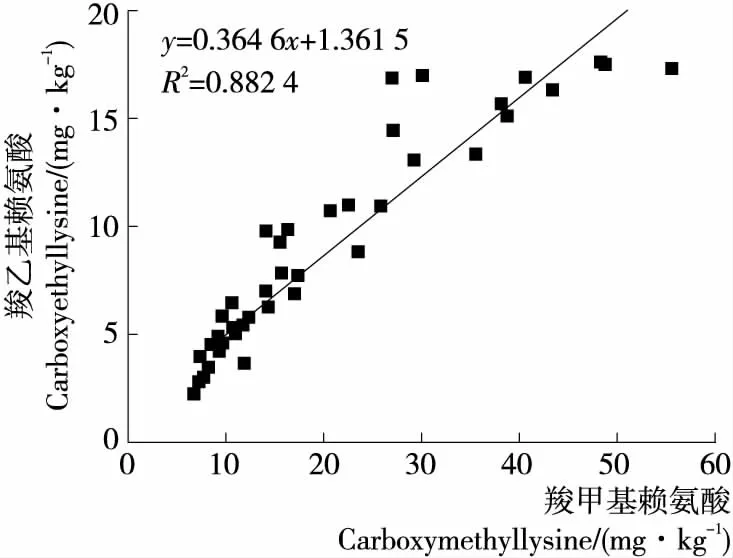
图2 猪肉中羧甲基赖氨酸(CML)和羧乙基赖氨酸(CEL)含量的相关性Figure 2 Relationship between Nε-carboxymethyllysine (CML)and Nε-carboxyethyllysine(CEL)in pork
3 结论
加热对猪肉中结合态CML和CEL的形成有促进作用,且加热时间越长,其AGEs含量也越大,当加热到120 min 后,CML和CEL的含量约为生肉的5~8倍。加热时间为0~40 min时,不管是否添加香料,CML和CEL的反应速率均为零级反应(R2=0.942~0.992)。肉中添加白芷、山奈或香叶,对加热过程中AGEs的影响因香料的种类、加热时间、肉的批次的不同而不同,总体来说,香料对加热过程中猪肉的CML的形成影响较小,但对CEL的形成有一定的促进作用,尤其是5 min加热处理的肉样,其CEL含量增加13%~61%。山奈、白芷、香叶对猪肉加热过程中AGEs形成的潜在促进作用的机理有待进一步明确。此外,其他常用香料,如八角、小茴香等或者复合香料对肉类食品加工及储藏过程中AGEs形成的影响尚待研究,这些研究将有助于预测肉类食品在不同的加工条件下AGEs的形成规律,对肉制品的工业生产具有重要的指导意义。

