MIBK加氢制MIBC热力学研究
祁文博,艾抚宾,乔 凯,袁 毅,彭绍忠
(中国石化 大连石油化工研究院,辽宁 大连 116045)
甲基异丁基醇(4-甲基戊醇-2,简称MIBC)是一种性能优良的惰性溶剂,可用作石油、石蜡、树脂、橡胶、纤维素、染料等的溶剂,能增加涂料的光泽度和平整性,并且能够改进发白现象,最主要的是作为矿石精选的浮选剂,有较大的市场需求。
大连(抚顺)石油化工研究院从20世纪80年代就开始丙酮化学的研究,先后开发了丙烯水合-脱氢制丙酮、丙酮加氢制MIBK、丙酮加氢制异丙醇等技术,如何把丙酮转化为附加值高的化工产品,开发出多种具有实用性和经济价值的丙酮衍生物,对丙酮化学技术的工业化有重要的实际意义。大连(抚顺)石油化工研究院开发的丙酮加氢一步法生产MIBK技术已工业化,若MIBK加氢制备MIBC技术开发成功,可延长产业链、提高MIBK装置对市场的适应性。
为了深入了解MIBK加氢制备MIBC反应的特点,控制好反应,优化反应条件,需要对该反应进行热力学方面的研究。本文计算了气相及液相反应时的标准摩尔生成焓和反应平衡常数。此外,研究了反应温度、压力及氢酮物质的量比(以下简称氢酮比)对反应平衡转化率的影响,为该技术的工艺条件设计提供了理论依据。
1 气相反应热力学计算
1.1 Cpm与T之间的函数关系
MIBK加氢制MIBC的反应方程式为:

从文献[1]和[2]中查出MIBK及MIBC在不同温度下的定压热容,见表1。经过多项式回归得到MIBK和MIBC的Cpm与T之间的函数关系式,氢气的相关参数从文献[1]中查出,见表2。

表1 气相条件下MIBK及MIBC各温度下的定压热容

表2 MIBK及MIBC的Cpm与T之间函数关系
用 Benson 基团贡献法[3],利用公式(2)和(3)计算 MIBK 及 MIBC 的 ΔfHmΘ,SmΘ。


式 (2)中nj为j种基团数;ΔH为各种基团数对ΔfHmΘ的贡献参数;Ci为第i种修正参数 (σ 和 η除外)。 式(3)中nj为j种基团数;ΔS为各种基团数对SmΘ的贡献参数;σ为对称数;η为对映(光学)异构体数。表3为MIBK及MIBC中各基团对理想气体标准热化学性质的贡献。

表3 MIBK及MIBC中各基团对理想气体标准热化学性质的贡献
根据表 3 中的数据,用公式(2)和(3)计算出MIBK 的 ΔfHmΘ(g)为-287.88kJ·mol-1,SmΘ(g)为 407.06J·mol-1·K-1;MIBC 的 ΔfHmΘ(g)为-344.09kJ·mol-1,SmΘ(g)为 419.13J·mol-1·K-1。 从文献[3]中查出氢气的 ΔfHmΘ(g)为 0kJ·mol-1,SmΘ(g)为 130.59J·mol-1·K-1。
1.3 气相反应的ΔrHm及K计算
根据公式 (4)~(6) 计算出 MIBK加氢制备MIBC气相反应的ΔrHm及K。
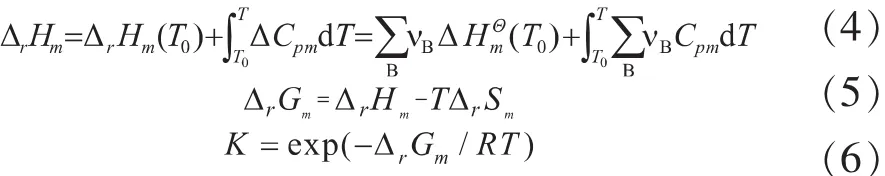

图1 MIBK加氢气相反应的ΔrHm及K
由图1中数据可以看出,反应的标准摩尔焓变都小于0,是放热反应,且气相反应的焓变随反应温度的升高而增加。反应平衡常数随反应温度的升高而减小。在低温下,反应平衡常数较大,这说明低温有利于气相反应的进行。
2 液相反应热力学计算
2.1 Cpm与T之间的函数关系
从文献[1]和[2]中查出MIBK及MIBC在不同温度下的定压热容,见表4。经过多项式回归得到MIBK和MIBC的Cpm与T之间的函数关系式,氢气的相关参数从文献[3]中查出,见表5。

表4 液相条件下MIBK及MIBC各温度下的热容

表5 MIBK及MIBC的Cpm与T之间函数关系
式(8)中 Tr=T/Tc,Tc为临界温度; ai,bi,ci为基团i的预测参数,Ni为分子中基团的数目。MIBK及MIBC的Tc[1-2]分别为574.6K、574.4K。表6为MIBK及MIBC的Tu-Liu基团贡献法参数值[3]。
2.2 液态组分焓的计算
各组分在标准状态下的液相摩尔生成焓的ΔfHmΘ(l)等于气相摩尔生成焓 ΔfHmΘ(g)减去蒸发焓ΔvHmΘ,计算公式见式(7)。标准状态下各组分的 ΔvHmΘ采用Tu-Liu基团贡献法[3]计算,公式见式(8)。
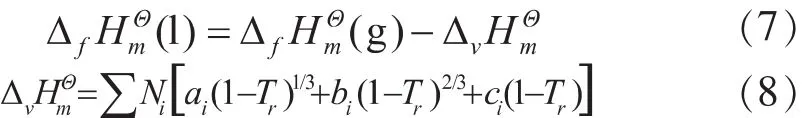
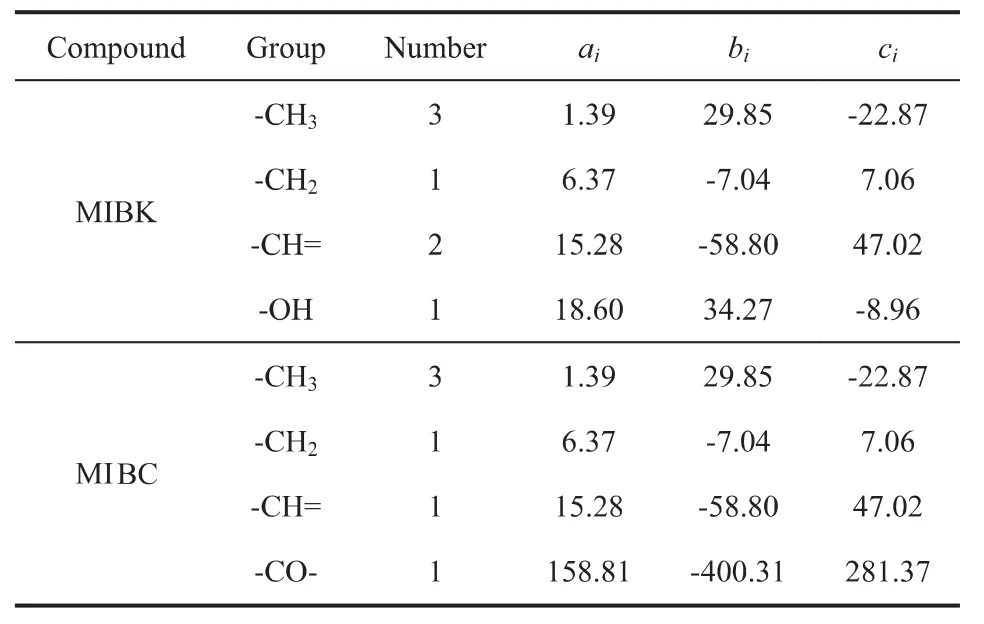
表6 MIBK及MIBC的Tu-Liu基团贡献法参数值
根据表 6 中的数据,用公式(7)和(8)计算出MIBK 的 ΔfHmΘ(l)为-330.25kJ·mol-1,MIBC 的 ΔfHmΘ(l)为-401.45kJ·mol-1。
2.3 液态组分熵的计算:
各组分在标准状态下的液相摩尔熵SmΘ(l)等于气相摩尔熵 SmΘ(g)减去蒸发熵 ΔvHmΘ[3],计算公式见式(9)。标准状态下各组分的ΔvHmΘ采用赵国良经验式[3]计算,公式见式(10)。

式(9)中A和B为经验常数,Tb为沸点。MIBK的A、B、Tb[1-3]分别为 125.52、-222.59、389.7K;MIBC 的A、B、Tb[1-3]分别为 390.58、-894.16、404.9K。
根据公式 (8) 和 (9) 计算出MIBK的SmΘ(l)为304.46J·mol-1·K-1,MIBC 的 SmΘ(l)为 274.91J·mol-1·K-1。
2.4 液相反应的ΔrHm及K计算
根据公式 (4)~(6) 计算出 MIBK加氢制备MIBC液相反应的ΔrHmΘ及K。

图2 MIBK加氢液相反应的ΔrHm及K
由图2中数据可以看出,液相反应与气相反应类似,也是放热反应,不同的是液相反应的焓变随反应温度的升高而降低。液相反应平衡常数与气相反应平衡常数类似,也随反应温度的升高而减小,这说明低温有利于液相反应的进行。
3 反应平衡转化率的影响
对于MIBK加氢制MIBC反应,影响反应平衡转化率的主要因素是温度、压力和氢酮比。温度是影响化学平衡的重要因素。因为标准平衡常数只是温度的函数,不同温度下标准平衡常数值不同,从而化学平衡时体系的组成不同。在有气体参与的反应中,压力往往会对反应体系的平衡组成产生影响。对于气体分子数减小的反应,增加系统的总压,平衡会向右移动,有利于正反应进行。对于两种及以上反应物参加的反应,可通过反应物的配比(氢酮比)来改变反应的平衡组成。MIBK加氢时氢气容易从混合气中分离,为了MIBK能反应充分,可使氢气过量来尽量提高MIBK的平衡转化率。
为了方便计算MIBK加氢制备MIBC的平衡转化率,做两点假设:(1)反应体系为理想气体混合物;(2)反应在恒温恒压下进行。
在MIBK加氢制备MIBC过程中,设反应体系压力为p,温度为T,反应起始时氢酮比为n,MIBK为1mol,反应平衡后,生成的MIBC为ymol。反应平衡时体系中总的物质的量为w=1+n-y,标准平衡常数与各组分平衡组成的关系[4]见式(11):
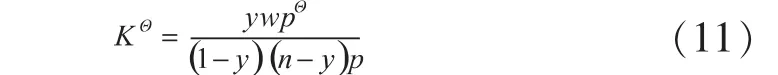
3.1 温度对反应平衡转化率的影响
在氢酮比为10,反应压力为4.0MPa的情况下,MIBK加氢平衡转化率随反应温度的变化关系如图3所示。
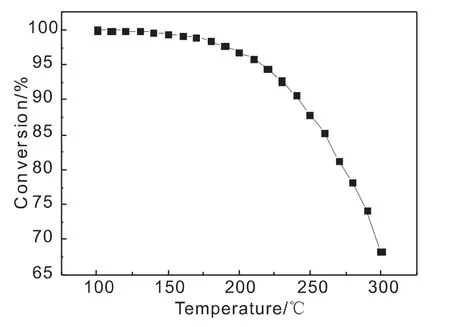
图3 温度对反应平衡转化率的影响

图4 压力对反应平衡转化率的影响
从图3可以看出,MIBK的平衡转化率随温度的升高而降低,160℃后降低的尤为明显。说明从热力学角度低温有利于反应的进行。反应温度≯160℃时,MIBK的平衡转化率都>99%;反应温度≯240℃时,MIBK的平衡转化率都>90%。
3.2 压力对反应平衡转化率的影响
在反应温度160℃,氢酮比为10的情况下,MIBK加氢平衡转化率随反应压力的变化关系如图4所示。
从图4可以看出,MIBK的平衡转化率随压力的升高而增大,说明增加反应压力有利于反应的进行。大于3.5MPa后,MIBK的平衡转化率都高于99%,且在此之后压力的变化对平衡转化率的影响逐渐变小。
3.3 氢酮比对反应平衡转化率的影响
在反应温度160℃,反应压力为4.0MPa的情况下,MIBK加氢平衡转化率随氢酮比的变化关系如图5所示。
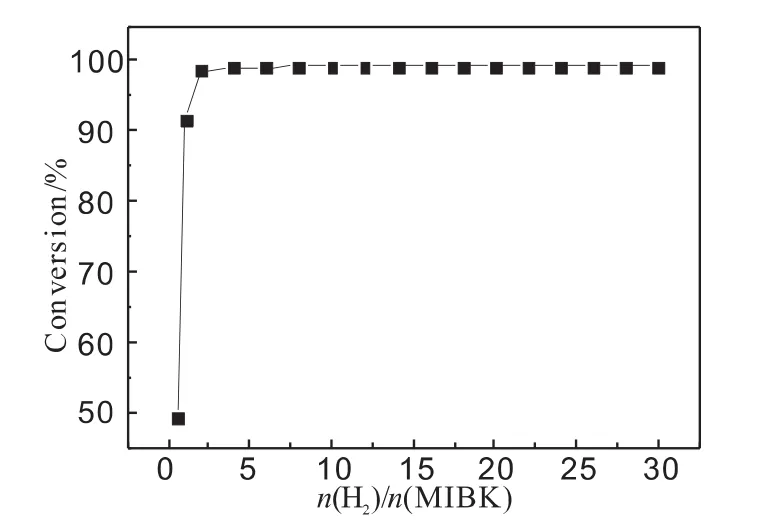
图5 氢酮比对反应平衡转化率的影响
从图5可以看出,MIBK的平衡转化率随氢酮比的升高而增大,当氢酮比为0.5时,MIBK过量,平衡转化率只为48%;当氢酮比为1.0时,平衡转化率也仅能达到92%;当氢酮比为2.0时,此时的平衡转化率即可接近99%。说明提高氢酮比有利于反应的进行。但当氢酮比大于2.0后,氢酮比的升高对MIBK平衡转化率的影响变得很小。
4 结论
MIBK加氢制备MIBC的反应是放热反应,温度对反应焓变的影响较小,但对反应平衡常数的影响较大,反应平衡常数随温度的升高而迅速减小,当气相反应的反应温度高于170℃、液相反应的反应温度高于190℃时,反应平衡常数开始小于1,且温度的升高对平衡常数的影响逐渐变小。
通过研究反应温度、压力及氢酮比对反应平衡转化率的影响,确定出MIBK加氢制MIBC适宜的反应条件为:反应温度为≯240℃,反应压力≮3.5MPa,氢酮比≮2。
符号说明
Cpm等压摩尔热容,J·mol-1·K-1
T 温度,K
a,b,c,d 各物性经验常数
R 通用气体常数,8.314J·mol-1·K-1
ΔfHmΘ各组分在标准状态下的摩尔生成焓,kJ·mol-1
ΔfHm各组分的摩尔生成焓,kJ·mol-1
SmΘ各组分在标准状态下的摩尔熵kJ·mol-1
ΔrHm反应的焓,kJ·mol-1
ΔrSm反应的熵,kJ·mol-1
ΔvHmΘ蒸发焓,kJ·mol-1
ΔvSmΘ蒸发熵 kJ·mol-1
K 反应平衡常数
ΔrGm反应的吉布斯自由能,J·mol-1
PΘ标准状态下的压力,MPa

