ICSI联合IVM技术在卵巢低反应高龄患者中的应用
宋文妍,田成成,金海霞,石森林,马馥荟
随着社会经济的发展,越来越多的女性延迟生育及“二胎”政策的放开,寻求辅助生殖技术的高龄女性数量不断增加。而年龄是影响女性生育力的关键因素,随着年龄的增长,女性生育力逐年下降,卵巢中卵泡数量逐渐减少及卵母细胞质量下降[1]。同时高龄女性在促排卵周期中出现卵巢反应不良的概率也随之增大,且有相当一部分患者取出的卵母细胞为未成熟卵母细胞,这些未成熟卵母细胞大多因无法正常受精而被废弃。随着体外成熟(in vitro maturation,IVM)技术的发展,使未成熟卵母细胞有再利用的机会。然而对于这部分未成熟卵母细胞经IVM培养的临床价值尚存在争议。本文就卵巢低反应(poor ovarian response,POR)的高龄患者不同促排卵方案联合IVM培养的有效性做一初步探讨。
1 对象与方法
1.1 研究对象 回顾性分析2016年1月—2018年9月于郑州大学第一附属医院生殖医学中心行胞浆内单精子注射(intracytoplasmic sperm injection,ICSI) 联合IVM技术助孕治疗的81例患者,共81个周期,按不同促排卵方案分为:微刺激方案组(n=37)和拮抗剂方案组(n=44)。纳入标准:①年龄≥35岁;②获卵数≤3个;③本周期获得的卵子均未成熟;④卵巢低反应;卵巢低反应诊断标准[2]:①女方年龄≥40岁或其他可能引起低反应的危险因素;②既往曾发生过低反应(常规刺激方案卵泡数≤3个);③卵巢储备功能检测异常[基础窦卵泡数(AFC)<5~7个或抗苗勒管激素(AMH)<0.5~1.1 ng/mL];如果年龄或卵巢储备功能检测正常,患者连续两个周期应用最大化的卵巢刺激方案仍出现POR也可诊断。排除标准:①染色体异常的患者;②多周期均未获得成熟卵子的患者;③排除子宫畸形及其他内分泌疾病。经患者知情同意后将未成熟的GV期和MⅠ期的卵子经IVM培养,并签署知情同意书。
1.2 控制性促排卵方案 拮抗剂方案:月经周期第2~3天开始促性腺激素(gonadotropin,Gn)促排卵,当1个以上卵泡直径≥14 mm时同时添加促性腺激素释放激素拮抗剂(gonadotropin releasing hormone antagonist,GnRHA)思则凯(默克雪兰诺有限公司,德国)0.25 mg至人绒毛膜促性腺激素(hCG)注射日。当B超提示有1~2个卵泡直径≥18 mm时,用hCG扳机,36~37 h后取卵。
微刺激方案:月经周期第2~3天开始口服来曲唑(江苏恒瑞医药有限公司,中国)2.5~5 mg/d,根据卵泡生长情况加用国产尿人绝经期促性腺激素(hMG)75~150 IU,当B超提示有1~2个卵泡直径≥18 mm时,用hCG和/或促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist,GnRHa)扳机,36~37 h后取卵。
1.3 卵母细胞的获取及培养
1.3.1 卵母细胞的获取 注射hCG 36~37 h后经阴道B超引导下进行取卵。获卵后3~4 h将被颗粒细胞包裹的卵母细胞放入事先添加有80 U/mL透明质酸酶(美国Sigma公司Chemical Co.,St.Louis,M O)中30 s,用吸管吹吸去除颗粒细胞,然后在显微镜下观察卵母细胞的成熟情况,将无明显第一极体的未成熟卵母细胞(包括MⅠ期、GV期)放入IVM培养液(Sage Media TM Quinn’s系列试剂,美国)中37℃、6%CO2条件下培养24 h。
1.3.2 受精与胚胎培养 未成熟卵母细胞培养24 h后在显微镜下观察,收集有明显第一极体排出的成熟卵母细胞(MⅡ期)进行ICSI。授精完成后放入G-1培养液(Vitrolife公司,瑞典)中37℃、6%CO2条件下培养16~18 h后观察,有清晰双原核(2PN)为受精卵,随后观察记录胚胎发育情况,胚胎评分按Peter评分计算[3],Ⅰ级:卵裂球大小均匀,形状规则,透亮,碎片<10%;Ⅱ级:卵裂球稍不均匀或形状稍不规则,胞浆有颗粒现象,碎片10%~20%;Ⅲ级:卵裂球明显不均匀或形状明显不规则,胞浆有颗粒现象,碎片20%~50%;Ⅳ级:卵裂球严重不均匀或形状严重不规则,胞浆有颗粒现象,碎片>50%。
1.4 胚胎移植及随访 根据患者的激素水平及子宫内膜情况确定是否移植,移植后给予口服达芙通(AbbottBiologicals B.V,荷兰)及阴道黄体酮凝胶雪诺酮(默克雪兰诺,瑞士)等黄体支持。移植后14 d测血hCG值,移植后35 d B超检测提示有孕囊判定为临床妊娠。
1.5 统计学方法 应用SPSS21.0软件进行数据分析,定量资料用均数±标准差表示,组间比较采用两独立样本t检验;定性资料用率表示,采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基础情况比较 2组患者的年龄、不孕时间、基础内分泌、AFC、AMH及Gn时间,差异均无统计学意义(P>0.05)。微刺激方案组扳机日卵泡直径≥18 mm的有12个,≥14 mm有48个;拮抗剂方案组扳机日卵泡直径≥18 mm有17个,≥14 mm有62个。微刺激方案组的Gn启动剂量均为150 IU,拮抗剂方案组的Gn启动剂量42例为300 IU,2例150 IU。拮抗剂方案组Gn总量高于微刺激方案组,差异有统计学意义(P<0.05),见表1。
2.2 2组患者实验室结果比较 2组间体外培养成熟率、2PN率、卵裂率、可利用胚胎率及优胚率差异无统计学意义(P>0.05),见表2。
2.3 2组患者临床结局分析 微刺激方案患者中共有11例各获得1枚优质冻胚,1例获得两枚优质胚胎,其中9例解冻移植共9枚胚胎,1例宫内单胎妊娠,足月剖宫产一男婴。拮抗剂方案患者中有8例各获得1枚优质冻胚,1例获得2枚优质胚胎,6例共解冻8枚胚胎,6枚存活,6例解冻移植,1例宫内单胎妊娠,现继续妊娠中。2组患者的胚胎存活率、胚胎种植率及临床妊娠率差异均无统计学意义(P>0.05),见表3。
表1 2组患者基础情况比较 ()

表1 2组患者基础情况比较 ()
组别 年龄(岁) 不孕时间(年) bFSH(IU/L) LH(IU/L) AFC(个) AMH(ng/mL) Gn时间(d) Gn总量(IU)微刺激方案组 38.05±5.67 6.11±5.54 13.32±6.03 5.37±2.71 3.27±1.84 0.47±0.32 8.41±4.78 1 493.92±1 067.18拮抗剂方案组 38.64±6.46 5.95±5.14 11.45±4.55 4.61±2.33 3.43±1.97 0.49±0.35 9.02±2.76 2 657.39±836.95 t 0.432 0.128 1.589 1.331 0.382 0.337 0.726 5.384 P 0.667 0.898 0.116 0.187 0.704 0.737 0.470 <0.001
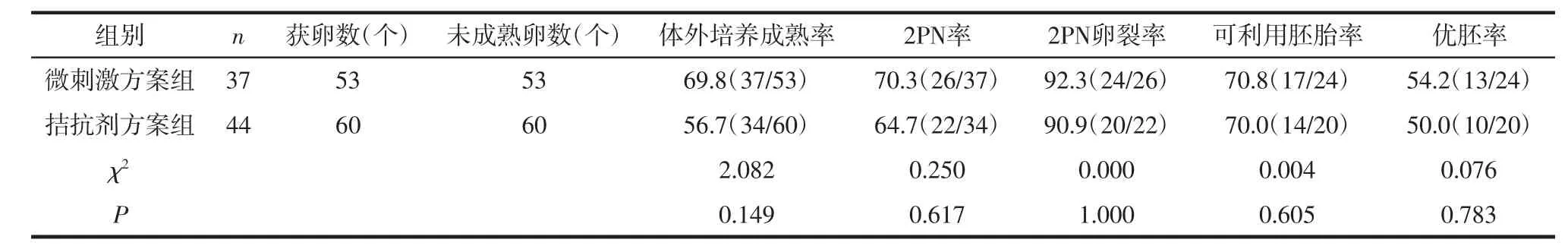
表2 微刺激方案与拮抗剂方案实验室结果比较 %(n/n)
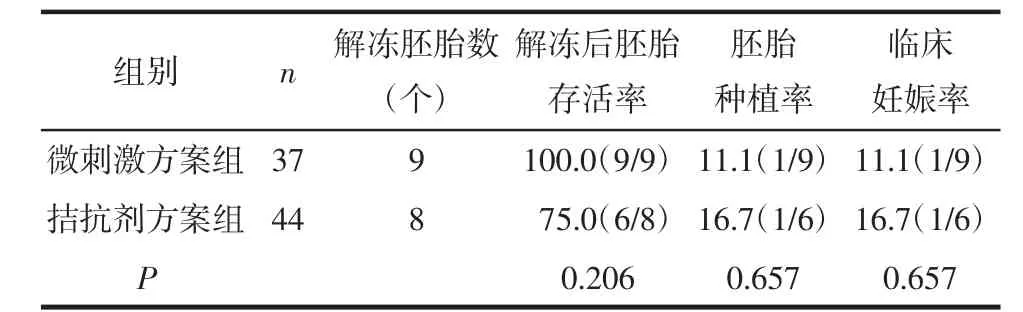
表3 微刺激方案与拮抗剂方案临床结局分析 %(n/n)
3 讨论
近年寻求辅助生殖技术的高龄患者越来越多,随着女性年龄增高,其生育能力逐年下降,卵巢内卵泡数量减少、卵母细胞质量下降及对外源性促性腺激素反应不良,是影响高龄患者生育力的关键因素。目前尚没有确切有效的方法改善这部分人群的妊娠结局。本研究着重于POR的高龄患者,当获取的卵母细胞均为未成熟卵母细胞时,联合IVM培养是否有效,且不同促排卵方案之间对卵母细胞及胚胎发育是否有差异。
3.1 ICSI联合IVM有效性分析 本研究中高龄低反应的2组患者的获卵数均≤3个,且均为未成熟卵,而行ICSI治疗中这些未成熟卵母细胞大多因无法正常受精而被废弃。有研究报道延长体外培养时间可使卵母细胞恢复减数分裂[4]。随着IVM技术的出现及逐渐成熟,其活产率从16.5%提高到23.5%[5],目前IVM助孕随访显示IVM技术不会增加妊娠风险、产科并发症及新生儿异常[6],使临床上获取的未成熟卵母细胞有了重新再利用的机会,扩大了IVM的适用范围。本研究中经IVM后微刺激方案组和拮抗剂方案组的体外成熟率分别为69.8%和56.7%,显著提高了卵母细胞的利用率,其可利用胚胎率分别为70.8%和70.0%,优胚率分别为54.2%和50.0%,同时也极大地提高了胚胎的利用率。这与Lee等[7]研究发现在卵巢储备功能降低的高龄患者通过体外授精联合IVM技术使可利用胚胎数量增加约60%的结论相符。本研究微刺激方案组最终有12例获得可移植胚胎,9例解冻移植,1例妊娠并分娩,拮抗剂方案组最终有9例获得可移植胚胎,7例解冻移植,1例妊娠。高龄患者其妊娠率及活产率急剧下降,即使使用IVF,其活产率也在10%左右[8],因此通过ICSI联合IVM技术可改善其妊娠和分娩的机会。
本研究中使用的IVM培养液为商品化的培养液,添加有75 mIU/mL FSH和75 mIU/mL LH,培养条件为37℃,6%CO2。对于IVM培养液添加外源性Gn的方案,Wu等[9]发现添加Gn促进了卵泡的发育,提高了卵母细胞的发育潜能,洪焱等[10]研究发现添加hMG可获得较添加FSH和重组hCG(艾泽)更高的卵母细胞成熟率、临床妊娠率及胚胎着床率。在GV期卵母细胞的体外培养液中加入Gn有助于卵母细胞的成熟及获得更高的优胚率[11]。不同的培养条件也会影响卵母细胞的体外成熟,有研究认为卵丘细胞共培养有利于卵母细胞体外成熟,卵丘细胞与减少活性氧物质有关,并且缺乏卵丘细胞会减少氨基酸的摄入和抗氧化剂的合成[12],同时颗粒细胞能够分泌多种生长因子,通过自分泌或旁分泌作用于卵母细胞,促使卵母细胞核质同步发育[13]。卵母细胞体外成熟后3~6 h实施ICSI,获得的优胚率更高,其原因可能与细胞质进一步成熟有关[14]。培养液中添加营养物质、生长因子、抗氧化剂等以提高卵母细胞的成熟率,改善其受精能力及胚胎发育潜能[15]。因此,通过改善体外培养环境,适当添加一些成熟促进因子等可进一步提高卵母细胞的成熟率及胚胎质量。
3.2 卵巢低反应的高龄患者用药方案分析 卵母细胞发育成熟过程涉及多个阶段,多种细胞及多种激素的相互作用,卵子质量与患者的自身情况、卵巢储备功能及促排卵方案有关,通过改变临床用药方案来提高卵子质量;在促排卵过程中添加重组LH来提高卵母细胞的成熟率[16];低剂量的hCG联合GnRHa诱导卵母细胞成熟[17];对于卵巢储备功能减退的高龄女性,在促排卵周期中添加重组人生长激素(growth hormone,GH)可提高其获卵数、MⅡ数及可利用胚胎率等[18]。
对于POR的患者,其对外源性Gn的反应较差,给予大剂量长时间的Gn应用效果不理想,给予温和的拮抗剂方案及微刺激方案不仅能改善卵巢的低反应性,减少药物用量,降低费用,而且可获得满意的胚胎数[19]。本研究2组方案的实验室结果及临床妊娠结局差异无统计学意义(P>0.05),但拮抗剂方案组Gn用量较微刺激方案组增加(P<0.05)。随着Gn用量的增加,其相应的费用也随之增加,因此微刺激方案对POR的高龄患者更加经济有效。
综上,对于POR的高龄患者,拮抗剂方案与微刺激方案获取的卵母细胞在体外培养过程中的成熟率、可利用胚胎率、优胚率及妊娠率方面差异无统计学意义,但拮抗剂方案组的Gn用量高于微刺激方案组,其费用随之增加,对于这部分患者微刺激方案更加的经济有效。同时在促排卵周期中卵母细胞未成熟率较高时,联合IVM,可增加其卵母细胞及胚胎利用率,为POR者提供了一种有效的补救措施,提高了妊娠机会。

