群体感应系统调控乳酸菌细菌素合成的研究进展
黄雨霞,武瑞赟,李平兰
(中国农业大学食品科学与营养工程学院,北京100083)
乳酸菌通常被认为是食品级微生物,其产生的细菌素、胞外多糖等代谢产物通常被认为是安全的(GRAS,一级)[1]。其中,细菌素是乳酸菌的次级代谢产物,是代谢过程中由核糖体合成的一类具有抗菌活性的蛋白质或多肽,它们具有对热稳定、对蛋白酶敏感、分子量(<1.0×104)较小等特点,经过翻译后修饰[2],具有广谱的抑菌活性,因此作为一种天然的食品防腐保鲜剂被广泛研究。对于目前报道的乳酸菌细菌素主要分为三类[3]:①Class Ⅰ细菌素。属于羊毛硫抗生素,含有羊毛硫氨基酸,A型较细长,螺旋形,带正电荷,两亲分子,比如乳酸链球菌素(Nisin);B型为球状结构,没有净电荷。②ClassⅡ细菌素。属于非羊毛硫抗生素,相对热稳定,又可分为Subclass Ⅱa和Subclass Ⅱb两种。Subclass Ⅱa对以单增李斯特氏菌为代表的革兰氏阳性菌有良好的抑菌活性;Subclass Ⅱb 一般由2条多肽链组成,它们需要2个肽协同作用才能产生抗菌活性。③Class Ⅲ细菌素。热不稳定的蛋白质。
Nisin是唯一被粮食和农业组织/世界卫生组织(FAO/WHO)认定为安全并批准用于食品中的细菌素[4]。乳酸菌细菌素合成量低是限制其应用的主要原因,已有的研究表明,乳酸菌细菌素的合成受群体感应的调控,且三组分系统发挥了核心的作用。乳酸菌细菌素对保障食品质量安全和人体健康具有重要意义,揭示其群体感应的合成调控机制有助于实现细菌素的大量生产。因此,本文中,笔者总结群体感应系统及其调控乳酸菌细菌素合成的三组分系统的研究进展,以期为研究者提供参考。
1 群体感应
在乳酸菌细菌素合成过程中,群体感应(QS)系统发挥了关键的调控作用,通常认为QS是一种细胞间通信过程(cell-to-cell communication),使细菌能够共同改变行为以响应细胞密度和物种的变化,首次发现于海洋生物Photobacteriumscheri在高细菌密度下可以产生的发光现象[5]。群体感应涉及细胞外信号分子的产生、释放和范围检测,这种信号分子被称为群体感应信号分子(quorum sensing molecular,QSM)或自诱导物(autoinducer,AI)。随着细菌种群密度的增加,信号分子在环境中不断积累,细菌监测信号分子浓度变化,以感知细胞数量的变化,并共同调控基因表达[6]。QS在调节细菌活力、抗生素生物合成、生物膜形成、质粒接合以及其他毒力因子的产生方面起到重要作用[7]。根据信号分子和受体蛋白不同将群体感应分为4类[8-9]:①N-酰基高丝氨酸内酯类(AHL)介导的 LuxI/R群体感应系统;②寡肽类(autoinducing peptide,AIP)介导的群体感应系统;③AI-2介导的LuxS /AI-2 群体感应系统;④AI-3 和假单胞菌喹诺酮信号(Pseudomonasquinolone signal,PQS)介导的群体感应系统。调控乳酸菌细菌素合成的群体感应主要属于第②类和第③类,且三组分系统在其中发挥重要作用。
早在1999年研究就发现,调控乳酸菌细菌素合成的是由三组分群体感应系统调控的。之后Maldonado等[10]研究证明,三组分系统是调控乳酸菌细菌素合成的主要群体感应调控系统,很多对乳酸菌细菌素合成的研究都基于三组分系统。三组分系统通常由一个双组分系统(two component system,TCS)和一个信号分子组成,其中TCS由位于膜上的组氨酸蛋白激酶(histidine protein kinase,HPK)和调节特定基因表达的反应调节蛋白(response regulator protein,RR)组成[11],其调控机制在Class Ⅰ和Class Ⅱ类乳酸菌细菌素具有相似性和特异性,揭示三组分系统对其合成的调控机制对于乳酸菌细菌素的研究应用具有重要的意义。
2 三组分系统对乳酸菌细菌素的合成调控
2.1 三组分调控系统的组成
2.1.1 信号分子
构成三组分系统的信号分子为寡肽类,也被称为自动诱导肽(AIP),其在中性条件下以阳离子形式存在,净电荷为3~6,长度为19~26个氨基酸残基,其中疏水残基含量较高。自诱导肽信号的合成发生在细胞核糖体中,并通过进一步修饰加工,以达到成熟形式[12]。Maldonado-Barragán等[13]通过研究LactobacillusplantarumNC8证实其自诱导分子具有高特异性,这与Brurberg等[14]的研究具有相同的结果,表明微生物产生的AIP在任何菌株中都不能互换。Syvitski等[15]设计并合成了一系列截短的以及氨基酸取代的信号肽,用圆二色谱和核磁共振技术分析比较了变异链球菌(S.mutans)信号肽的结构与其诱导活性之间的关系。但到目前为止,信号肽的结构与功能的关系还不是很明确。
2.1.2 双组分系统
TCS是调控细菌素合成的典型的信号转导途径,通常由与膜结合的传感器HPK和细胞质反应调节蛋白RR组成,2种蛋白质均呈现模块化结构。HPK是具有跨膜螺旋的跨膜整合膜蛋白,通常由感觉结构域、组氨酸-磷酸转移(DHP)结构域(含有可磷酸化的His残基)和ATPase(CA)结构域(ATP结合位点并催化DHP结构域的磷酸化)组成。RR由保持保守的天冬氨酸残基的受体域(CRC)和通常是DNA结合域的效应域组成。反应调节蛋白中磷酸基的水解使系统对外界刺激做出反应。水解过程可以通过RR 的自磷酸酶或HPK的磷酸酶介导,也可以通过天冬氨酸磷酸酶介导[16]。通过该过程,磷酸基团转移至响应调节剂的天冬氨酸,最后作为无机磷酸盐释放。磷酸化的反应调节剂与启动子结合,激活细菌素基因和三组分系统基因的表达。
Zuniga等[17]首先依据19个乳酸菌的基因组序列研究了乳酸菌的TCS的种类和数量。Monedero等[18]在此基础上,用MBGD中98个完整的基因组序列以进行比较分析,将HPK分为ⅢA、HPK10、Ⅱ、Ⅵ、和CheA/HPK9这5类,RR分为OmpK、LytR、Narl、CitB、YcbB、AraC、CheY和CheB这8类。在乳酸菌TCS里HPK中的ⅢA和RR中的OmpK含量最丰富(在TCS中占71.45%)。
2.2 三组分调控系统调控细菌素合成的机制
2.2.1 ClassⅠ类乳酸菌细菌素的合成调控
ClassⅠ类乳酸菌细菌素的典型代表是Nisin,Nisin是一种由乳酸乳球菌乳酸亚种(Lactococcuslactissubsp.lactis)合成的细菌素。调控Nisin合成的群体感应系统是非典型的三组分调控系统,被称为NICE(Nisin controlled expression)系统。Kleerebezem等[19]综述了产生乳链菌肽的菌株携带的基因,含有乳链菌肽(nisA)结构基因,TCS(nisK-R)和其他参与乳链菌肽修饰,输出和免疫的基因的基因簇。在三组分调控系统中,Nisin本身作为寡肽类信号分子,激活包括nisA在内的整个nis簇的诱导,主要有参与蛋白质修饰的nisB和nisC;与ABC转运蛋白相关的nisT;用于去除前导肽的胞外蛋白酶的nisP;与跨膜信号转导相关的nisK;响应监管相关的nisR;与免疫相关的nisE、nisF、nisG和nisI(图1)[20]。TCS中的 RR属于OmpR族,HPK属于ⅢA族[18]。
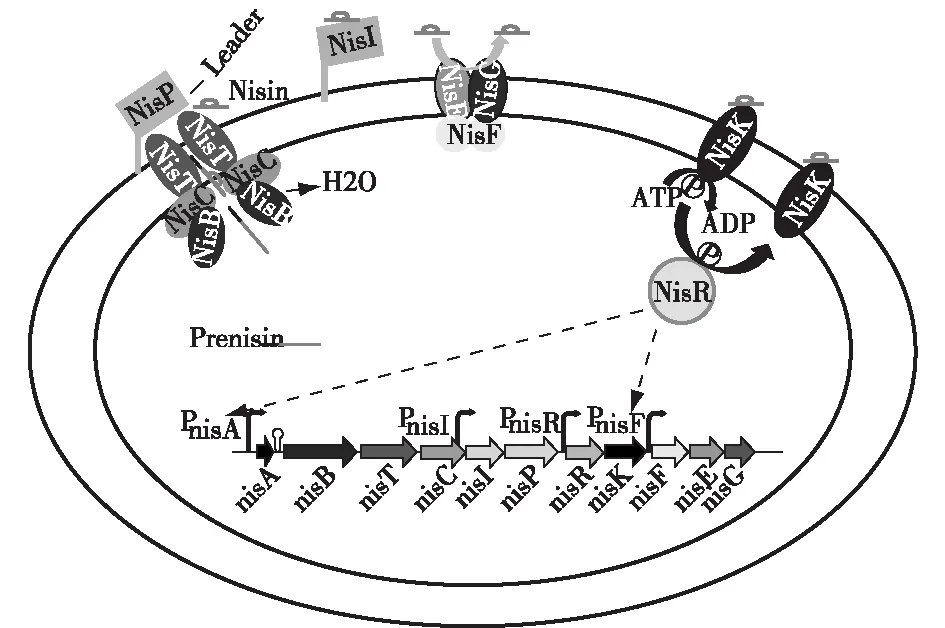
图1 Ⅰ类细菌素合成的群体感应调控系统[20] Fig.1 Quorum sensing system regulating the synthesis of classⅠbacteriocin[20]
2.2.2 ClassⅡ类乳酸菌细菌素的合成调控
调控Ⅰ类和Ⅱ类乳酸菌细菌素合成的三组分调控系统有相似性但也有特异性,其相同之处在于三组分系统的组成都是由自诱导肽、组氨酸激酶和反应调节蛋白组成,但3种组成成分具有明显的差异。在Ⅰ类乳酸菌细菌素的三组分系统中,自诱导肽是抗菌肽本身,而Ⅱ类细菌素的自诱导肽是由特定基因簇编码的,且不同的菌株的编码基因簇不同。最典型的基因簇为plnABCD,plnA编码自诱导肽AIP,plnB编码组氨酸激酶,plnC和plnD编码2种反应调节剂,张香美等[21]制备类植物乳杆菌L-XM1不产细菌素表型,用人工合成的PlnA诱导其产生了细菌素,确定PlnA在类植物乳杆菌L-XM1细菌素合成中的作用,之后又通过克隆并插入plnB基因,发现plnB敲除突变体ΔplnB21丧失了产细菌素的能力,即使在加入PlnA后,其产细菌素型也不能恢复[22]。存在类似pln基因簇的L.plantarum菌株包括C11、WCFS1、J51、NC8、J23、 I-UL4、V90。L.plantarumC11中的调节操纵子是典型的plnABCD基因簇编码的三组分系统[23]。L.plantarumWCFS1 的基因组序列显示,它的pln基因簇的结构和序列与 C11 菌株一致,所以与 C11 具有相同的群体感应调节机制[24]。L.plantarumJ51与C11的操纵子存在差异,但编码三组分系统操纵子都为plnABCD[25]。与C11中的pln调节操纵子不同,L.plantarumNC8调节操纵子仅包含3个基因:编码自诱导肽的plnNC8IF,HPK的plnNC8HK和RR的plnD,其中NC8-plnD与C11-plnD具有高度的相似性[26]。L.plantarumJ23 与NC8具有相同的调控三组分的基因操纵子[27]。而L.plantarumI-UL4中的三组分基因操纵子与以上2种情况不同,其操纵子为plnUL4IF-plnUL4HK-plnD,但其与NC8和J23相似的结构,调控方式也基本相同[28]。除此之外,有研究发现L.plantarumV90具有组合性生产的特点[29]。由此可见,调控乳酸菌细菌素合成的三组分系统基因具有多样性的特点。
与控制乳球菌中Nisin产生的TCS相比,调节Ⅱ类细菌素产生的TCS具有不同的特征。首先,TCS的RR属于LytTR家族,Nikolskaya等[30]借助分子生物学技术研究了LytTR携带的N端保守的DNA结合域与其他RR携带的经典螺旋-转角-螺结构不同。其次,它的同源HPK属于HPK10系列传感器激酶[16]。与其他HPK相比,HPK10族具有不同的特征,Johnsborg等[31]研究证明HPK10在N端传感器域中存在5~8个预测的跨膜螺旋,是肽类激素的受体。这与位于胞浆外环两侧的2个典型跨膜螺旋不同。
图3为Ⅱ类细菌素合成的群体感应调控系统的示意图。
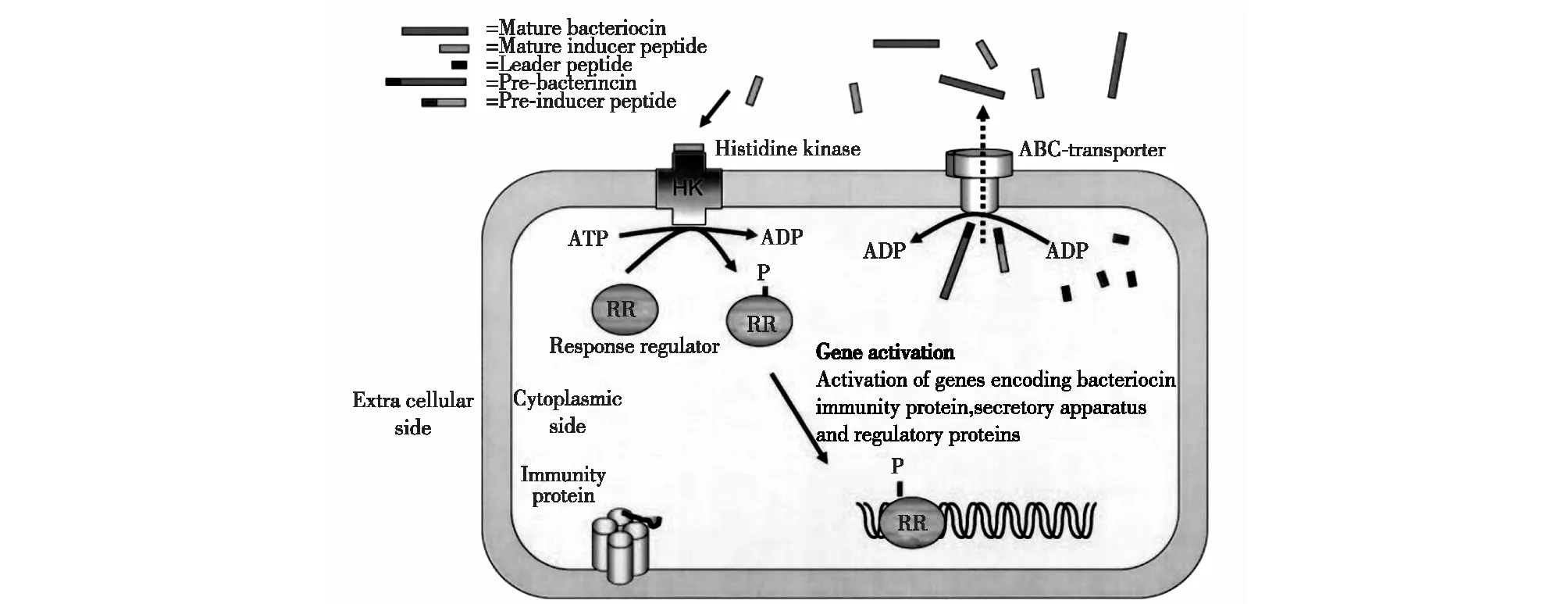
图2 Ⅱ类细菌素合成的群体感应调控系统[32] Fig.2 Quorum sensing system regulating the synthesis of classⅡ bacteriocin[32]
3 其他介导群体感应调控的因素
在乳酸菌细菌素的群体感应调控系统中,三组分调控系统发挥了核心作用,但还存在其他影响细菌素合成的因素,比如细菌密度和共培养的影响。关于细菌素合成的研究表明,一些产生细菌素的乳酸菌(Bac+)在以非常低的细胞密度接种时可以变成非产生菌株(Bac-),在以高细胞密度接种时,向生长培养基中添加Bac+变异体(含诱导肽)或含纯化诱导剂肽的上清液或与特定细菌共培养时,而这些菌株又可以恢复细菌素生产能力[33-34]。但Bac+表型的恢复只能在固体培养基上实现,比如L.plantarumWCFS1突变株只有添加植物乳杆菌素A(PlnA)后通过将培养物涂布在固体培养基上才能恢复产细菌素能力[35]。据推测,在固体表面上的生长类似于细菌的自然生长,细菌在自然环境中通常在表面上形成生物被膜,这些生理条件可能影响与细菌素诱导相关的基因的表达。
有研究表明,乳酸菌细菌素的产生可通过共培养诱导或增强,相关菌株包括Lactobacillussalivarius、Lactobacillusacidophilus、Enterococcusfaecium和L.plantarum等[36-38]。以L.plantarumNC8为例,特定的革兰氏阳性细菌的存在可以作为环境刺激因子,共培养时能够激活PLNC8生产并增强PLNC8-自诱导活性,从而在没有诱导细胞的情况下触发细菌素的生产[39]。从这个意义上讲,调节细菌素合成的QS系统能够以某种方式感知产生诱导肽的细菌的数量。Autoinducer-2(AI-2)在许多情况下与共培养诱导产生细菌素有关[40]。 AI-2是通过luxS基因产物的催化作用合成的S-核糖基同型半胱氨酸的分解代谢的副产物[41],已被证明是介导Bac+菌株共培养中细菌素产生的诱导信号分子。Jia等[42]提出AI-2作为L.plantarumKLDS1.0391中细菌素产量增加的间接触发因素,其产生依赖于plNC8HK-plnD基因。当L.plantarumKLDS1.0391与细菌素产生菌L.helveticusKLDS1.0207共培养时,可观察到plnNC8HK和plnD基因的显著上调,这种基因表达的上调导致细菌素活性增加,且与AI-2活性正相关。Di Cagno等[43]研究表明,在与LactobacillusrossiaeA7共培养条件下,L.plantarumDC400中luxS基因表达显著升高,上清液中AI-2诱导物的活性增强。尽管如此,AI-2与细菌素生产之间的直接联系尚不明确。
4 展望
目前乳酸菌细菌素的群体感应的研究主要集中在基因和结构方面,从当前的研究结果看,三组分调控系统在介导乳酸菌细菌素合成方面发挥着重要的作用,然而三组分的结构和功能的相关性以及不同类型的菌株调控基因的差异性还有待进一步的研究。同时,还有很多尚未识别的环境因素在调节信号分子的产生或细胞对信号分子的敏感性方面发挥作用,AI-2在细菌素合成调控过程中的信号输出、接收或转导途径等具体作用机制有待阐明。调控乳酸菌细菌素合成基因具有多样性,还有很多复杂的环境因素在其中发挥作用,因此目前没有找到通用的调控系统。加强基因多样性、环境因素以及共培养机制的研究对提高细菌素产量具有重要意义。

