沙门氏菌群体感应系统研究进展
戴 鹏,杨 溢,赵亚荣,羊 扬,刘彦红,鲍恩东, 李亚杰,丁旭娜,朱国强
(1.扬州大学兽医学院,江苏扬州225009;2.江苏省动物重要疫病与人兽共患病 防控协同创新中心,江苏扬州225009;3.天津瑞普生物技术股份有限公司,天津300300)
1970年,Nealson等[1]首次发现费氏弧菌的生物发光现象与细菌密度有关。1994年,Fuqua等[2]提出“群体感应”概念,即细菌产生群体感应(quorum sensing,QS)信号分子并释放至胞外环境,当环境中信号分子浓度达到一定阈值,就能与信号分子的受体蛋白结合,激活靶基因表达,以调控菌体的群体行为(如运动性、生物发光、生物被膜以及胞外多糖形成等)[3]。
QS系统广泛存在于各种微生物群体之中,革兰氏阳性菌和革兰氏阴性菌均能利用群体感应系统调控相关基因表达。其中,革兰氏阳性菌通常利用分泌的寡肽以及双组分系统(two-component system,TCS)介导群体感应功能。相比之下,包含沙门氏菌在内的革兰氏阴性菌QS系统则含有以下4个共同特征:①自体诱导物是N-酰基高丝氨酸内脂(acy-homoserine lactones,AHLs)或是由S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)合成的其他分子;②自体诱导物会与位于细胞膜或细胞质中的特异性受体结合;③QS通常会修饰编码多种生物进程的数十至数百个基因;④QS的激活会刺激自体诱导物的增加,建立一种能促进细菌种群同步基因表达的前馈回路[4]。
根据QS信号分子的差异,目前将沙门氏菌QS系统分为3类,即AHL介导的Ⅰ型QS系统、AI-2介导的Ⅱ型QS系统和AI-3/肾上腺素(epinephrine,Epi)/去甲肾上腺素(norepinephrine,NE)介导的Ⅲ型QS系统。本文中,笔者重点对沙门氏菌三类QS系统及其功能的研究进展进行阐述。
1 AHL介导的Ⅰ型QS系统
1.1 AHL的合成及特性
AHL介导的Ⅰ型QS系统最初发现于费氏弧菌中。LuxI和LuxR调控费氏弧菌的萤光素酶操纵子,其中LuxI合成AHLs,即自体诱导物-1(AI-1)。AHLs在合成后经自由扩散穿过细胞膜进入胞外环境。随着细菌群体数量的增加,环境中AHLs的浓度也随之升高。在达到特定的阈值浓度时,AHLs扩散回细胞内并与其特异性受体蛋白LuxR结合,从而激活荧光素酶操纵子的转录。
在所有LuxI-R型QS系统中,细菌合成AHLs,然后与LuxR蛋白结合以调控涉及多种表型的不同基因转录。LuxI及其同系物通过将酰基载体蛋白(ACP)的脂肪酸链转移至SAM,释放AHLs和甲硫腺苷。AHLs由含有脂肪酸侧链的高丝氨酸内酯环组成,不同细菌会产生相异的自体诱导物分子,因此在不同种属的细菌中能发现AHLs的差异。例如,AHLs酰基链上可以连接4~18个碳原子,并且酰基链的饱和度也能改变。但是这些AHLs的作用方式基本相似,能够实现多种生理功能(如形成生物被膜和表达毒力基因等)[5]。
1.2 沙门氏菌合成SdiA参与Ⅰ型QS系统
沙门氏菌通过感应AHLs以进行种间通讯。由于缺少LuxI同源基因,沙门氏菌不能合成AHLs。但沙门氏菌能编码SdiA(suppressor of cell division inhibition A)受体蛋白从而识别并结合其他细菌产生的AHLs[6]。SdiA具有2个功能结合域——氨基端的AHL分子结合域以及羧基端的DNA分子结合域(具有螺旋-转角-螺旋模体),并且SdiA在与DNA分子互作前需要结合AHLs以正确折叠,从而稳定自身结构。Campos-Galvão等[7]证实沙门氏菌中SdiA序列非常保守。
沙门氏菌的SdiA结合其他细菌产生的AHLs时会激活2个srg基因座——rck(resistance to complement killing)操纵子基因座和srgE(sdiA-regulated gene E)基因座(图1)。沙门氏菌能编码SdiA受体蛋白从而识别并结合其他细菌产生的AHLs。SdiA结合其他细菌产生的AHLs时会激活rck操纵子基因座和srgE基因座。rck操纵子参与沙门氏菌Pef(plasmid-encoded fimbriae)菌毛的生物合成,还具有侵袭宿主细胞并抵御补体杀伤的功能。值得一提的是,由于肠炎沙门氏菌和鼠伤寒沙门氏菌中rck操纵子上游5’端核酸序列不同,SdiA调控这两种沙门氏菌rck操纵子的表达水平也不相同[8-9]。srgE编码沙门氏菌Ⅲ型分泌系统(T3SS)效应子并通过T3SS2输入至宿主细胞[10]。然而,SrgE的生物学功能仍需进一步研究。
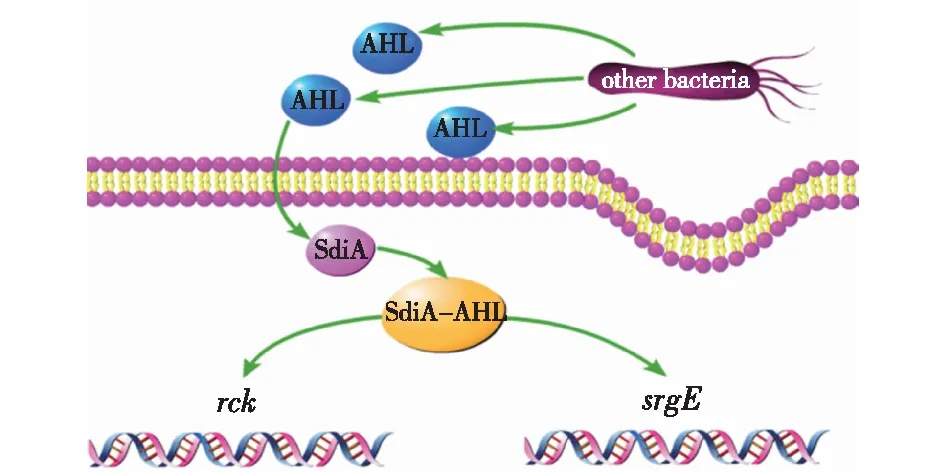
图1 沙门氏菌AHL介导的Ⅰ型QS系统 Fig.1 AHL-mediated type Ⅰ quorum sensing system in Salmonella
1.3 沙门氏菌Ⅰ型QS系统的功能探索
由于沙门氏菌无法直接合成AHLs,所以其Ⅰ型QS系统的主要功能是窃听环境中能产生AHLs的其他细菌,从而使自身在竞争性环境中占得优势。例如,Smith等[11]和Sperandio等[12]分别在感染嗜水气单胞菌的龟以及感染小肠结肠炎耶尔森氏菌(这两种细菌均能合成AHLs)的小鼠肠道中检出鼠伤寒沙门氏菌的SdiA受体蛋白被激活。值得注意的是,虽然牛胃肠道中含有AHLS,并且笔者所在实验室成员羊杨[13]已从牛瘤胃中分离出能产生AHLs的菌株,其他健康哺乳动物的消化道内均未检出AHLs,但是沙门氏菌的SdiA在牛消化道环境中并未被激活,可能是牛的日龄及饮食影响消化道固有菌群合成AHLs或其他未知的原因。因此,SdiA在沙门氏菌定植牛消化道过程中的功能并未明确[11],此外,也有研究显示沙门氏菌的SdiA可能窃取大肠杆菌的信号分子(吲哚)从而增强其自身的耐药性[14],因此,沙门氏菌中SdiA蛋白的功能尚需进一步探索。根据Doulgeraki等[15]的报道,沙门氏菌在不同的生长条件(如培养温度以及培养基的化学组成)下,sdiA的表达会发生变化,但是表达的变化如何影响沙门氏菌也仍待进一步研究。
近年来也出现了诸多关于AHLs影响沙门氏菌表型的报道。Dourou等[16]发现一些细菌(如铜绿假单胞菌、小肠结肠炎耶尔森氏菌等)合成的AHLs可能会影响肠炎沙门氏菌的生长特性。Liu等[17]证实AHLs能增加沙门氏菌(携带pRST98质粒)中rck操纵子的表达量,从而增强细菌的黏附力、对血清抗体的抵抗力以及生物被膜形成的能力。Campos-Galvão等[18]证明AHLs通过调控糖原合成基因(glgC)、菌毛基因(fliF、lpfA和fimF)和SPI-1基因(hilA、invA和invF)来刺激鼠伤寒沙门氏菌生物被膜的形成。Almeida等[19]通过模拟肠道环境发现,外源性AHL(C12-HSL)能在厌氧环境中诱导肠炎沙门氏菌在聚苯乙烯上形成生物被膜,并且Ⅰ型QS系统对生物被膜的成熟阶段产生影响。上述结果表明,当环境中存在其他细菌合成的AHLs时,沙门氏菌能形成生物被膜作为应答,这使得沙门氏菌能在一些竞争性环境(如宿主肠道)中占得优势。但是宿主肠道环境较为复杂,并且细菌的生长、生物被膜形成等表型也受一些非生物因素(如温度)的影响,此外,SdiA受体蛋白在这些表型变化中是否发挥作用?因此,Ⅰ型QS系统对沙门氏菌致病性相关的功能(包括诱导生物被膜形成、增强黏附力)仍需进一步挖掘。
2 LuxS/AI-2介导的Ⅱ型QS系统
2.1 AI-2的合成及特性
AI-2介导的Ⅱ型QS系统广泛存在于各类细菌中,细菌通过该QS系统感应内源性和外源性AI-2信号分子,由此介导细菌种间通讯。LuxS是一种小分子金属酶,其催化细菌活化甲基循环中的最后步骤。在此循环中,SAM作为甲基供体生成中间产物S-腺苷高半胱氨酸(SAH),SAH在S-腺苷高半胱氨酸核苷酸酶(Pfs)的催化下产生S-核糖高半胱氨酸(SRH),SRH再经LuxS蛋白催化,转化为4,5-二羟基-2,3-戊二酮(DPD)。DPD是一种极不稳定的化合物,它能与水反应并环化形成数种呋喃酮类衍生物,其中之一就是AI-2的前体。AI-2是一种呋喃酮酰硼酸盐二酯——(2S,4S)-2-甲基-2,4-羟基四氢呋喃酮-硼酸盐(S-THMF)。沙门氏菌AI-2及其受体蛋白LsrB的共结晶结构表明沙门氏菌能识别AI-2-(R-THMF)。AI-2的分泌量取决于细菌的生长条件,如营养物质、pH、渗透压、生长速率和应激因素等[20]。
2.2 AI-2介导的信号传导
沙门氏菌能利用LuxS调控(LuxS-regulated,lsr)系统从环境中摄取AI-2分子,从而使环境中的其他细菌无法感应该信号分子[21]。在鼠伤寒沙门氏菌中,lsr操纵子含有编码运输和调控AI-2的基因,并且AI-2的存在会诱导该操纵子的表达。lsr操纵子由7个基因(lsrACDBFGE)组成。lsrA、lsrC、lsrD和lsrB基因分别编码涉及转运系统的蛋白(其中lsrA编码胞质内蛋白;lsrC和lsrD编码,2个跨膜蛋白;lsrB编码膜受体蛋白)。LsrG和LsrF能调控细胞中AI-2磷酸化的水平,从而控制lsr的表达[22]。由于lsrE的缺失不影响AI-2的转运以及lsr的表达,因此LsrE的功能仍需进一步探索。lsrR和lsrK分别编码阻遏蛋白LsrR和激酶LsrK,这2个基因位于lsr操纵子的上游并对lsr操纵子起调控作用[23]。
在AI-2缺失的情况下,阻遏蛋白LsrR会抑制lsr操纵子的转录。随着细胞外AI-2浓度的增加,AI-2与LsrB结合,随后通过LsrABC转运系统输入细胞内部。AI-2一旦进入细胞内,LsrK就会使其磷酸化,磷酸化的AI-2(P-AI-2)能直接与LsrR相互作用并减弱其对lsr操纵子的抑制。LsrG和LsrF能降解P-AI-2并因此恢复LsrR对lsr操纵子的抑制(图2)。在还原条件下,LsrG能将P-AI-2转化为互为同分异构体的3,4,4-三羟基-2-戊酮-5-磷酸(P-TPO)和3-羟基-2,4-戊二酮-5-磷酸(P-HPD)[24]。LsrF的结晶结构分析表明其与Ⅰ型醛缩酶的结构相似,并且其可与DPD类似物(如5-磷酸核糖和5-磷酸核酮糖)形成复合物。近期研究表明,虽然LsrF和醛缩酶结构相似,但是LsrF的作用并非是裂解P-AI-2,而是将P-HPD中的酰基转移至辅酶A(CoASH),从而生成磷酸二羟丙酮(DHAP)和乙酰辅酶A,它们分别是糖酵解途径和柠檬酸循环的中间产物[22]。但是沙门氏菌在应答AI-2时,DHAP和乙酰辅酶A浓度以及代谢通量如何变化仍需进一步研究。
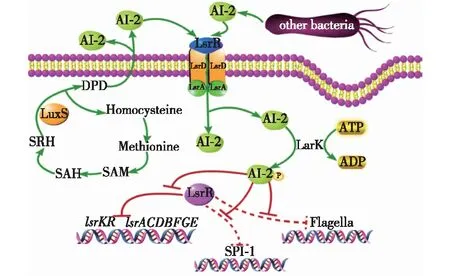
图2 沙门氏菌AI-2介导的信号传导系统 Fig.2 AI-2-mediated signaling system in Salmonella
沙门氏菌及多种其他细菌均能合成AI-2分子并释放至环境中。在AI-2合成过程中,SAM为甲基供体产生SAH,其转化为SRH(S-核糖高半胱氨酸)后,再经LuxS蛋白催化,生成DPD,其能形成AI-2的前体。SRH可进入下一轮循环,依次转化为高胱氨酸(homocysteine)和蛋氨酸(methionine)后形成SAM。环境中的AI-2分子进入沙门氏菌细胞后,LsrK就会使其磷酸化,磷酸化的AI-2分子能结合LsrR从而使其失活,由此激活lsr操纵子、鞭毛及SPI-1上相关基因的表达,发挥潜在的致病功能。
2.3 沙门氏菌Ⅱ型QS系统的功能探索
学者研究AI-2介导的Ⅱ型QS系统功能时,往往通过构建luxS基因的缺失株以进行表型分析。细菌的很多表型归因于AI-2信号传导,如调控细菌毒力以及窃听并破坏其他细菌的通讯[25]。然而,AI-2在沙门氏菌信号传导中的确切作用存在争议。Choi等[26]发现鼠伤寒沙门氏菌luxS基因的缺失会降低SPI-1中一些基因的转录水平,同时会减弱细菌侵袭上皮细胞的能力,与野生株相比,鼠伤寒沙门氏菌luxS基因的缺失株在小鼠体内显示出毒力下降。但是,Perrett等[27]重复上述实验时却得出完全相反的结果。对此可能的解释为luxS基因缺失株具有多重效应或LuxS除群体感应之外还具有其他功能[28]。Gart等[29]关于鼠伤寒沙门氏菌QS系统的研究表明,在不含AI-2分子的情况下,阻遏蛋白LsrR会降低SPI-1和鞭毛运动性相关基因的表达水平,从而使沙门氏菌对上皮细胞的侵袭能力减弱,而P-AI-2分子能结合LsrR从而使其失活。因此,沙门氏菌Ⅱ型QS系统具有介导鞭毛基因(fliC和fliD)和SPI-1相关毒力因子(invF、sicA、sopB和sopE)表达的功能(图2)。
虽然在许多其他细菌(如放线杆菌、肺炎克雷伯氏菌等)中,luxS基因的缺失会使得生物被膜形成的能力下降,但是Ju等[30]证实都柏林沙门氏菌luxS基因缺失株的疏水性以及生物被膜的形成能力比野生株强。这种相异的结果表明,沙门氏菌中AI-2的产生并不与生物被膜的形成直接相关,而是luxS基因调控与生物被膜形成相关的基因表达水平,从而改变生物被膜形成的表型。因此,LuxS/AI-2介导的Ⅱ型QS系统在沙门氏菌生物被膜形成过程中所发挥的功能仍需进一步探索。
Cappuyns等[31]同时发现AI-2在沙门氏菌中的作用还与代谢相关,因为lsr操纵子与其他糖转运蛋白功能和序列具有相似性。AI-2与其他碳源的合成及输入相类似,均受到严格控制。鼠伤寒沙门氏菌中,AI-2的合成量取决于培养基中碳水化合物的量以及细菌所处的生长阶段。对数生长期的细菌产生并分泌AI-2,而处于稳定期的细菌不再产生AI-2[31]。
3 AI-3/Epi/NE介导的Ⅲ型QS系统
3.1 AI-3/Epi/NE的合成及特性
沙门氏菌能利用真核细胞和原核细胞之间出现的跨界信号以收集环境信息并调控基因表达。跨界信号传导网络涉及AI-3、Epi和NE信号分子。Epi/NE属于儿茶酚胺,主要来源于中枢神经系统、肠神经系统和肾上腺髓质中的肾上腺能神经元。免疫细胞(T细胞、巨噬细胞和嗜中性粒细胞)也能合成并分泌Epi/NE,这是胃肠道中Epi/NE的另一来源[32]。AI-3由胃肠道菌群产生,其与宿主应激激素Epi和NE存在交叉通迅交流。尽管AI-3不直接依赖于luxS的合成,但是luxS突变对AI-3的产生有一定影响。luxS基因的突变通过改变细胞代谢从而影响AI-3的合成。具体来说,luxS的突变使得细菌利用草酰乙酸(而非SAM)合成甲硫氨酸。该通路可能会改变细胞的代谢以及氨基酸的浓度从而引起酪氨酸(儿茶酚胺前体)水平下降,继而导致AI-3浓度降低[33]。
AI-3与AI-2在化学性质上差异显著。AI-2是一种极性呋喃酮,不能结合C18柱,而AI-3则能结合C18柱并只能用甲醇洗脱。尽管AI-3结构尚未明确,但是它可能与Epi/NE相似,因为AI-3的调控作用能被肾上腺素受体拮抗剂阻断[34]。
3.2 沙门氏菌Ⅲ型QS中的TCS
哺乳动物细胞能通过肾上腺素能受体(G蛋白偶联受体,GPCR)识别Epi/NE。相比之下,细菌细胞虽然不编码GPCR,但是具有能够感应这些激素的膜结合的组氨酸传感器激酶(HK)。HK是TCS的组分之一,沙门氏菌可通过TCS感应Ⅲ型QS信号分子。TCS由HK和反应调控因子(RR)组成。HK位于细菌细胞质膜上,在感应到特定的环境信号后会发生自身磷酸化,然后将磷酸基团转移到其同源RR上的天冬氨酸残基上。RR是一种转录因子,通过结合DNA以促进或抑制基因表达从而介导信号传导级联的输出[35]。
QseBC(quorumsensing protein B and C)TCS最先发现于变形菌门(Proteobacteria)中。膜结合蛋白QseC是与AI-3直接互作的HK,也能结合Epi和NE,因此是一种细菌肾上腺素能受体,其作用也能被α-肾上腺素能受体拮抗剂阻断。QseC有2个跨膜结构域,分别为HK结构域和ATP酶结构域。QseC在感应到AI-3、Epi和NE信号分子后启动自身磷酸化,然后将磷酸基团转移至其同源RR QseB。沙门氏菌中还具有第2种QS TCS,即QseEF(QseE是HK,QseF为RR)。QseE不能感应AI-3,但能感应Epi/NE以及硫酸盐、磷酸盐[36]。值得注意的是,Moreira等[37]发现QseC和QseE这2个肾上腺素能受体通过互作,在体内和体外均能调控鼠伤寒沙门氏菌的毒力,表明沙门氏菌QseBC和QseEF双组分系统间存在交叉通讯交流(图3)。
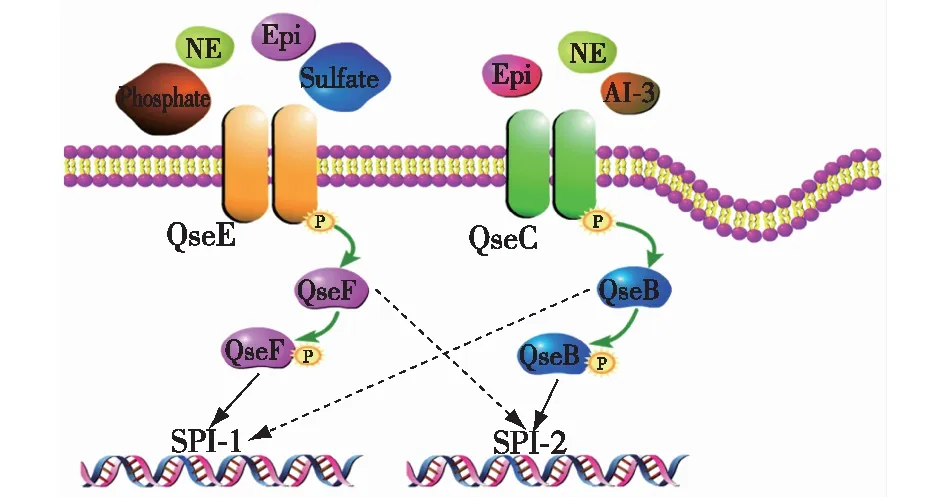
图3 沙门氏菌Ⅲ型群体感应双组分系统[37] Fig.3 Type Ⅲ quorum sensing two-component system in Salmonella[37]
沙门氏菌Ⅲ型群体感应系统通过TCSs进行信号传导。沙门氏菌组氨酸激酶QseC能感应AI-3、Epi和NE信号分子;另一个组氨酸激酶QseE不能感应AI-3,但能感应Epi/NE以及硫酸盐、磷酸盐。QseC和QseE感应到相应信号分子后启动自身磷酸化,然后各将磷酸基团转移至反应调控因子QseB和QseF。磷酸化的QseF和QseB分别能激活SPI-1和SPI-2上基因的表达从而发挥致病作用。QseBC和QseEF这2个TCSs之间还存在交叉通信交流。
3.3 沙门氏菌Ⅲ型QS系统的功能探索
学者研究沙门氏菌Ⅲ型QS系统功能时,往往通过缺失QS TCS相关基因以分析表型变化。Bearson等[38]发现鼠伤寒沙门氏菌的qseC基因缺失后,该菌在猪中定植能力下降,并且微阵列和RT-qPCR数据显示,鼠伤寒沙门氏菌在应答NE时,运动性基因以及参与鞭毛早期、中期及晚期合成的基因上调。Moreira等[39]先后证实沙门氏菌qseC基因缺失对小鼠全身性感染能力减弱以及QseC、QseE在沙门氏菌毒力基因(sipA、sopB和sifA)表达方面发挥重要作用,在后者实验中,qseE和qseC单缺失株对小鼠全身性感染能力较野生株显著减弱,而qseEC双缺失株减弱并不显著,具有中间表型,表明沙门氏菌QseBC和QseEF双组分系统间存在交叉通讯交流。在大肠杆菌中,QseBC能激活qseEF的转录,并且Epi能增强这种活化作用,显示出这2个QS双组分系统的层次关系(QseBC作用于QseEF的上游)[40]。但是上述关系在沙门氏菌中还需要进一步确证。
近年来也出现了诸多关于QseBC介导沙门氏菌生物功能的报道。Moreira等[39]证明鼠伤寒沙门氏菌的QseC能调控SPI-1和SPI-2编码的T3SSs及其效应子,表明QseC有利于鼠伤寒沙门氏菌侵袭上皮细胞以及在巨噬细胞中存活,从而发挥致病作用。Moreira等[41]发现QseC能调控鼠伤寒沙门氏菌毒力与应激相关周质蛋白(virulence and stress-related periplasmic protein,VisP)的表达并介导脂质A分子的修饰,从而增强沙门氏菌在应激条件下(如酸性pH、H2O2和CrCl3等)于含沙门氏菌囊泡(SCV)内生存的能力。Li等[42]证实QseC能调控鼠伤寒沙门氏菌运动性(flhDC)、侵袭性(sifA)以及繁殖能力(sopB)相关基因的表达,并且QseC还能介导鼠伤寒沙门氏菌感染巨噬细胞后的细胞凋亡。吉滢等[43]和Ji等[44]研究表明,QseBC双组分系统能调控伤寒沙门氏菌鞭毛基因(flhD)的表达,并且还能介导生物被膜的形成。与野生株相比,伤寒沙门氏菌的QseC缺失株QseB呈过表达、运动性减弱并且对HeLa细胞侵袭性减弱,但是生物被膜形成能力增强;而伤寒沙门氏菌的QseB缺失株生物被膜形成的能力减弱,运行性无显著变化,但是对HeLa细胞的侵袭性增强,表明QseB对伤寒沙门氏菌的生物被膜形成以及毒力具有双重调控作用。但是QseB调控沙门氏菌相关基因的机制仍需进一步研究。
目前已有学者锚定细菌群体感应系统对毒力基因的调控,通过阻断细菌信号传导途径,以抑制细菌毒力[6,45-46]。此外,利用沙门氏菌QS系统治疗癌症的研究也取得了重大进展[47]。但是群体感应信号分子抑制剂作为治疗方法的应用,必须全面详尽研究细菌的信号传导机制,以确定抑制剂是否特异性阻断信号传导,而非作用于代谢途径,因为后者可能会对细菌产生选择性压力从而诱导耐药性的形成。
4 展望
细菌能利用细胞间信号传导以应答环境的变化。沙门氏菌是重要的人畜共患病病原菌,能使用三类细胞间信号传导机制收集环境信息,由此调控基因表达。这些基因表达的变化通常涉及毒力基因调控,从而增强沙门氏菌的致病性。随着细菌耐药性的产生,常规抗生素治疗沙门氏菌病的方案受到挑战,开发针对细菌毒力基因、同时不抑制细菌生长或引起细菌死亡(由此避免耐药性产生)的抗菌药物是新的治疗策略。
同时还要注意的问题是:这些信号分子抑制剂是否会对胃肠道常驻菌群产生影响,以及是否会对哺乳动物宿主具有毒性,这将是以后研究的重点方向之一。

