群体感应抑制剂及其在食品保藏中的应用研究进展
吴 荣,顾 悦,张 悦,钟华晨,贺银凤
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
细菌在生长和繁殖过程中向周围环境分泌特定的信号分子,这种信号分子被称为自诱导物(autoinducer,AI)[1]。随着菌体密度的增加,信号分子也会进行聚集,当聚集到一定程度,就可以调控微生物群体的生理特征,这种现象称为群体感应(quorum sensing,QS)现象[2]。QS系统根据细菌所分泌信号分子的不同大致可分为4种类型:①革兰氏阴性细菌分泌的酰基高丝氨酸内酯(acyl-homoserine lactone,AHL)类分子;②革兰氏阳性细菌分泌的寡肽类分子(autoinducing peptides,AIP);③革兰氏阴性细菌和阳性细菌均可分泌的种间通用信号分子AI-2[3];④AI-3/肾上腺素/去甲肾上腺素型信号系统[4]。3种QS系统调控示意图如图1所示。
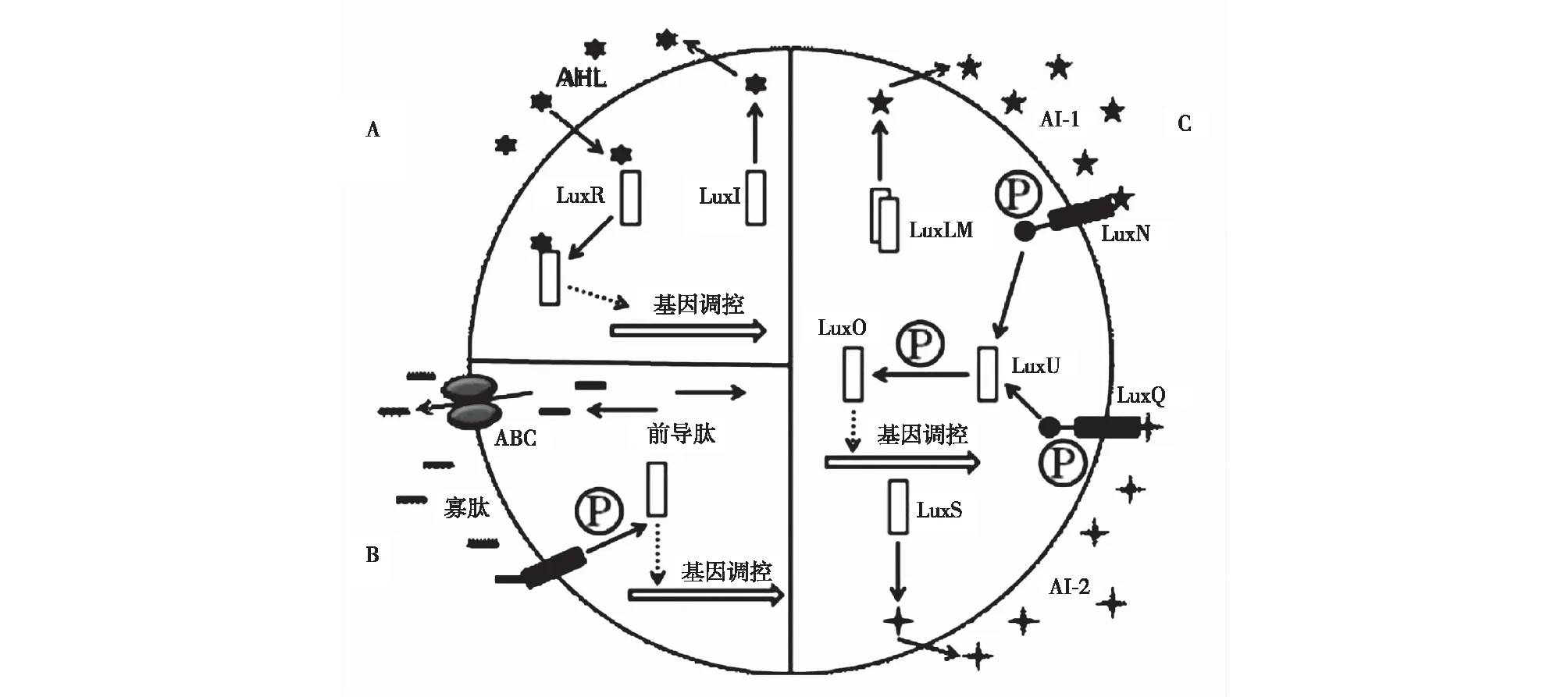
图1 3种QS系统调控示意图 Fig.1 Schematic diagram of three kinds of QS system control
QS系统介导着多种生物效应,它可使单细胞的细菌执行多细胞生物的一系列行为,因此,QS系统代表着生物体进化向前迈进了一大步[5]。同时,它能够调控细菌的多种生理生化功能[6],如:生物荧光、生物膜的形成、抗生素合成、固氮基因调控、质粒的接合转移、毒力因子的表达等。在医学上,QS系统可以调控病原菌的致病性;在食品生产流通过程中,QS系统会促进有害菌在食品或加工设备表面形成生物膜,增加其对环境的耐受性,因而更容易导致食品腐败变质。为了防止这一现象的加剧,同时有效延长食品货架期,人们开始把目光投向QS抑制剂。
1 群体感应抑制剂
QS系统与引起食物腐败变质的有害菌密切相关,在腐败食品中已经检测到许多 QS系统的信号分子[7]。细菌通过释放和交换AI以调控相关基因的表达,从而影响细菌相关生理性状的表达。不同种类的AI介导不同的QS系统,阻止AI的积累或其与受体的识别和结合,就可以干扰群体感应系统,阻止有害菌生物膜的形成,抑制其毒力因子的表达,降低有害菌侵染食品的能力,以延长食品保质期。现阶段已经发现了对细菌QS有抑制和干扰作用的物质[8],即群体感应抑制剂,用来阻止细菌之间的信息交流,同时也有越来越多的研究者开始进行群体感应抑制剂的深入研究。
1.1 群体感应抑制剂对革兰氏阴性菌的作用途径
目前对于革兰氏阴性菌的QS系统研究较多。革兰氏阴性菌在QS系统中最常见的信号分子是AHL。可以通过抑制AHL合成酶的活性,降解AHL合成酶及抑制AHL与受体蛋白结合等方式抑制AHL,从而达到阻断或抑制QS信号分子合成的目的[9]。
1.1.1 抑制AHL合成酶的活性
研究发现,姜油酮的酚醛基形成氢键和π-π键相互作用,形成稳定的复合物,其与QS受体(酪氨酸和丝氨酸等氨基酸残基)特异性结合,阻碍了信号分子与受体结合[10-11],使QS系统不再进一步被激活,达到抑制毒力因子的表达和生物膜形成的效果[12]。
1.1.2 降解AHL合成酶
降解AHL QS信号分子可以通过氧化还原酶类来实现,致使信号分子失活的方式是将信号分子中的羰基还原成为羟基[13]。Vanelslander等[14]研究发现,来自底栖硅藻透明带的天然卤过氧化物酶系统除了竞争物种之间的相互作用之外,还参与细菌QS信号分子的失活。在透明带中加入酚红和H2O2后,通过溴酚蓝的形成验证了卤代过氧化物酶的活性。Syrpas等[15]将有β-酮基部分与H2O2组合而合成的高丝氨酸内酯加入到透明带培养物中,导致这种类型的AHL失活,而不包含β-酮基部分的AHL不受影响并保留QS活性,这种现象表明失活的β-酮基AHL依赖于H2O2。所以,天然卤代过氧化物酶体系会影响β-酮基AHL的失活,且信号分子的影响效果表现为H2O2依赖性。
1.1.3 抑制AHL与受体蛋白结合
QS系统的基本过程主要包括信号分子的合成、信号分子与受体蛋白的结合及下游基因的表达等主要步骤。QS信号分子与受体蛋白结合后,活化受体蛋白,进而激活下游的转录调控因子,诱导细菌毒力及相关因子的表达[16]。在涉及假单胞菌QS机制的几种蛋白质中,LasR和PqsE在其级联信号系统中起重要作用。它们可能导致QS信号分子的增加,生物膜形成和毒力因子的产生。吡罗昔康(Piroxicam)和美洛昔康(Meloxicam)与LasR和PqsE蛋白竞争性结合,从而阻断铜绿假单胞菌与其特异性结合,进而抑制铜绿假单胞菌的生物膜的形成,因此可用作铜绿假单胞菌QS系统的抑制剂[17]。
1.2 革兰氏阳性菌的群体感应抑制剂
革兰氏阳性菌所分泌的信号分子是AIP,其前体物质在胞内合成,再经一系列的加工修饰,形成AIP。AIP需要借助ABC转运系统(ATP-binding-cassette)或在其他膜通道蛋白帮助下穿透细胞膜出入细胞。细菌生长促进AIP浓度上升,当其达到一定浓度,膜上的AIP 识别系统会对AIP进行识别并与之结合,在此基础上激活膜上的双组分磷酸激酶系统(TCS),因此,受体蛋白能与DNA特定靶位点结合,以达到调控QS特定性状表达的目的[18]。
1.2.1 AIP类似物
AIP类似物可以拮抗性地结合受体蛋白,从而抑制QS过程。在前期的研究中,阻止金黄色葡萄球菌(Staphylococcusaureus)QS系统的研究多集中在AIP配体上,目的是竞争性抑制AIP与AgrC结合[19],或者在较小程度上将AIP配体与其目标受体隔离。AgrC受体和S.aureus相关毒素生成自诱导肽AIP-Ⅲ[20]。Fowler等[21]在过去成果的基础上,合成了与其类似的化合物 AIP-Ⅲ D4A,即用酰胺键替代硫酯,以提高其在探索S.aureus中QS系统的实用性。酰胺桥联的AIP不能使任何浓度下的AgrC活化,AIP-Ⅲ酰胺的这一结果与以前对AIP-Ⅰ和AIP-Ⅱ内酰胺类的研究是一致的,两者都只是非常弱的同源受体激动剂[22]。从抑制性上看,AIP -III酰胺被发现是4种AgrC受体中最弱的抑制剂;但是它对抗AgrC-Ⅲ是最有效的[23],这些结果表明了通过AIP-Ⅲ抑制AgrC受体的硫酯连接的重要性。与AIP-Ⅲ酰胺相反,抑制剂AIP-Ⅲ D4A的酰胺桥连类似物与其母体硫酯对应物在很大程度上具有相似的抑制活性[24]。由于AIP-Ⅲ D4A酰胺在报告物测定中显示出与其母体硫代酯(AIP-Ⅲ D4A)相当的活性,Tal-Gan等[25]推测这种类似物在溶液中具有很大程度上相似的结构。因此,用酰胺键替代硫酯显著提高了AIP-Ⅲ D4A酰胺的总体水解稳定性。AIP-Ⅲ D4A相比AIP-Ⅲ更加稳定,也因此达到抑制S.aureusAgrC 受体蛋白的活性进而抑制QS系统的目的。
1.2.2 抑制剂衍生物
同期对于AIP的研究不仅局限于此,Cirioni等[26]合成了一系列新型 RNA-Ⅲ抑制肽(RNAⅢ inhibiting peptide,RIP)衍生物,对抑制QS现象起到抑制作用。首先,FS3和达托霉素在葡萄球菌血管移植物感染大鼠模型中起到预防假体生物膜的功效。体外研究表明,在FS3存在下,达托霉素的最低抑菌浓度(MIC)和最小杀菌浓度(MBC)较低。在体内研究中,当单独测试时,达托霉素和FS3均显示出很好的疗效,但是,它们的组合显示出显著高于每一种化合物的效力。达托霉素是预防葡萄球菌生物膜相关感染的重要候选物,FS3可作为有意义的抗葡萄球菌抗生素增强剂。因此,可以得出这样的结论:QS抑制剂将革兰氏阳性细菌和革兰氏阴性细菌的倾向均匀地递增至抗微生物剂,也可以通过RNA-Ⅲ抑制肽阻断葡萄球菌TRAP/agr系统(存在于革兰氏阳性细菌中)来实现生物膜的体内抑制。
同时,Cirioni等[26]还研究了FS8,将FS8作为与传统抗微生物剂联用以预防葡萄球菌生物膜相关感染的替代或附加剂[26]。S.aureus也是留置医疗器械生物膜相关感染中最常见的病原体之一[27-28]。细菌可以附着在生物材料或组织的表面,并形成由细胞包封在细胞外聚合物基质中组成的多层结构[29]。生物膜中的细菌行为受到QS现象的调节[30]。生物膜一旦形成,被膜态细胞可能比单独的浮游细胞抗微生物剂的抗性高1 000倍,使得它们特别难以消除[31]。通过干扰葡萄球菌感染的已知功能,七磷脂酰胺RNA-Ⅲ抑制肽(RIP)可以抑制S.aureus的毒力[32],并能够抑制葡萄球菌生物膜的体内形成和调节毒素的生成[33]。为了防止细菌黏附和生物膜形成,Simonetti等[34]使用了RIP衍生物FS8,它与替加环素联用可抑制小鼠创伤感染模型中S.aureus生物膜的形成,通过体外研究表明,FS8强烈影响生物膜的形成,在其存在下,替加环素显示MIC和MBC远低于在没有FS8时获得的情况。因此, 该研究初步表明:FS8具有影响生物膜形成的能力以及其作为抗生素增强剂的性质,可与常规抗微生物剂结合使用,作为预防葡萄球菌生物膜相关感染的替代或附加剂。
FS10是一种模拟自诱导结构的分子,能够干扰稳定蛋白或自诱导合成酶的稳定性[35]。FS10可以联合替加环素进行治疗,替加环素是甘氨酰环霉素类中的第一种药物,这是一种来自四环素的新型抗生素,他们的有效性不仅可以直接作用于QS系统,而且对广泛的细菌,包括葡萄球菌也具有强大的活性[36],因此可以用于S.aureus产生的QS系统的抑制剂,并且也可以用于刺激伤口愈合过程。
1.3 种间信号分子AI-2的群体感应抑制剂
作为革兰氏阴性菌和革兰氏阳性菌间通用的信号分子,AI-2在长期的研究中引起了广泛关注。马艳平等[37]对AI-2展开深入的研究,发现在很多细菌中,一些生理功能都受到AI-2介导的QS系统的调控,如抗生素的合成、毒力因子的表达、生物膜的形成、生物发光以及细菌素的合成等。
通过各项研究已经确定出AI-2的生物合成途径如下图2所示[38],且对信号分子AI-2的抑制可以从以下几个方面进行。
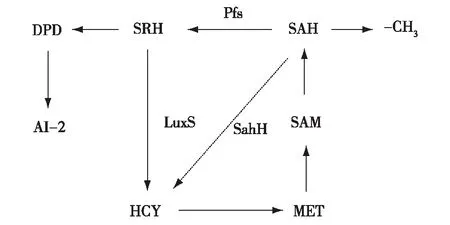
SAM为S-腺苷甲硫氨酸;SAH为S-腺苷高半胱氨酸;SRH为S-核糖高半胱氨酸;DPD为4,5-二羟基-2,3-戊二酮;AI-2为自诱导物-2;HCY为高半胱氨酸;MET为蛋氨酸(methione);Pfs为S-腺苷高半胱氨酸核苷酶;LuxS为S-核糖高半胱氨酸裂解酶;SahH为S-腺苷高半胱氨酸水解酶图2 AI-2合成图 Fig.2 AI-2 synthesis diagram
1.3.1 MTAN酶抑制剂
MTAN由基因编码并催化5′-甲硫腺苷(5′-methylthioadenosine,MTA)或SAH脱嘌呤生成5′-甲硫(基)核糖(5′-niethylthioribose,MTR)或SRH,由于已知MTAN 是将SAH水解为SRH的唯一催化酶,若抑制MTAN酶将阻断SRH的生成,继而不能生成信号分子AI-2。同时有研究发现,除了在病原微生物中发现MTAN酶的存在,在其他动物体中并未检出[39],因此,MTAN酶可以选择性地抑制病原微生物,这一研究成果体现出MTAN重大的研究意义[40]。
1.3.2 DPD(4,5-二羟基-2,3-戊二酮)类似物抑制剂
DPD类似物抑制剂在AI-2介导的QS系统中起着关键作用。研究者们发现DPD的类似物对QS系统有抑制作用。Roy等[41]合成了可以针对多种QS系统起作用的DPD类似物,胞内的DPD类似物被LsrK磷酸化因而与磷酸化的AI-2竞争,使AI-2不能与LsrR蛋白结合,继而影响相关基因的表达,抑制QS现象。Lowery等[42]研究还发现,DPD类似物不仅表现出对哈氏弧菌QS系统的抑制作用,对鼠伤寒沙门菌中的QS系统也有发挥抑制作用。
1.3.3 呋喃酮类化合物
研究者在海洋红藻(Deliseapiilchra)中提取出一种溴代呋喃酮类化合物fimbrolide,这种卤化呋喃酮破坏了AI-2生物合成途径,能阻止细菌定植在其表面,从而抑制生物膜的形成[43]。Zang等[44]在研究中发现fimbrolide能够显著抑制AI-1 QS系统,同时,fimbrolide衍生物对AI-2 QS系统也表现出非常强的抑制性,所以研究者把这类化合物看做AI-2 QS抑制剂的标杆。
1.3.4 D-半乳糖
Zhu等[45]将D-半乳糖作为抑制剂,观察它是否可以抑制AI-2活性,从而抑制牙周病原体的生物膜形成,发现D-半乳糖显示出对哈维氏菌中AI-2活性的高度抑制,同时,D-半乳糖对周期性病原体的生物膜形成也有抑制作用。
Ryu等[46]以D-半乳糖作为信号分子AI-2的抑制剂,研究了其在抑制牙周致病菌的生物膜形成过程中的作用。通过生物发光测定显示,D-半乳糖抑制了Fusobacteriumnucleatum和V.harveyi中AI-2的活性,表明其可作为AI-2抑制剂。此外,对QS抑制剂进一步分析发现,Gbp可作为一种AI-2受体,D-半乳糖与 Gbp竞争性结合AI-2,从而降低了AI-2发挥的作用[47]。除了D-半乳糖对Gbp的直接作用外,D-半乳糖可能抑制由AI-2诱导的周期性病原体的其他黏附素,包括D-核糖和呋喃酮化合物的AI-2抑制剂也可能会进一步抑制生物膜形成[48]。通过结晶紫染色法也发现,D-半乳糖会抑制F.nucleatum生物膜的形成。
2 群体感应抑制剂在食品保藏中的应用
动物性或植物性食品因储存不当极易腐败变质,而细菌是导致食物腐败变质的最主要原因之一。食物从生产到到达消费者手中要经历许多流程,其中每一步都极易被细菌污染而变质。变质的食物不仅食用品质降低,营养价值也会随之降低,部分食品还会产生相应的毒素从而危害人体健康。因此,预防食品腐败变质,延长保质期迫在眉睫。
近年来,针对QS系统与食品腐败变质相关性的研究越来越多,在不同的食品中也逐步发现了不同种类的信号分子。导致食品腐败变质的微生物不仅参与食品的腐败变质过程,同时又受到QS信号分子的调控。通过特定的途径阻断腐败菌之间的细胞交流,以切断QS系统对其相关基因表达的调控,从而减缓食品腐败的速度,延长食品保质期。因此,QS抑制剂在食品保藏中的研究有重要意义,并且取得了初步成果。
2.1 群体感应抑制剂在动物性食品保藏中的应用
动物性食品中富含蛋白质,脂类等营养成分,这就为细菌的生长代谢提供了有利的条件,导致腐败菌的繁殖和代谢,生成醛、酮或H2S等物质,致使食品腐败变质。因此,可通过抑制QS系统在腐败菌中的调控作用,达到延长食品保质期的效果。
在发酵乳的制备过程中,Shobharani等[49]发现长时间储存时会有大量的腐败菌在其中生长,最主要的为假单胞菌,假单胞菌能够产生信号分子,破坏发酵乳,导致其腐败变质。呋喃酮作为QS抑制剂对假单胞菌起到显著的抑制作用,通过添加2(5H)-呋喃酮和溴呋喃酮,减少了假单胞菌的毒力,进而延长了发酵乳的保质期。Zhu等[50]使用生物传感器测定法、薄层色谱法和气质联用技术对冷藏对虾中的QS系统进行检测,发现其中存在3种信号分子,AHL、AI-2 和环状二肽,他们能够调控腐败菌希瓦氏菌生物膜基质和胞外蛋白酶的产生,且起主要作用的是AHL。通过外源添加AHL,发现外源AHL能够抑制其他细菌生长以增加体内希瓦氏菌的种群百分比,加速了冷藏对虾的腐败变质,缩短了其保质期。因此,抑制其QS系统以延长保质期在海食品保鲜领域也显得尤为重要。Bruhn等[51]对商业生产的真空包装肉样进行提取和检测,从中分离出96株产AHL的细菌,其中Hafniaalvei是最常见的产AHL的细菌,它能够分泌3-oxo-C6-HSL,通过QS系统实现对腐败菌的调控,从而加速真空包装肉品的腐败。因此,群体感应抑制剂在肉质品中的应用对延长肉品保质期也是未来研究的重要方向。
S.aureus是最常见的革兰氏阳性球菌,在食品腐败变质和食源性疾病的引发中都扮演着重要角色。研究发现,S.aureus受到AIP的调控。当S.aureus污染食品并在较高温度下大量繁殖至106 CFU/mg,即可导致食物腐败变质,产生引起食物中毒的肠毒素,摄入1 μg的S.aureus肠毒素,即可引起急性胃肠炎、恶心、剧烈呕吐、腹痛腹泻等症状。肉、蛋及乳制品的生产销售过程都极易受S.aureus污染导致腐败变质[52]。因此,抑制S.aureus的繁殖对食品防腐和延长食品保质期具有重大的意义。
2.2 群体感应抑制剂在果蔬食品保藏中的应用
果蔬食品腐败变质的主要原因是细菌的生长代谢。在生长代谢过程中,细菌可以分泌分解果胶的酶类,这些酶类就是导致果蔬腐败变质的主要原因。
通过对能在马铃薯根茎和块茎上引发黑曲霉和软腐病的欧文氏菌(Erwinia)进行研究,发现Erwinia的毒力因子也受到QS系统的调节,粉蝶霉素A可以作为抑制剂抑制Erwinia毒力因子的表达,因此阻断了AHL与受体蛋白结合,不能形成AHL信号分子,进而阻断了信号分子对Erwinia的调控,可以在一定程度上阻止马铃薯根茎和块茎上黑曲霉的生长和软腐病的发生,达到延长其保质期的效果[53]。在豆芽的保藏过程中,豆芽的贮藏时间也受到产AHL的腐败菌的调控影响。一些产AHL的假单胞菌会分泌C6-HSL,能够加速豆芽中腐败菌的生长,导致豆芽褐变软化,缩短了豆芽的保质期[54]。
蜂蜜因其较长的保质期逐步受到研究者们的关注,Truchado等[55]在研究中发现,蜂蜜能够抑制AHL的产生,进而抑制其调控的QS系统。在进一步研究中又发现,栗子和椴树蜂蜜对AHL QS系统显示出较高的抑制活性,而桔子和迷迭香的抑制效果相对较低。因此,蜂蜜较长的保质期可归因于其抗菌性能和对QS系统的抑制能力。
3 展望
随着研究的不断扩展,研究者们发现干扰QS系统可以影响细菌对信号分子的感应,进一步影响细菌生物膜的形成和毒力因子的表达。而QS系统与食品腐败之间又存在着复杂的联系,因此,通过干扰微生物的QS系统来调控食品腐败变质,延长食品保质期就具有重大的意义。就目前的研究成果来看,对QS抑制剂的开发已经取得了一定的成果。因为细菌QS信号分子种类繁多,其作用机制也并非单一,这就要求我们要深入了解不同细菌QS信号分子的作用机制。现阶段,细菌QS抑制剂开发已成为工农业和医药等领域的研究热点,在食品行业,也有助于新型防腐剂的开发利用。相信越来越多的QS抑制剂将被发现或经人工合成,从而为新型食品防腐剂的开发提供理论依据。

