细菌群体感应对细菌生物膜形成与调控的研究进展
董汝月,于晓倩,曾名湧,刘尊英
(中国海洋大学食品科学与工程学院,山东青岛266003)
Rending等[1]根据信号分子的性质及感应模式的不同,将细菌群体感应(quorum sensing,QS)系统分为4类:① LuxI/R型信号系统。除黄色黏球菌和哈氏弧菌(Vibrioharveyi)外,大部分的革兰氏阴性菌的QS都是由这个系统调控,该系统以N-酰基高丝氨酸内酯(N-acyl-homoserine lactones,AHLs)作为信号分子。AHLs由LuxI酶合成,在细胞内不断累积后利用特定的传输系统向外运输,其数量达到一定阈值后就会与相应的受体蛋白LuxR结合进而启动下游基因的表达(图1)。研究发现,在部分革兰氏阴性菌中,LasR、CarR、ExpR、Rh1R和TraR也属于AHLs受体蛋白[2]。

图1 LuxI/R型信号系统[1] Fig.1 LuxI/R quorum-sensing system[1]

图3 LuxS/AI-2型信号系统[1] Fig.3 LuxS/AI-2 quorum-sensing system[1]
②小分子多肽介导的信号系统。主要存在于革兰氏阳性菌中,在该系统中主要利用修饰后的小分子多肽(auto-inducing peptides,AIPs)作为信号分子,AIPs不能自由穿透细胞壁,需通过ABC转运系统(ATP-binding cassette)才能到达细胞外发挥作用。AIPs浓度达到一定阈值时会与细胞膜上的双组分磷酸蛋白激酶信号识别系统结合,引发激酶的组氨酸磷酸化并使细胞内受体蛋白的天冬氨酸磷酸化,然后再与特定靶位结合后启动目的基因的表达[3](图2)。

图2 AIP介导的信号系统[3] Fig.2 AIP quorum-sensing system[3]
③LuxS/AI-2型信号系统。除了细菌种内的QS交流外,还存在一种用于种间交流的AI-2(autoinducer-2,AI-2)型群体感应系统(图3)。AI-2分子被认为是一类呋喃酮酰硼酸二酯(furanosyl borate diester),其前体为4,5-二羟基-2,3-戊二酮(DPD),在该系统中,当AI-2在菌体外积累到一定阈值时会与LuxP受体蛋白结合,再通过与激酶蛋白LuxQ反应启动相关基因的表达[4]。
④AI-3/肾上腺素/去甲肾上腺素型信号系统。人们对于该系统中的信号分子AI-3研究得很少,该信号分子是表达肠出血性大肠杆菌毒力因子的信号分子,然而该分子结构尚未明确[5],该系统的诸多功能仍在探索中(图4)。
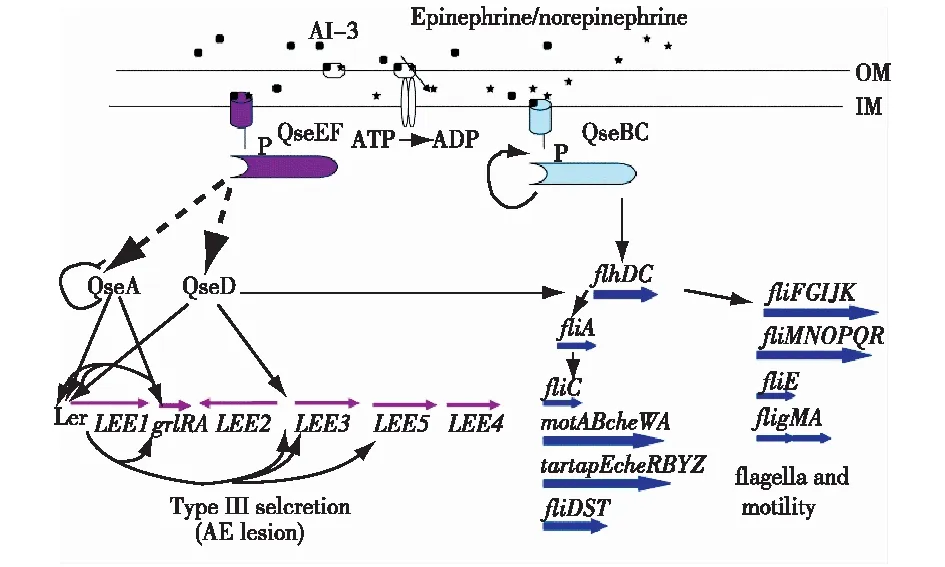
图4 AI-3/肾上腺素/去甲肾上腺素型信号系统[1] Fig.4 AI-3 quorum-sensing system[1]
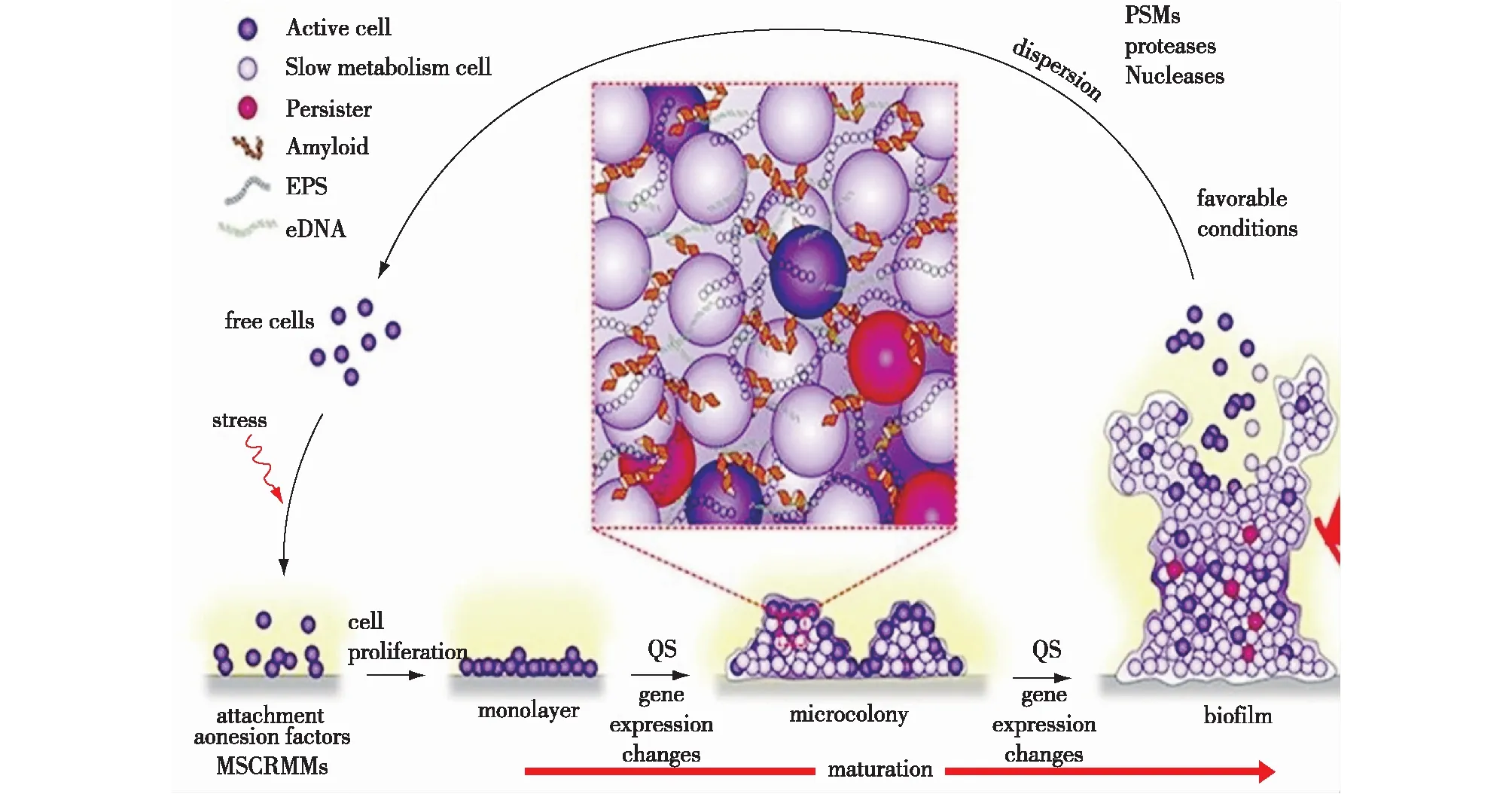
图5 生物膜形成过程 Fig.5 The biofilm life cycle
1 细菌生物膜的形成过程
细菌生物膜的形成一般包括4个阶段(图5)[6]。第一阶段为细菌初始黏附。浮游的细菌借助鞭毛的运动、流体动力或布朗运动到达载体表面;第二阶段为细菌微集落形成。吸附到载体表面的细菌在繁殖过程中通过调节基因表达,分泌出胞外聚合物如多糖、蛋白质、胞外DNA等黏附于载体表面形成微集落;第三阶段为生物膜成熟。细菌通过生长和繁殖形成复杂的三维结构的生物膜;第四阶段为生物膜的分散。生物膜中的胞外聚合物分解,单个细菌脱离生物膜,进入周围环境中,进入下一个生物膜周期[7]。细菌生物膜形成的不同阶段与群体感应密切相关,受群体感应系统的调控。
1.1 细菌初始黏附
在生物膜形成的初始阶段,微生物细胞可以通过它们的附属物(例如柱状物和鞭毛)附着到表面,也可以利用其他物理作用,如范德华力/静电相互作用等附着到其上。Yarwood 等[8]研究发现,细菌的初始黏附与细菌群体感应有关,在金黄色葡萄球菌中,agr群体感应系统控制几种与宿主基质接触的表面黏附素,这些包括纤维蛋白原和纤连蛋白结合蛋白。在某些条件下,agr突变体比野生型菌株更容易黏附在生物和非生物表面[9]。Cole等[10]发现,胃肠道病原体幽门螺杆菌具有涉及附着的群体感应luxS的同系物,并发现luxS突变体的黏附能力要比野生型菌株高2倍。
1.2 生物膜微集落的形成与成熟
细菌吸附到载体表面后,在繁殖过程中通过调节基因表达,分泌出细胞外聚合物,这些聚合物黏附到载体上形成生物膜微集落[7]。Hentzer等[11]研究表明,细菌的运动性、胞外聚合物(extracelluar polymeric substance,EPS)形成和鼠李糖脂形成会影响生物膜结构。EPS是生物膜中的主要组分,EPS占总生物膜质量的50%~80%,研究表明在生物膜成熟阶段,对EPS的形成很重要的某些基因产物被表达,而群体感应系统是EPS生成的一个重要调控机制[12]。Borlee等[13]发现第二信使环二鸟苷酸(c-di-GMP)能够正向调节EPS基质组分的产生。Starkey等[14]在铜绿假单胞菌中发现细胞内高水平的c-di-GMP能够通过促进EPS基质形成来促进生物膜生长,而较低水平的c-di-GMP促进浮游细菌的活力。Huber等[15]发现群感应系统cep可以调控cepI/R洋葱伯克霍尔德菌H111菌生物膜的成熟。在具有cepI或cepR突变的菌株中,它可以形成生物膜中的微集落,而野生型菌株则形成成熟的生物膜。Labbate等[16]和Lynch 等[17]研究发现:基于酰基HSL的群体感应影响革兰氏阴性细菌Serratialiquefaciens、嗜水气单胞菌的生物膜成熟,携带ahyI突变的菌株形成比野生型菌株结构分化更小的生物膜,ahyI突变体也显示出生物膜相关活力计数的逐渐减少,且这种表现可以通过添加外源丁酰基HSL使其恢复。Yang等[18]研究发现细菌产生的AHL显着增加了硅藻生物膜的生物量和EPS产量。
1.3 生物膜的分散
在生物膜分散阶段,生物膜内的微生物细胞快速增殖和分散,以便从生物膜中离开成为浮游形式,有利于细菌转移到新的部位从而实现传播感染[19]。Le等[20]发现,金黄色葡萄球菌的agr系统突变株的生物膜形成能力增强,同样的agr系统可以使成熟的生物膜解离,金黄色葡萄球菌的agr系统可以通过上调类似去污剂的多肽酶和核酸酶的表达来促进生物膜解离。在生物膜分散阶段,群体感应系统仍可调控生物膜解离速度而加速细菌分散、感染。
2 生物膜形成调控策略研究
由于QS系统参与细菌生物膜形成的不同阶段,故细菌生物膜形成调控策略不仅包括通过直接手段(如生物膜降解酶)去除生物被膜,还包括通过抑制QS系统来间接调控生物膜的形成,下面简要介绍几种常见的生物膜形成调控策略。
2.1 抑制细菌群体感应信号分子的产生
该策略通过干扰细菌信号分子的合成途径,抑制信号分子的合成,从而达到调控细菌生物膜形成的目的。信号分子大体分为4类:①N-酰基高丝氨酸内酯(acyl-homoserine lactones,AHLs)及其衍生物类,即AI-1类,这类信号分子主要作用于革兰阴性细菌;②氨基酸和修饰后短肽类(autoinducing peptide,AIPs),这类信号分子主要作用于革兰阳性细菌;③呋喃硼酸酯类(furanostlborate-diester),即AI-2类,它是一类种间信号分子;④其他信号分子,哈维氏弧菌产生的第三类自诱导分子13-碳羟基酮(13-carbon hydroxyl ketone),即CAI-1[21]。QS信号分子的产生是以某类物质为底物,然后经各种酶共同催化合成。因此,理论上可以通过破坏底物或抑制酶活性来阻断信号分子的合成[22]。由S-腺苷甲硫氨酸(SAM)衍生的AI-1和AI-2类信号分子,经过5′-甲基硫代腺苷/S-腺苷高半胱氨酸核苷酶(MTAN/Pfs)催化5′-甲基硫代腺苷(MTA)或S-腺苷高半胱氨酸(SAH)水解使其脱腺苷化,在这一过程中,任一产物的积累都会抑制AI-1或AI-2的产生。近年来的详细晶体学研究已经阐明了大肠杆菌SAH/MTA核苷酶结合位点的完整结构和几何结构,从而实现了更多的互补抑制剂设计。Gutierrez等[23]研究发现羟基化吡咯烷作为一种SAH/MTA抑制剂能够抑制自诱导物的产生。Schauder等[24]发现BuT-DAD Me-Immucillin-A能够抑制2种菌AI-2的产生,并导致生物膜形成显著减少。同样,Dong等[25]发现Triclosan(二氯苯氧氯酚)通过抑制烯酰基 ACP还原酶而抑制铜绿假单胞菌N-丁酰基-L-高丝氨酸内酯(C4-HSL)合成。此外,植物中含有的天然小分子物质也可以干扰信号分子的产生。Truchado等[26]研究表明,富含黄烷酮的天然橙提取物(主要是柚皮苷、新橙皮苷和橙皮苷)可通过减少AHLs的产生来降低小肠炎耶尔森氏菌的活性并抑制生物膜的形成。
2.2 降解细菌群体感应信号分子
另一种基于QS的调控策略是通过产生信号分子降解酶降解信号分子,使细菌的QS系统不能感知信号分子,从而无法启动相关基因的表达,以此调控生物膜形成。如细菌中有许多降解 AHLs 的群体感应淬灭酶,研究发现有4种类型的酶具有降解AHLs信号的能力:AHL-内酯酶和脱羧酶,能够水解信号分子内酯环;另外2种为AHL-酰基酶和脱氨酶,能够裂解信号分子酰基侧链[12]。Romero等[27]发现鱼类病原体Tenacibaculummaritimum形成生物膜依赖短链C4-HSL,并且可通过酰基转移酶降解长链C10-HSL,从而影响其生物膜的形成能力。Chevrot等[28]发现由植物产生的γ-氨基丁酸能够激活根瘤农杆菌的内酯酶(AttM)活性,进而降解AHL信号,减弱QS依赖性感染过程。Schipper等[29]在原核QS猝灭系统中添加了由一组基因bpiB编码的“内酯酶”,在Nitrobactersp.中检测到编码BpiB01、BpiB04和BpiB07的3个同系物,这些基因负责抑制生物膜的形成。Vinoj等[30]发现由地衣芽孢杆菌DAHB1表达的AHL-内酯酶(AiiA)具有广谱AHL底物特异性。纯化的重组AiiA在盖玻片试验中抑制了弧菌生物膜的发育,并显着减弱了循环水产养殖系统中虾的感染和死亡率。
2.3 使用群体感应抑制剂
群体感应抑制剂(quorum sensing inhibitor,QSI)一般为信号分子类似物,通过与信号分子受体蛋白竞争性结合,并使受体蛋白失活,进而阻断QS系统而调控生物模的形成。最早发现的群体感应抑制剂是从海洋红藻Deliseapulchra中提取的一种 AHLs 类似物——卤化呋喃酮(halogenated furanones),该物质可以破坏费氏弧菌的QS行为[31]。最早研究的(5Z)-4-溴-5-(溴亚甲基)-3-丁基-2(5H)-呋喃酮可抑制大肠杆菌中的群集和生物膜形成。Ren等[32]通过DNA微阵列分析发现,天然的溴化呋喃酮所抑制的大多数基因是参与趋化性/运动性和鞭毛合成。Roy等[33]发现,在鼠伤寒沙门氏菌中,具有2~6个碳原子侧链的合成呋喃酮能够显著抑制生物膜形成。He等[34]发现呋喃酮化合物C-30与变形链球菌在牙齿表面形成生物膜有关,这种化合物会降低与细菌黏附和生物膜积累相关的基因的表达,从而使生物膜变薄,并发现其他种类链球菌的生物膜形成被呋喃酮C-56抑制[35]。Kalaiarasan等[36]研究发现,合成的2种抗QS化合物N-(4- (4-氟苯胺)丁酰基)-L-高丝氨酸内酯(FABHL)和N-(4-(4-氯苯胺)丁酰基) - L-高丝氨酸内酯(CABHL)可以通过抗QS系统来抑制生物膜形成。在植物中同样存在与信号分子结构类似的物质,可以干扰信号分子的产生,从而干扰生物膜的形成。Siddiqui等[37]发现胡椒提取物可抑制AHLs的产生,并且抑制由铜绿假单胞菌和细菌聚生体引起的生物膜形成和EPS产生。
2.4 群体感应抑制剂与抗生素协同作用
生物膜内的细菌在生物膜胞外基质的保护下可以更好地抵抗杀菌物质。因此,破坏生物膜可能会增强细菌对杀菌物质的敏感性。Bahari 等[38]报道了添加姜黄素显著降低了阿奇霉素和庆大霉素对铜绿假单胞菌的最低抑菌浓度(MIC),且阿奇霉素比庆大霉素和姜黄素对生物膜形成和运动性表现出更大的抑制。Zeng等[39]发现抗生素氨苄青霉素和黄芩苷对铜绿假单胞菌生物膜抑制具有协同作用。Mahdiun等[40]发现铋 -乙二硫醇和妥布霉素可以协同降低铜绿假单胞菌中信号分子的产生和生物膜的形成。Brackman等[41]发现妥布霉素和黄芩苷水合物联合作用可有效减少肺部感染伯克霍尔德氏菌的微生物群体负荷,且病原菌的生物膜不能维持。
2.5 使用生物膜降解酶
生物膜调控除了基于QS的调控策略外,生物膜EPS降解酶也越来越受到重视。EPS主要成分为多糖、蛋白质、糖蛋白、脂质、磷脂、糖脂和核酸。根据EPS不同的成分,可以将生物膜降解酶分为多糖降解酶、蛋白水解酶和胞外DNA降解酶。多糖降解酶一般包括淀粉酶、海藻酸裂解酶、纤维素酶和溶菌酶。Araújo等[42]发现β-葡聚糖酶与季铵盐十六烷基三甲基溴化铵(CTAB)协同作用可去除铜绿假单胞菌60%的生物膜。Huang等[43]发现蛋白酶在去除生物膜方面更有效。Lefebvre等[44]发现,丝氨酸蛋白酶可分别降解绿脓杆菌和金黄色葡萄球菌77%和70%的生物膜。Ye等[46]研究发现,将脱氧核糖核酸酶I(DNase I)固定在钛(Ti)表面上可显著降低变形链球菌(变形链球菌)和金黄色葡萄球菌(金黄色葡萄球菌)在载体上的黏附和生物膜形成。Kim等[45]研究发现DNase I可以显著抑制大肠杆菌生物膜形成并能显著降解已形成的成熟生物膜。生物膜降解酶的使用可以替代或减少化学杀菌剂的使用,从而有效提高产品安全性。
3 结语与展望
QS系统是细菌主要的调控和交流机制,细菌利用其可以方便地感知周围环境中自身或其他细菌的浓度变化,并借此来调控细菌内某些特定基因的表达。细菌生物膜使细菌具有更强的耐药性,对人类安全产生严重威胁,而群体感应作为调控生物膜形成的重要机制之一,了解细菌生物膜形成过程中QS的具体调控过程和调控策略可以有效的去除和控制生物膜及相关感染。与化学合成的群体感应抑制剂相比,植物中提取的QSI安全性更高,并且群体感应抑制剂与抗菌剂的协同作用可以更好地减少药物的应用。最近生物膜中主要成分EPS的研究越来越多,特别是高效、绿色的酶制剂的应用发展前景也非常广阔,随着技术的不断发展,新的理论不断被提出,我们有理由相信,将来可以更好地解决细菌生物膜这一难题。

