凡纳滨对虾源气单胞菌的分离鉴定及群体感应
于红雷,韩云艳,曾名湧,刘尊英
(中国海洋大学食品科学与工程学院,山东青岛266003)
细菌利用信号分子进行交流的方式称为群体感应(quorum sensing,QS)。细菌分泌的信号分子是一种自诱导物(autoinducers,AIs),当自诱导物的浓度达到一定阈值时,会被特定的受体识别,从而启动下游基因的表达并调控细菌的群体行为[1]。 目前研究表明,革兰氏阴性菌和革兰氏阳性菌都存在群体感应系统,革兰氏阴性菌主要以酰化高丝氨酸内酯(N-acyl homoserine lactone,AHLs)作为信号分子,而革兰氏阳性菌则采用被修饰过的寡肽类(autoinducing peptides,AIPs)为信号分子。QS在调节细菌的群体行为和生理功能中发挥着重要作用,比如生物发光、生物膜的形成、毒力基因的表达和致腐能力等[2-3]。近年来,越来越多的研究表明食物腐败与细菌的QS有关,Fu等[4]研究发现QS可以控制波罗的海希瓦氏菌(Shewanellabaltica)腐败相关基因的表达,Christensen等[5]报道了SerratiaproteamaculansB5a的腐败行为受QS调节,并且S.proteamaculansB5a的sprI(负责产生AHLs)突变体失去对牛奶的腐败能力。
气单胞菌(Aeromonasspp.)是革兰氏阴性菌,广泛存在于海水、池塘等水生环境中,是一种导致胃肠炎和败血症的人畜共患条件致病菌,气单胞菌分泌AHLs类信号分子并且调控其毒力基因的表达[6-7]。气单胞菌在凡纳滨对虾和大黄花鱼的腐败过程中发挥重要作用[3,8],并且绿薄荷精油通过抑制温和气单胞菌AHLs的分泌降低了腐败能力(胞外蛋白酶活性)[9]。因此,本研究中,笔者拟从冷藏凡纳滨对虾中筛选、鉴定气单胞菌,并研究气单胞菌的群体感应特性,以期阐明气单胞菌的致腐机制及实现对水产品腐败的精准控制。
1 材料与方法
1.1 材料、菌株和培养条件
AHLs标准品,Sigma 公司;偶氮酪蛋白、壮观霉素、四环素、卡那霉素、X-gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷),Solarbio 公司;RP-C18反相薄层板,Merck 公司;细菌基因组提取试剂盒,北京全式金公司;LB液体培养基、RS鉴别培养基等相关培养基,青岛海博生物技术有限公司;其余试剂均购自国药集团试剂有限公司。
气单胞菌、紫色杆菌(ChromobacteriumviolaceumCV026)和根癌农杆菌(AgrobacteriumtumefaciensA136)均在LB培养基中培养,培养条件为 30 ℃、160 r/min。根癌农杆菌培养体系需加入50 mg/L壮观霉素和4.5 mg/L四环素,紫色杆菌培养体系需加入20 mg/L卡那霉素。
1.2 气单胞菌的分离鉴定
冷藏凡纳滨对虾贮藏到货架期终点时,选取虾肉打浆,之后稀释至适当梯度涂布于RS培养基中,于30 ℃培养24 h。挑取黄色菌落于LB液体培养基中培养纯化,将分离纯化后的菌株进行16S rRNA 测序、鉴定,然后通过NCBI数据库比对并用MEGA6.0构建系统发育树。
1.3 气单胞菌群体感应信号分子 AHLs 的检测
1.3.1 气单胞菌AHLs粗提液的制备
将菌株在LB液体培养基中培养,30 ℃、180 r/min振荡培养至一定的密度后,8 000 r/min离心5 min,取上清液,用等体积含0.5%(体积分数)甲酸的乙酸乙酯萃取3次,混合有机相旋蒸至干,溶于二甲亚砜,-20 ℃保存备用。
1.3.2 薄层层析(TLC)法检测AHLs
将AHLs标品和样品粗提液点样于C18反相薄层板上,并以甲醇/水(体积比3∶ 2)展开,无菌风吹干,将紫色杆菌CV026与含0.7 %(质量分数)琼脂的LB混合均匀,低于 42 ℃铺于薄层层析(TLC)板上,凝固。30 ℃密闭容器中培养24~48 h,观察颜色变化[10]。
1.3.3 AHLs含量检测
将过夜活化的菌株按体积比1∶ 1 000接种于LB液体培养基中,于180 r/min、30 ℃培养。每隔 4 h 测OD600按照 1.3.1方法提取信号分子,-20 ℃保存备用。将AHLs提取物、A136裂解物和20 mmol/L的KH2PO4溶液均匀混合(体积比1∶ 1∶ 2)后,取200 μL混合液加入96孔板中,再加入X-gal(500 μg/mL)。30 ℃培养3 h,酶标仪检测吸光值OD635。阴性对照加入等量二甲基亚砜(DMSO),以β-半乳糖糖苷酶活性(OD635)表示AHLs的相对含量。
1.4 气单胞菌生长曲线测定
将菌株接种于添加和未添加C4-HSL的AB培养基中,于30 ℃、180 r/min培养,每隔4 h测定菌落总数和OD600,绘制生长曲线。
1.5 气单胞菌生物膜的测定
参照Peeters等[11]的方法,利用结晶紫染色法测定细菌的生物膜能力。将添加和未添加C4-HSL(10 μmol/L)的菌液于48孔酶标板中,30 ℃、180 r/min培养24 h。除去菌液,用蒸馏水清洗孔板3次,置于50 ℃烘箱烘干30 min,然后再加入1.2 mL质量分数1%的结晶紫,染色15 min,再用蒸馏水清洗每个孔3次后,加入1.2 mL体积分数95%的乙醇,静置5 min,在570 nm处测定吸光值OD570,以吸光值大小表示生物膜形成量的多少。
1.6 气单胞菌蛋白酶活力测定
蛋白酶测定用偶氮酪蛋白作为反应底物,将菌株接种于添加和未添加C4-HSL的LB培养基中,30 ℃、180 r/min培养24 h,4 ℃、10 000 r/min离心5 min,取上清液作为粗酶液。反应体系为200 μL偶氮酪蛋白(20 mg/mL)和400 μL上清液,混合均匀后置于30 ℃水浴1 h,再加入600 μL三氯乙酸终止反应。对照组为先加入偶氮酪蛋白水浴,再加入三氯乙酸,最后加入上清液。然后再4 ℃、10 000 r/min离心5 min,取500 μL上清液和等体积的NaOH(1 mol/L)混合,在440 nm处测定吸光值OD440,以吸光值大小表示蛋白酶活力的相对强弱。
2 结果与讨论
2.1 气单胞菌的分离鉴定结果
气单胞菌的16S rRNA 基因琼脂糖凝胶电泳图如图1(a)所示。
由图1(a)可知,其目的片段在1 800 bp左右。将得到的16S rRNA 基因序列通过 NCBI的BLAST系统进行序列相同性检索,结果表明该菌为气单胞菌属(Aeromnasspp.)。
系统发育学分析结果如图1(b)所示。由图1(b)可知,该菌与Aeromonassp. J1.3E2亲缘关系最近,相似性达 99.0%。因此,判定该菌为气单胞菌属,命名为Aeromonassp. A01。
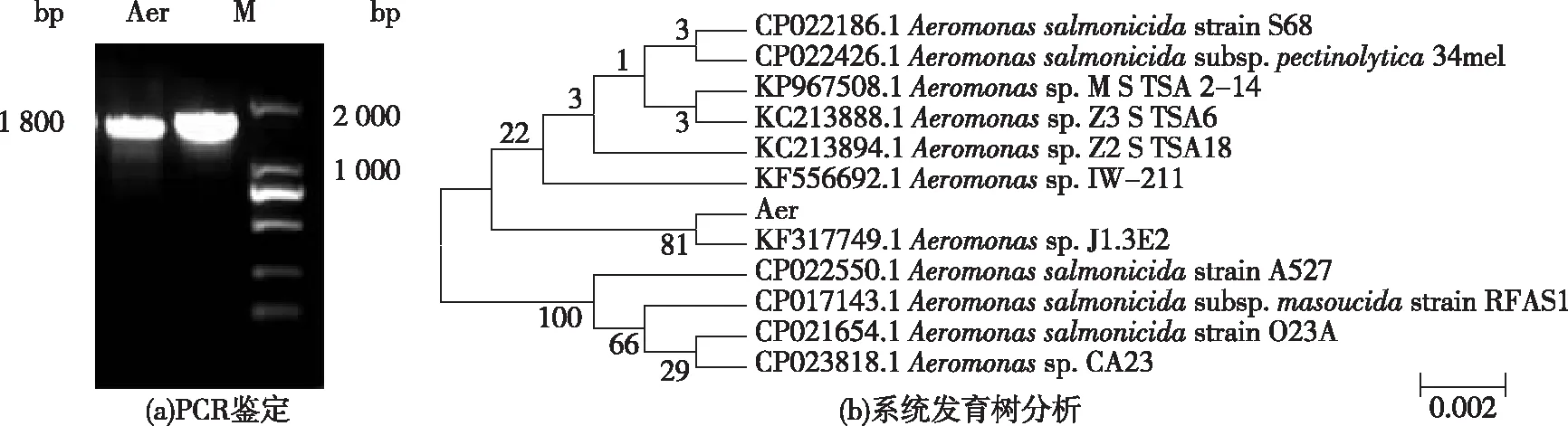
Aer:Aeromonas spp.A01;M:基因Marker;分支上的数值代表为自举1 000次的结果图1 16S rRNA PCR 扩增产物电泳图和系统发育树 Fig.1 16S rRNA PCR amplified products electrophoresis of Aeromonas sp. A01 (a); relationship between Aeromonas sp.A01 and other Aeromonas sp.(b)
2.2 Aeromonas sp. A01信号分子种类与含量分析
气单胞菌属细菌主要分泌C4-HSL和C6-HSL类信号分子[12-13]。本研究中,用TLC法检测Aeromonassp. A01的种类和含量,结果如图2所示。
由图2(a)可知,气单胞菌Aeromonassp. A01可产生C4-HSL,但未检测到C6-HSL信号分子。由图2(b)可知,随气单胞菌培养时间的延长,信号分子AHLs含量呈逐渐增加趋势,且AHLs的含量自对数生长期显著增加(P<0.05),并在12 h左右达最高值,进入稳定期后,AHLs含量趋于稳定,这可能是细菌密度在对数生长期不断增加,而稳定期保持不变造成的。

图2 TLC法检测Aeromonas sp. A01的AHLs 种类和含量 Fig.2 TLC analysis of AHLs secreted by Aeromonas sp. A01(a); the growth curve and AHLs activity of Aeromonas sp. A01(b)
2.3 外源信号分子C4-HSL对Aeromonas sp.A01生长、生物膜和蛋白酶的影响
为进一步探究Aeromonassp. A01的群体感应特性,本研究通过添加外源信号分子C4-HSL研究群体感应对Aeromonassp. A01生长、生物膜和蛋白酶的影响,结果如图3和图4所示。
由图3可知,自对数生长期后期,外源C4-HSL(10 μmol/L)显著促进了Aeromonassp. A01的生长(P<0.05)。表明Aeromonassp. A01可利用C4-HSL促进自身的生长,而细菌总数是衡量水产品腐败的重要指标,Aeromonassp. A01可能通过利用QS促进自身生长进而加速水产品的腐败。
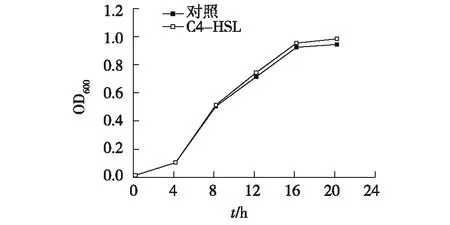
图3 外源信号分子C4-HSL对Aeromonas sp. A01 生长的影响 Fig.3 Effects of exogenous C4-HSL on the growth of Aeromonas sp. A01
腐败菌分泌的蛋白酶会将食物蛋白质分解成小肽和氨基酸,并进一步氧化降解产生腐败异味[14]。细菌蛋白酶活性高低可加快或延缓食品腐败进程。细菌蛋白酶活性受细菌群体感应系统的调节,信号分子AHLs可显著促进Pseudomonasfluorescens蛋白酶产生[15],同时群体感应受体LuxO也会影响Vibriocholerae的蛋白酶活性[16]。由图4可知,外源C4-HSL可提高Aeromonassp.A01蛋白酶活性,培养36 h后,其蛋白酶活性提高了20%。与对照差异达显著水平(P<0.05)。
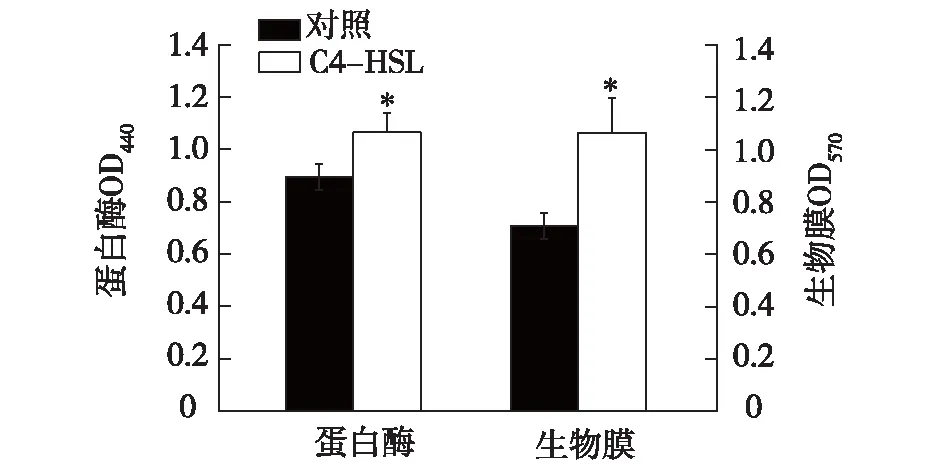
图4 外源信号分子C4-HSL对Aeromonas sp. A01 蛋白酶活性和生物膜形成的影响 Fig.4 Effects of exogenous C4-HSL (10 μmol/L) on protease activity and biofilm formation of Aeromonas sp. A01 inculated for 36 h
细菌生物膜的形成代表了一种受保护的生长模式,它允许细菌在恶劣的环境中生存。生物膜形成通常受QS系统调控[17-18]。图4结果证实,Aeromonassp.A01具有很强的生物膜形成能力,外源添加C4-HSL后,其生物膜形成能力提高了51%,与对照差异达极显著水平(P<0.01)。由此推测,Aeromonassp. A01通过利用C4-HSL促进自身生物膜形成与蛋白酶分泌,进而增强抗逆性,加速水产品营养物质的降解,最终加速水产品的腐败。
3 结论
从冷藏的凡纳滨对虾中成功分离出气单胞菌,并命名为Aeromonassp.A01,其可产生C4-HSL类信号分子,且在对数生长期前后达最大值并在稳定期保持在较高水平。Aeromonassp.A01可利用外源信号分子C4-HSL调控自身生长,并能利用外源信号分子调控自身蛋白酶产生与生物膜形成。
冷藏凡纳滨对虾气单胞菌生长、蛋白酶活性和生物膜形成与AHLs介导的群体感应密切相关,C4-HSL可促进气单胞菌生长、生物膜形成能力和蛋白酶活性提高。因此,气单胞菌的群体感应系统或群体感应信号分子可作为控制冷藏凡纳滨对虾腐败的新靶点,但其详细的作用机制还需进一步探究。

