微生物群体感应系统的调控机制及应用研究进展
周 朋,王 喆,包美娇,董明盛,吴俊俊
(南京农业大学食品科技学院,江苏南京210095)
微生物之间可以通过自身合成特殊的信号分子,以实现种内和种间的交流,来启动特定基因的表达,从而控制整个群落的状态,目前一般将这种现象称为群体感应(quorum sensing,QS)。自体诱导物(autoinducer,AI)[1-2]是具有扩散性,且可以被微生物感应到的信号分子。AI的浓度会随着细胞密度的增加而不断提高,达到一定的浓度后,可以和胞内的受体蛋白相结合形成信号分子——受体蛋白复合体,复合体可以和QS系统启动子结合,并调节下游控制细胞群落密度的基因的表达量。因此,AI可以视作微生物之间交流的语言,不同种类微生物的语言不同。革兰氏阴性菌中的AI通常为酰基化的高丝氨酸内酯类化合物(acyl-homoserineLactone,AHL)[3-4]。在革兰氏阳性菌中的AI为氨基酸和短肽类物质(autoinducing peptides,AIPs)[2,5]。革兰氏阴性菌和革兰氏阳性菌均可以感应由luxS基因表达产生的4,5-二羟基-2,3-戊二酮(AI-2)系列的自体诱导物分子,实现革兰氏阴性菌和革兰氏阳性菌种间的交流[6]。
本文中,笔者介绍了革兰氏阴性菌和革兰氏阳性菌的代表性群体感应系统以及群体感应系统在动态学调控、致病菌防治以及食品防腐领域的研究现状。
1 代表性的群体感应系统
费氏弧菌以及铜绿假单胞菌均为革兰氏阴性菌,通过AHL类信号分子调控群体感应;粪肠球菌以及金黄色葡萄球菌均为革兰氏阳性菌,通过AIP类信号分子调控群体感应。它们的群体感应系统目前研究得比较清晰,并且非常有代表性,在发酵工程动态调节、致病菌防治等领域也多有应用,因此本文中,笔者选择这4株菌作为代表,简介其QS系统及相关基因调控元件。
1.1 费氏弧菌的LuxI/R群体感应系统
来自海洋的发光细菌费氏弧菌(Vibriofischeri)是一种革兰氏阴性菌,通过高丝氨酸内脂介导的QS调节生物发光,并且借助这一特性和许多真核宿主建立起共生关系。费氏弧菌群体感应系统如图1所示。费氏弧菌中的LuxI/R群体感应系统由luxicdabe、luxr两个操纵子组成[2,7]。luxi负责编码信号分子蛋白LuxI,参与信号分子3-oxo-C6-HSL的合成,正常情况下有痕量表达。luxr负责编码信号分子受体蛋白LuxR,LuxR和信号分子结合后结构发生改变,可以结合到luxr、luxi基因中间的启动子区,启动下游luxab基因负责编码的荧光素酶亚基基因的表达,同时抑制luxr基因的继续表达,形成负反馈。
荧光素酶表达后催化费氏弧菌胞内的分子氧将长链的脂肪醛和还原态的黄素单核苷酸氧化为长链脂肪酸,同时释放出最大发光强度波长位于450~490 nm的蓝绿光。在海水中时,费氏弧菌的浓度较低,其周围的信号分子浓度也较低,因此合成荧光素酶的基因关闭,细菌不发光;当费氏弧菌附着于鱼类或乌贼等海洋生物上时,菌体密度达到一定的程度,荧光素酶基因被强力启动,细菌发出荧光。在费氏弧菌的宿主夏威夷短尾鱿鱼上费氏弧菌可能达到109~1010个/cm3的细胞密度,费氏弧菌利用宿主体内丰富的营养物达到相当高的群落密度,发出的荧光又会为宿主吸引到猎物或者摆脱捕食者追捕,两者借此互利共生[8]。
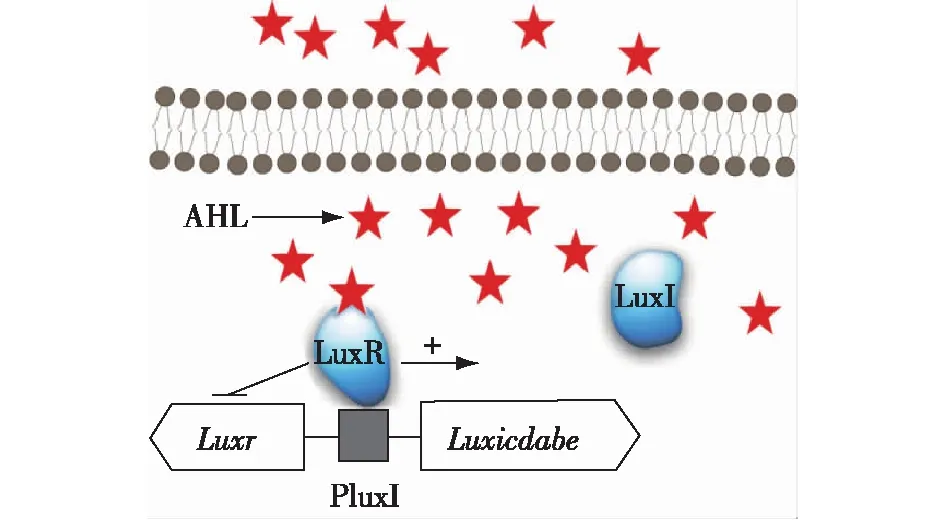
图1 费氏弧菌群体感应系统 Fig.1 Quorum sensing system of Vibrio fischeri
1.2 铜绿假单胞菌的Las-Rhl群体感应系统
铜绿假单胞菌(Pseudomonasaeruginosa)是一种常见的病原菌,属于革兰氏阴性,通过高丝氨酸内酯介导的QS系统调控其生命活动过程[9-10],包括毒力因子的表达、生物膜的形成、抗生素排出泵的表达以及运动性等。铜绿假单胞菌群体感应系统如图2所示。铜绿假单胞菌的群体感应系统是费氏弧菌群体感应系统研究的延伸,铜绿假单胞菌QS系统相关元件和费氏弧菌LuxI/R系统有显著的同源性,但是铜绿假单胞菌的QS系统更为复杂。铜绿假单胞菌QS是一个复杂的层次网络[11],包含了Las和Rhl两套QS系统,它们相互独立又相互关联。Las系统中[12-13],lasi基因控制信号分子3OC12-HSL(PAI 1)的形成,信号分子合成后分泌到胞外环境,当累积到一定的浓度后会和LasR结合并激活大量毒力因子基因表达。包括:lasB、lasA、apr、toxA和lasI自身[14-17],实验证明缺失有活性的LasR蛋白的铜绿假单胞菌对动物无害。
Rhl系统中[18-19],rhl催化N-butyryl-L-HSL(PAI2)的合成,该信号分子和RhlR结合后可以激活负责鼠李糖脂合成的rhlAB基因、负责信号分子蛋白合成的rhli基因和lasB基因的表达。Rhl系统也负责一些毒力因子表达[20-22],包括绿脓菌素、氰化物和几丁质等。这两个系统之间存在级联调控关系,Las系统控制转录激活蛋白RhlR的表达,因此Rhl系统控制的基因需要有完整且有活性的Las系统才能被完全激活[23-24]。两种系统同时调节多种基因表达[15,22,25-28],包括合成弹性蛋白酶、分泌蛋白、过氧化氢酶、外毒素、外凝集素、酰基高丝氨酸内酯和超氧化物歧化酶等多种毒力因子基因的表达。PAI Ⅰ会阻碍PAI Ⅱ和RhliR的结合,确保两套系统分别在合适的时间运行[2]。
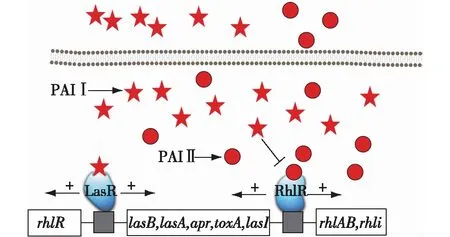
图2 铜绿假单胞菌群体感应系统 Fig.2 Quorum sensing system of Pseudomonas aeruginosa
1.3 金黄色葡萄球菌的Agr群体感应系统
金黄色葡萄球菌(Staphylococcusaureus)是一种非常常见的人类致病菌,属于革兰氏阳性,金黄色葡萄球菌群体感应系统如图3所示。它的Agr群体感应系统的核心agr操纵子包括一个编码的自诱导肽(autoinducing peptides,AIPs) AgrD的基因agrD、一个负责编码加工蛋白(AgrB)的基因agrB、一个编码组氨酸激酶感应器(AgrC)的基因agrC和一个编码反应调节器(AgrA)的基因agrA。AgrD是一种自诱导肽,负责QS系统的调控,在正常情况下保持较低的表达量,其可以被膜蛋白AgrB加工,截短成只保留活性肽段的AIP并不断分泌到胞外,胞外的AIP浓度不断增加最终达到临界阈值后会被膜蛋白AgrC部分感知。然后AgrC膜蛋白会发生磷酸化,并将反应调控子AgrA磷酸化,磷酸化后的AgrA-P结合到agrABCD上游的启动子区域,形成正反馈,启动agrABCD基因和其他受Agr调控系统控制基因的表达[3]。
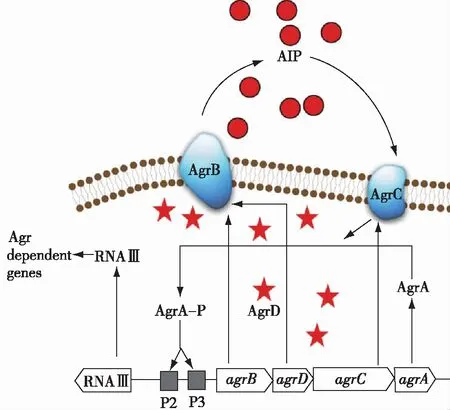
图3 金黄色葡萄球菌群体感应系统 Fig.3 Quorum sensing system of Staphylococcus aureus
1.4 粪肠球菌的Fsr群体感应系统
粪肠球菌的群体感应系统为Fsr系统[29],如图4所示。核心的fsr操纵子包含了fsrA、fsrB和fsrC3个基因,fsrA基因转录合成反馈调节肽FsrA,fsrB和fsrC一个编码加工蛋白(FsrB),一个编码组氨酸激酶感应器(FsrC),两者共同构成一个操纵子。fsrB编码的膜蛋白FsrB会加工Gelatinase biosynthesis activates pheromones(GBAP)并释放到胞外。FsrC位于细胞膜上,可以协助GBAP进入细胞。粪肠球菌从指数期到稳定期的过程中,GBAP不断积累,当GBAP浓度达到启动子检测阈值,处于fsr操纵子下游编码白明胶酶和丝氨酸蛋白酶的gelE和sprE基因分别被诱导启动。不同于Agr系统,Fsr系统的启动是通过GBAP使FsrA发生磷酸化后直接和各个基因相对应的启动子相结合,启动下游基因的转录,而不涉及其他的信号分子的加工。相对的,当粪肠球菌数量较少,体系中的GBAP浓度低于一定的值时,FsrA会抑制fsrB-fsrC和gelE-sprE基因的表达。
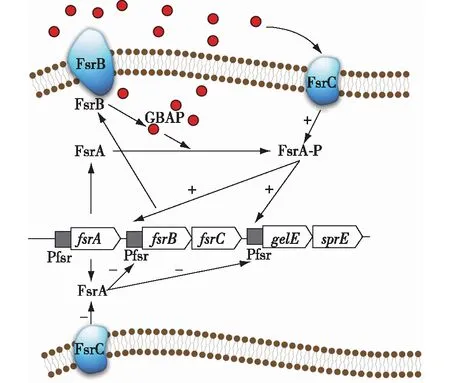
图4 粪肠球菌群体感应系统 Fig.4 Quorum sensing system of Enterococcus faecalis
2 群体感应系统的应用
2.1 利用群体感应系统调节代谢流
发酵工程菌负责合成大量重组蛋白,构建人工代谢通路,如果在培养起点就启动蛋白表达会对菌体带来巨大的负担,使菌株无法达到良好的生长状态。菌株的不良状态会影响最终的产量[30]。因此,前人通过引入各式诱导表达调控系统实现转录水平的调控,其中以受IPTG诱导的T7表达系统应用最为广泛。传统的诱导表达调控系统有许多优点,包括能通过调节诱导剂浓度调节基因表达强度、通过控制诱导剂添加时间控制基因表达的启动以平衡菌体的生长和产物的合成等。但是传统的诱导表达调控系统也有许多缺点[31],包括无法实现动态调控、对细胞状态无法及时反馈等。另外,诱导剂价格不菲且对细胞有一定的毒性,这阻碍了其在工业化中的推广[32]。
解决这一问题的方法之一就是在发酵菌株内引入动态代谢途径调控系统来控制途径基因的表达。已经有许多这方面的尝试[33]。Farmerw等[34]通过在大肠杆菌体内构建一个乙酰磷酸的感应器调节番茄红素的合成。Dahl等[35]在大肠杆菌中构建了一个感应有毒中间代谢产物焦磷酸法尼酯的压力反馈感应器,使终产物青蒿素前体紫穗槐二烯产量提升了2倍,且避免了IPTG的添加。Soma等[36]通过在Plux启动子中插入lacO操纵子构建了一个可以响应于IPTG浓度的杂合启动子,实现了异丙醇生物合成的动态调控。有研究利用枯草芽孢杆菌中存的在丙二酰辅酶A调控系统设计了响应丙二酰辅酶A浓度的负反馈调节系统,提高了脂肪酸的产量[37-38]。
但是这些策略缺乏普适性,需要构建与产物途径相关的感应器,无法应对复杂多变的产物需求,而群体感应系统可以通过感应范围内菌浓度并启动相应基因的表达,同时具有动态调节和通用性的优点。Williams等[39]在酿酒酵母中构建了一个高种群密度自动触发表达的基因开关,并通过该策略提高了莽草酸途径生产的对羟基苯甲酸的产量。Gupta等[40]利用Pantoeastewartii菌的群体感应系统构建了一个不依赖于代谢通路的基因控制元件,可以实现靶基因的动态调节,利用该元件筛选将糖分解代谢流重新分配到异源合成途径中的最佳时间点,使肌醇的浓度提高了5.5倍,同时使葡萄糖二酸浓度从无法检测提高到大于0.8 g/L,另外还将莽草酸的浓度从不可检测提升到200 mg/L。Anand等[41]也证明利用QS系统可以用来辅助胞外酶的生产,细胞只有在在很高的临界密度时胞外酶的产出才是占优势的,利用QS系统控制胞外酶产生使得发酵菌株在起始密度低,生长周期比胞外酶产生时间长时更具优势。基于群体感应的发酵工程动态调节结合发展迅速的合成生物学未来必将有更广泛的空间。目前,利用群体感应进行有害微生物的防治具有更多的可能性以及现实性。
2.2 利用群体感应系统防治有害微生物
2.2.1 利用群体感应防止食品腐败
食品腐败是指食品在微生物作用下感官品质、营养品质以及卫生安全品质发生不良变化,丧失可食性的现象,每年食品腐败都导致了巨大的经济损失并且引起了严重的卫生安全问题[42]。研究表明特定微生物之间的QS在食品腐败全程中均有参与,相关脂肪分解酶、蛋白分解酶的表达,生物膜的形成都与之相关。QS广泛存在于各类食品腐败过程中[43-45],在牛奶、水果和蔬菜等各类腐败食品中均检测出了QS信号分子[46],牛奶和奶制品的腐败主要由假单胞菌和沙雷氏菌引起,肉制品的腐败主要由蜂窝哈夫尼亚菌和沙雷氏菌引起,鱼类和水产品的腐败主要由腐败希瓦氏菌和不动杆菌引起,果蔬的腐败主要由欧文氏菌、假单胞菌和肠杆菌引起,针对这些微生物的群体感应调控参与的腐败过程,研究人员希望通过抑制特定腐败微生物的群体感应解决食品腐败问题。
对于细菌群体感应的抑制和干扰主要有以下3种途径[47]:抑制信号分子的合成、促进信号分子的降解和抑制信号分子与受体蛋白的结合,这些能够抑制微生物的群体感应效应的物质称为群体感应抑制剂(quorum sensing inhibitor,QSI)。目前QSI依据来源可分为天然提取和人工合成这两类[47]。现今常用的人工合成的QSI,如卤代呋喃酮及其衍生物虽有较强的干扰QS信号通路的活性,但是大多具有一定的毒性,有些QSI甚至可能诱变致癌,不适合应用于食品保鲜。考虑到食品安全问题,从食源性材料中提取QSI用于食品防腐是目前比较有效的方式。
Shobharani等[48]针对引起牛奶腐败的假单胞菌,利用300 μmol/L浓度的二氢呋喃酮阻断发酵牛奶中假单胞菌的信号交流,抑制了其毒力因子的产生,将货架期延长到了9 d。Bai等[49]研究了孜然、姜黄、苦艾、延胡索、香肉豆蔻、葫芦巴以及小豆蔻等香料精油对于酰化的高丝氨酸内酯介导的群体感应和生物膜形成的影响,发现在体积分数为0.02%时孜然精油具有最好的QS抑制效果和抗生物膜形成活性,亚抑菌浓度的孜然精油通过阻碍细胞接触、降低细胞代谢和胞外聚合物产生抑制了假单胞菌的生物膜形成,延迟了冷冻牛奶中嗜冷性假单胞菌PSPF19引起的腐败。
Chan等[50]从马来西亚雨林的生姜根围中分离出3株具有抑制群体感应效果的菌,分别鉴定为不动杆菌(GG2),伯克霍尔德菌(GG4)和克雷柏氏杆菌属(Se14)。GG2和Se14通过自身产生的内酯水解酶产生广谱的AHL降解活力从而抑制群体感应,而GG4则通过酰基转移酶改变AHL的结构实现群体感应的抑制。GG2和GG4也存在依赖于AHL的群体感应,它们产生的QSI对于自身的AHL以及外源的AHL均有抑制作用。实验证明3株菌能有效减弱人和植物内的病原菌毒力因子的表达,且能有效抑制土豆块茎中胡萝卜软腐欧文氏菌对于蛋白质的水解活性,延缓腐败。
Truchado等[51]基于蜂蜜具有一定的抗菌活性这一研究结果,进一步探究了29种不同植物来源、不同地区的蜂蜜的群体感应抑制活性,发现测试蜂蜜在0.1 g/mL质量的浓度下就能够抑制AHL的生成,其中栗子和椴科植物的蜂蜜具有不依赖于酚类的QS抑制活性,因此有望从蜂蜜中分离出安全且高效的QSI。
Vattem等[52]发现从可食用的水果、香草等植物中分离出的食用植物素对人体有益并具有抗菌活性,亚抑菌浓度的食用植物素可以同时干扰AHL活性以及抑制AHL的合成,两种途径相结合抑制群体感应,并且食用植物素还能抑制病原菌的聚集,可用于抗菌化学疗法。
目前QSI在食品防腐中的应用方兴未艾,更多研究者将目光聚焦于将群体感应运用于新型医疗手段的开发。
2.2.2 利用群体感应系统防治致病菌
抗生素因其强大的抗菌能力而被广泛应用于医学医药领域,然而,抗生素的滥用也渐渐导致越来越多新型耐药性致病菌的出现。抗生素渐渐变得低效[53]。
铜绿假单胞菌极易导致免疫力低下患者的感染[54-55],呼吸道囊性纤维化患者、外伤烧伤患者或者需要通风的创伤患者都易感染铜绿假单胞菌并引发严重后果,在治疗过程中大量使用抗生素导致耐药性铜绿假单胞菌的出现[56]。
根据美国疾病控制中心报告,在众多人类致病菌中,由金黄色葡萄球菌引起的感染居第二位,金黄色葡萄球菌感染已经属于世界性的卫生问题[57],其高度的适应性和传播性使得它更易产生耐药性突变,多耐药性金黄色葡萄球菌检出率不断增高[58]。这两种菌的致病性基因的表达都受到QS系统的监管调节,研究人员尝试通过QSI设计新型治疗方案,减少对致病菌施加的选择生存压力,减少耐药性菌株的出现。
新加坡南洋理工大学的Ling等[59]发现铜绿假单胞菌PAO1可以编码一种新型的S型绿脓杆菌素pyocin S5,对于7株临床分离的铜绿假单胞菌具有抗菌活性。Saeidi等[60]基于这个发现,构建了一株能检测致病性铜绿假单胞菌并通过释放pyocin S5裂解杀灭致病菌的工程大肠杆菌,他们在大肠杆菌体内导入组成型表达的铜绿假单胞菌QS系统受体蛋白基因lasr、受铜绿假单胞菌QS调控表达的绿脓杆菌素基因PyocinS5以及细胞溶解酶基因LysisE7。大肠杆菌感应到体系内的铜绿假单胞菌QS信号分子后会启动下游基因的表达,生成可破坏铜绿假单胞菌细胞膜而对大肠杆菌无效的pyocin S5,杀死体系内的铜绿假单胞菌并将细胞溶解。结果显示该基因工程菌能降低生物膜的厚度,检测并杀死99%浮游的铜绿假单胞菌。
Hwang等[61]针对被生物膜包被的铜绿假单胞菌,在此基础上引入了趋药性基因CheZ,使大肠杆菌能自发富集到铜绿假单胞菌AHL信号分子浓度较高的区域,再利用抗菌肽MccS和抗生物膜酶DNase1,达到同时杀灭浮游的铜绿假单胞菌和生物膜包被的铜绿假单胞菌的目的。
Loughlin等[62]研究了一种人工合成的群体感应抑制剂mBTL,可以抑制铜绿假单胞菌的毒力因子绿脓杆菌素和生物被膜形成。mBTL主要作用于铜绿假单胞菌的两个QS受体蛋白LasR和RhlR,具有和信号分子相似的结构,可以通过与受体蛋白的竞争结合,抑制受QS调控的相关基因的表达,8 μmol/L的浓度即可绿脓杆菌素生产,且经实验证明在体内体外均能有效。
Srivastava等[63]发现从母马初乳中提取的多聚己糖具有抑制金黄色葡萄球菌QS的功效,可以抑制金黄色葡萄球菌毒力因子的表达,同时增加了其对抗生素的敏感性。
Cosgriff等[3]在对耐甲氧西林金黄色葡萄球菌的毒力因子筛查过程中发现了一个膜内嵌的肽酶基因(MroQ),缺失该基因的金黄色葡萄球菌显著降低了AIPs的分泌,受QS调控的一系列毒力因子表达也因此变弱,这个发现为利用QS系统建立安全的金黄色葡萄球菌感染治疗方案提供了新的思路。
4 群体感应系统的应用与展望
群体感应系统的深入研究为发酵工程动态调控、有害微生物防治等提供了新的思路,但是目前的研究依然存在一些不足或尚未明晰之处。目前群体感应的复杂多层次的调控网络还未能完全解析清楚,不同调控系统之间是否可以互相干扰也需要进一步的探究;基于群体感应的动态调控存在一定的渗漏,无法对靶基因的表达实现严谨调控,且基因表达的启动是不可逆的。需要对以群体感应为基础的基因元件进一步优化改造以及发现更加优秀的群体感应调节元件,努力使发酵过程更加简化,成本更加低廉,控制更加精密,向产业化方向靠拢;以QSI为基础的食品防腐剂目前的应用局限性在于从植物中提取的含量有限,而天然合成的QSI在食品安全性上很难得到保障,对于QSI的探索还需要充分考虑其应用的安全性及稳定性。

