细菌群体感应及其调控应激反应的研究进展
李鹏飞,武瑞赟,李平兰
(中国农业大学食品科学与营养工程学院,北京100083)
每个细菌自身都可以分泌一种化学信号分子,可以在细胞内外环境中自由扩散,从而分布于细菌的生长环境中。由于这些信号分子由菌体自身分泌并能调节菌体生长行为,所以被称为自诱导因子[1](autoinducers,AIs)。自诱导因子的浓度随着细胞密度的增加而增加。在细菌的细胞质或细胞膜上存在着自诱导因子的受体,能够实时感受自诱导因子浓度的变化,自诱导因子浓度一旦达到阈值,细菌就会利用细胞间通信协调它们的行为及相关表型的表达,这种现象被称作群体感应[1](quorum sensing,QS)。现已证实,QS系统对于细菌具有多种调控功能,如:细菌运动[2]、致病菌毒力因子的产生[3]、生物被膜形成[4]、菌体发光[5]、抗生素及色素的产生[6]和细菌素的产生[7]等。近年来一些研究表明,QS系统对细菌的应激反应也可能具有一定的调控功能。细菌的应激反应是指细菌对外界环境胁迫表现出的各种特定的、高度调节的适应性反应[8]。这些反应不仅可以保护细菌本身不受胁迫影响,而且能使得细菌对固有抗菌素的敏感性发生变化。对细菌应激反应展开研究,既有助于对致病菌的生长进行抑制,也有助于提高益生菌在食品加工生产中的生存能力。
1 细菌的QS系统
一般来说,细菌的QS系统主要分为3类:革兰氏阳性菌特有的QS系统、革兰氏阴性菌特有的QS系统以及革兰氏阳性菌和革兰氏阴性菌共有的QS系统。此外,在某些肠道病原体中还存在由信号分子AI-3诱导的QS系统,但相关研究较少,其分子结构及调节机制都有待研究[9]。
1.1 革兰氏阳性菌QS系统
革兰氏阳性菌QS系统中的自诱导因子是自诱导短肽(autoinducing peptides,AIPs)。细胞中产生的AIPs达到一定阈值时,会与位于细胞膜上的特异性受体分子结合,从而激活组氨酸激酶双元信号转导系统的激酶活性,使受体磷酸化,之后将受体传递给细胞质中的反应调控蛋白,被磷酸化的反应调控蛋白与DNA上的基因启动区结合,从而触发QS系统调控的基因表达[10]。
不同菌体及不同QS系统的AIPs具有一定的差异,这种特异性主要是由氨基酸排列顺序的不同以及空间结构的差异决定[11]。因此,由AIPs介导的QS系统是细菌种内交流的一种方式。
1.2 革兰氏阴性菌QS系统
革兰氏阴性菌QS系统中最常见的自诱导因子是N-乙酰-L-高丝氨酸内酯(N-acyl homoserine lactones,AHLs)。不同菌种所产AHLs不同,其差异主要在于酰基侧链的长度与结构,而高丝氨酸内酯部分是相同的[12]。可见,由信号分子AHL介导的QS系统也主要用于细菌的种内交流。
AHLs通常是由AHLs合成酶LuxI型蛋白以S-腺苷蛋氨酸(S-adenosylmethionine,SAM)和酰化酰基载体蛋白(acylated acyl carrier protein,acyl-ACP)为底物合成的[12]。当AHLs的浓度达到一定阈值时,会与特异性受体结合并激活转录调控因子LuxR[13]。之后,LuxI-LuxR蛋白复合体与DNA的基因启动子区结合,从而触发QS系统调控的基因表达[14]。
1.3 革兰氏阳性菌和阴性菌共有的QS系统
革兰氏阳性菌和阴性菌共有的QS系统中的自诱导因子为AI-2。Winzer等[15]研究证实,细菌中产生AI-2的生物合成途径是高度保守的。一般情况下,SAM作为甲基供体,先被催化生成S-腺苷同型半胱氨酸(S-adenosylhomocysteine,SAH),然后通过pfs编码的S-腺苷同型半胱氨酸核苷酶(S-adenosylhomocysteine nucleosidase,SAH’ase)的作用迅速水解为腺嘌呤和S-核糖同型半胱氨酸(S-ribosylhomocysteine,SRH)。由luxS基因编码的S-核糖同型半胱氨酸酶将SRH转化为同型半胱氨酸和4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD),DPD会自发重新排列形成AI-2[16]。
在许多革兰氏阳性菌和阴性菌中都存在AI-2的生物合成基因luxS及其同源基因[17]。因此,信号分子AI-2可以用于细菌的种间交流。现已确定AI-2调控的细菌功能有毒力因子、白细胞毒素、铁获取、蛋白的表达、细菌的运动性、细胞分裂、DNA加工、菌血症感染、生物被膜形成和生物发光等[18]。
2 细菌QS系统对应激反应的影响
从分子水平上讲,细菌在面对环境胁迫时所表现出的应激反应是一个复杂的反应过程,其基因组中的多种基因都会参与其中[19]。例如,对变形链球菌的研究发现,温度升高时,有40种蛋白的表达量升高;而对培养基进行稀释会诱导58种蛋白的合成,另外有20种蛋白表达量降低[20]。研究细菌的应激反应,就是为了找出在此过程中发挥关键性作用的基因或蛋白,从而设法控制这些基因的表达或抑制相关蛋白质的活性,最终实现对细菌应激反应的控制[20]。通过研究细菌QS系统对应激反应的影响,可以为这些基因或蛋白的寻找提供新的途径。
2.1 几种常见致病菌的QS系统对应激反应的影响
2.1.1 霍乱弧菌
霍乱弧菌是革兰氏阴性菌,主要存在于水环境中,可引起霍乱。Yildiz等[21]研究发现,霍乱弧菌在水环境中的生存主要受RNA聚合酶Σ因子RpoS的调控,RpoS的高表达可以提高霍乱弧菌对氧化胁迫和低营养胁迫的耐受性。RpoS也被证明可以增加霍乱弧菌QS系统中中枢调节蛋白HapR的表达,该蛋白调控着许多与霍乱弧菌发病机制和环境生存有关的生理功能[22]。Joelsson等[23]进一步研究发现,霍乱弧菌的QS系统通过调节蛋白HapR上调了RpoS蛋白的表达量,并增强了霍乱弧菌在氧化胁迫下的应激反应。可见,QS系统中的HapR可以增强霍乱弧菌的应激反应,通过抑制HapR的活性可以降低霍乱弧菌的生存能力。
2.1.2 变形链球菌
变形链球菌是龋齿的主要病原体[24]。Wen等[25]对变形链球菌的研究发现,luxS缺陷菌株对酸胁迫的耐受性下降,但仍能进行酸适应。此外,Leung等[26]的研究表明,链球菌中存在由感受态刺激肽(competence-stimulating peptide,CSP)介导的QS系统,而CSP很可能是一种应激诱导信息素,通过触发对细菌群体的信号,启动适应性反应(图1)。CSP前肽由特定的ABC转运体ComAB加工并输出到细胞外环境中,SepM蛋白酶负责最后的出口后加工过程。当成熟CSP积累超过阈值浓度时,它与位于膜上的ComD受体结合,触发其自磷酸化,随后通过磷酸化激活同源细胞质反应调节剂ComE。尽管CSP和XIP信号通路之间的相互联系还不完全清楚,但有研究已经证明了由ComE直接调控的cipB基因对于激活SigX非常重要[27],而SigX可以提高细菌的应激能力。
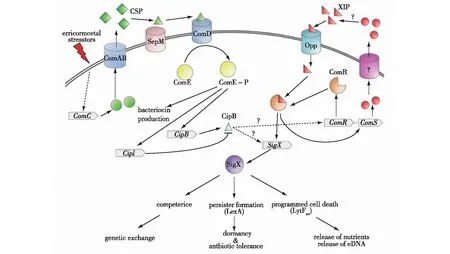
图1 变形链球菌中CSP介导的QS系统[26] Fig.1 CSP-mediated QS system in Streptococcus mutans[26]
Leung等[26]还证实,菌种通过CSP信息素的分泌来应对各种不利环境的胁迫,包括高温胁迫、氧化胁迫、酸胁迫和低营养胁迫,甚至可以用来应对抗生素的治疗。可见,luxS基因和CSP均可以作为降低变性链球菌应激反应的突破口。
2.1.3 大肠杆菌
致病性大肠杆菌是我国食源性疾病的主要病原体之一[28]。DeLisa等[29]对EscherichiacoliW3110的研究发现,Fe3+、NaCl和二硫苏糖醇(DTT)浓度的增加均会诱导该菌株所分泌的AI-2活性上调,这种上调是在种群密度和生长速率均未改变的情况下发生的。而一些环境胁迫(高温胁迫、乙醇、氧化胁迫、丝氨酸羟胺、乙酸钠、O2以及人白细胞介素-2过表达)不仅会导致AI-2活性下降,而且可能使AI-2发生降解或抑制AI-2的活性。
Park等[30]对肠道出血性大肠杆菌(EHEC)的研究得到一个有趣的结论,在渗透应激条件下,luxS缺陷突变株的生长率要高于野生型菌株,进一步研究发现,渗透应激使得野生型菌株细胞变形严重,细胞外膜的边界出现不清楚和不均匀(图2(a)),而luxS缺陷突变株的细胞则没有表现出外膜表面的损伤(图2(b)),当向luxS缺陷突变株中添加AI-2时,菌株的生长速率会降低,细胞变形加剧。这些结果都说明AI-2降低了EHEC对渗透胁迫的应激反应。这并非是个例,Wen等[25]对变形链球菌的研究也发现,luxS缺陷菌株对氧化应激的耐受性出现了上升趋势。这说明AI-2信号分子不仅可能会增强细菌的应激能力,对于某些菌株以及在特定的胁迫条件下,也会降低细菌的应激能力。

图2 电场发射扫描电子显微镜下的图像[30] Fig.2 Field emission scanning electron analysis (FE-SEM) image[30]
2.1.4 其他致病菌
桂萌[31]对维氏气单胞菌LP-11的研究发现,使用淬灭酶阻断菌株的QS系统后,细胞代谢活性下降,对于环境的适应力也随之下降。对哈氏弧菌的研究发现,QS系统调节蛋白LuxR激活了甘氨酸甜菜碱操纵子betIBA-proXWV,这增强了哈氏弧菌在渗透胁迫条件下的生长[32]。对溶藻弧菌的研究发现,在高温条件下,响应温度应激相关蛋白的表达量显著上调,而对于这些蛋白的调控依赖于QS系统的中枢调控蛋白LuxR[33]。对于哈氏弧菌和溶藻弧菌来说,LuxR蛋白均为提高其应激反应的关键性蛋白。
以上研究均表明,QS系统对所研究菌种的应激能力具有一定的调节作用。但也有实验表明了相反的观点,如Turovskiy等[34]对单增李斯特氏菌的研究发现,添加食品防腐剂乳酸链球菌素并不会导致AI-2活性上升,同时AI-2处理的细胞对传入的应激也没有更大的抵抗力。这说明AI-2诱导的QS系统对其应激能力的调节没有起到效果,然而单增李斯特氏菌中是否存在其他信号分子介导的QS系统对应激能力的调节机制还有待研究。
2.2 QS系统对乳酸菌应激反应的影响
乳酸菌是一类能从可发酵性碳水化合物产生大量乳酸的革兰氏阳性菌的统称,其既可以定居于肠道内维持肠道内环境的平衡,也可以应用于发酵工业中[35]。但不论是在人体肠道[36]或是在发酵食品的生产应用过程[37]中,乳酸菌往往都会经受各种环境胁迫,这就使提高乳酸菌的应激能力显得至关重要。
通过AI-2活性介导的QS系统在乳酸菌的酸性应激反应中具有明显的作用。Moslehi-Jenabian等[38]研究发现,在标准生长条件下,不同乳酸菌的AI-2活性水平似乎不同,但当暴露在酸胁迫环境时,AI-2活性增加,并且luxS基因的转录显著增加。Gu等[39-40]对菌种L.fermentum2-1和E.faecium8-3的研究同样发现,酸胁迫会导致AI-2活性增加,同时,酸胁迫还会导致luxS和pfs基因过度表达。
渗透压胁迫下,乳酸菌AI-2活性的变化出现了差异。Gu等[39-40]的研究还发现,随着渗透压的不断增大,AI-2的活性受到抑制。但Yeo等[41]的研究发现,他们实验用的4株乳酸菌的信号分子AI-2活性均随渗透压的增大而增大。这表明菌株对渗透压胁迫的应激反应存在菌株特异性。
可见,针对QS系统对乳酸菌应激反应影响的实验较少,相关研究仅仅表明环境胁迫使得QS系统信号分子AI-2的活性发生变化,并未说明这种产量变化会对乳酸菌的应激反应产生何种影响。QS系统对乳酸菌应激反应的具体作用及作用机制都有待研究。
3 总结与展望
细菌的应激反应提高了其在环境胁迫下的生存能力,研究细菌应激反应的影响因素不论对于致病菌还是益生菌都具有重要意义。细菌QS系统及其信号分子,为寻找在细菌应激反应过程中发挥关键性作用的蛋白及基因提供了一条新的途径,也为应对致病菌及益生菌对环境胁迫存在的应激反应提供了一种新方法。目前针对细菌QS系统对应激反应影响的相关研究主要集中在致病菌,乳酸菌的相关研究则很少。虽然细菌QS系统的多样性以及应激反应表现出的菌株特异性都为研究的开展设置了障碍,但相信随着相关研究的深入,这些难题都会迎刃而解。

