酵母菌对乳酸菌发酵特性及信号分子AI-2活性的影响
顾 悦,田建军,刘敏敏,李 博,张 悦,贺银凤
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
食品的发酵过程通常由多种微生物共同协作完成,微生物之间的相互作用决定了不同菌株的生产性能,最终影响发酵产品的风味、质地等特性。乳酸菌和酵母菌的共培养被广泛地应用在发酵饮料及食品的生产中[1-3],二者的共培养对发酵产品的风味特点、感官特性甚至发酵效率等方面都存在显著的促进作用[4-6]。除此之外,乳酸菌和酵母菌的混合培养同样有利于控制发酵食品中有害物质的含量以及降低致病菌的毒害作用。相比于乳酸菌的单菌发酵,混合培养还可以显著提高发酵产品的抗氧化特性[7]以及降低霉菌毒素的含量[8]。
群体感应(quorum sensing,QS)系统是细菌菌体间相互交流的重要机制,对细菌特定生理功能和基因的表达具有一定的调控作用[9]。其中,LuxS/AI-2 QS系统以自体诱导物-2(autoinducer 2,AI-2)作为信号分子介导种间信息的交流[10]。乳酸菌作为食品发酵过程中的主要微生物,其多种生理功能均受到LuxS/AI-2 QS系统的调控,例如生物膜的形成[11]、对宿主肠道细胞的黏附以及降低致病菌对宿主细胞的侵袭[12]等。
随着对LuxS/AI-2 QS系统研究的不断深入,发现QS系统在细菌共培养的过程中也发挥着重要的作用。不同乳酸菌菌株共培养时LuxS蛋白的表达水平发生显著改变[13],同时,乳酸菌还可以影响其他共培养菌株的信号分子AI-2的分泌[14]。但是,酵母菌作为与乳酸菌具有复杂互作关系的微生物之一,其对乳酸菌信号分子AI-2活性及LuxS/AI-2 QS系统影响的研究还相对较少。
本实验中,笔者以酸马奶酒中分离得到的一组乳酸菌和酵母菌组合为研究对象,探究酵母菌对乳酸菌生长的影响,同时分析共培养对乳酸菌发酵特性以及信号分子AI-2活性产生的影响,以期为深入研究乳酸菌和酵母菌混合发酵时LuxS/AI-2 QS系统的调控作用奠定理论基础。
1 材料与方法
1.1 菌株、培养基和试剂
Enterococcusfaecium8-3、SaccharomycescerevisiaeJ8,由内蒙古农业大学“内蒙古传统发酵乳制品中乳酸菌和酵母菌共生机理的研究”课题组提供;VibrioharveyiBB170,美国典型微生物菌种保藏中心(ATCC)(BAA-1117)。
脱脂乳培养基、MRS培养基、YEPD培养基、AB培养基根据文献[15-18]配制。实验中所用试剂均为市售国产分析纯。
1.2 仪器与设备
BCN-1360型生物超净工作台,哈尔滨市东联电子技术开发有限公司;HSP-250型生化培养箱,上海一恒科学仪器有限公司;高速冷冻离心机,美国Eppendorf公司;Scientific Multiskan FC酶标仪,美国Thermo公司;Perkin Elmer victor X 酶标仪酶标仪,美国Perkin Elmer公司;GC-9A型气相色谱仪、20-AT型高效液相色谱仪,日本岛津公司;820型荧光分光光度计,日本日立公司。
1.3 方法
1.3.1 无细胞发酵上清液(CFS)的制备
将S.cerevisiaeJ8在YEPD培养基中活化2代,按2%(体积分数)接种3代,30 ℃振荡培养70 h,收集发酵液,4 000 r/min离心20 min。收集上清液并调pH至6.5±0.2,再经0.45 μm滤菌器过滤除菌,得到酵母菌无细胞发酵上清液(CFS)作为酵母菌代谢产物,于-80 ℃保存。
1.3.2 酵母菌对乳酸菌生长的影响
将E.faecium8-3和S.cerevisiaeJ8分别在MRS培养基和YEPD培养基中活化2代,活化后的E.faecium8-3和S.cerevisiaeJ8以体积比9∶ 1进行混合,按2%接种量接入脱脂乳培养基,30 ℃振荡培养12 h,然后37 ℃静置培养24 h作为共培养实验组,E.faecium8-3单菌培养作为对照组。0~36 h的培养过程中,每4 h测定E.faecium8-3活菌数,以每毫升发酵液中的菌落数来计算。
1.3.3 酵母菌对乳酸菌发酵特性的影响
1)酵母菌对乳酸菌产游离氨基氮的影响。将E.faecium8-3和S.cerevisiaeJ8共培养,0~36 h内,每4 h收集实验组和对照组的发酵液,采用邻苯二甲醛衍生比色法[19]测定游离氨基氮(FAN)的含量。
2)酵母菌对乳酸菌产挥发性有机酸含量的影响。使用气相色谱法分别测定共培养实验组和对照组中乳酸、甲酸、乙酸、丙酸、丁酸、戊酸和异戊酸的含量。气相色谱条件:色谱柱为柱长2 m、内径3 mm的不锈钢柱,固定相为15%的邻苯二甲酸二壬酯与5%的吐温-80混合固定液,担体为Chromosorb HP(80-100 mesh),温度为柱温100 ℃、检测器及汽化室温度为150 ℃,气体流速为载气(N2)30 mL/min、H250 mL/min、空气500 mL/min,灵敏度为102,进样量为1 μL, 纸速为2 mm/min[20]。
3)酵母菌对乳酸菌产不挥发性有机酸的影响。使用高效液相色谱法分别测定实验组和对照组中苹果酸、酒石酸及柠檬酸的含量。高效液相色谱条件:色谱柱为C18柱、4.6 mm×150 mm,流动相为0.01 mol/L (NH4)2HPO4,用1 mol/L磷酸调pH至2.7,临用前使用超声波脱气,流速为1 mL/min,进样量为20 μL。使用高效液相色谱法进行分离,于210 nm处进行紫外检测,用峰面积标准曲线对有机酸的含量进行计算[21]。
4)酵母菌对乙醛含量的影响。将实验组和对照组中待测样品与等体积16%三氯乙酸(TCA)溶液进行混合,3 500 r/min离心10 min,收集上清液备用。将5 mL NaHSO3(10 g/L)与25 mL待测上清液进行混合,室温静置1 h后,加入10 g/L的淀粉溶液1 mL,使用0.1 mol/L碘液滴至接近终点,再用0.01 mol/L的碘液滴至终点。再加入20 mL 1.0 mol/L的NaHSO3,振荡混匀,用0.01 mol/L碘标准溶液滴定至终点,消耗标准碘液体积记为V1,空白实验消耗碘液体积记为V2[22]。乙醛含量的计算:乙醛含量=(V1-V2)×标准溶液的浓度×0.22/25。
5)酵母菌对乳酸菌产丁二酮的影响。将实验组和对照组中待测样品与等体积16%TCA溶液进行混合,3 500 r/min离心10 min,收集上清液备用。分别取处理后的上清液10 mL与0.5 mL和0 mL的1%邻苯二胺溶液进行充分混合,黑暗处静置30 min后,分别加入2 mL和2.5 mL 4 mol/L 的HCl溶液,混合均匀。以添加0 mL 1%邻苯二胺的溶液作为参比液,于335 nm处测定吸光度值。将丁二酮浓度作为横坐标,吸光度值作为纵坐标绘制标准曲线[22]。
6)酵母菌对乳酸菌产维生素的影响。采用荧光法测定实验组和对照组中维生素的含量。其中,维生素A(VA)和维生素E(VE)参照文献[23]、维生素B1(VB1)参照文献[24]、维生素B2(VB2)参照文献[25]测定,以每100 g发酵液中维生素的含量计算。
1.3.4 酵母菌对乳酸菌信号分子AI-2活性的影响
将E.faecium8-3和S.cerevisiaeJ8进行共培养,共培养组作为实验组,E.faecium8-3单菌培养作为对照组。在4~37 h的培养过程中,每隔3 h取发酵液制备CFS。利用V.harveyiBB170的生物学方法对实验组CFS、对照组CFS以及S.cerevisiaeJ8 CFS中信号分子AI-2的活性进行测定[26]。
2 结果与讨论
2.1 酵母菌对乳酸菌菌株生长的影响结果
S.cerevisiaeJ8对E.faecium8-3活菌数的影响结果见图1。
由图1可知:当E.faecium8-3和S.cerevisiaeJ8菌体共培养时,0~12 h时,对照组的活菌数高于实验组,这可能是因为此时振荡培养更有利于S.cerevisiaeJ8的生长。16~40 h时,实验组的活菌数高于对照组,因此,S.cerevisiaeJ8对E.faecium8-3的生长具有一定的促进作用。
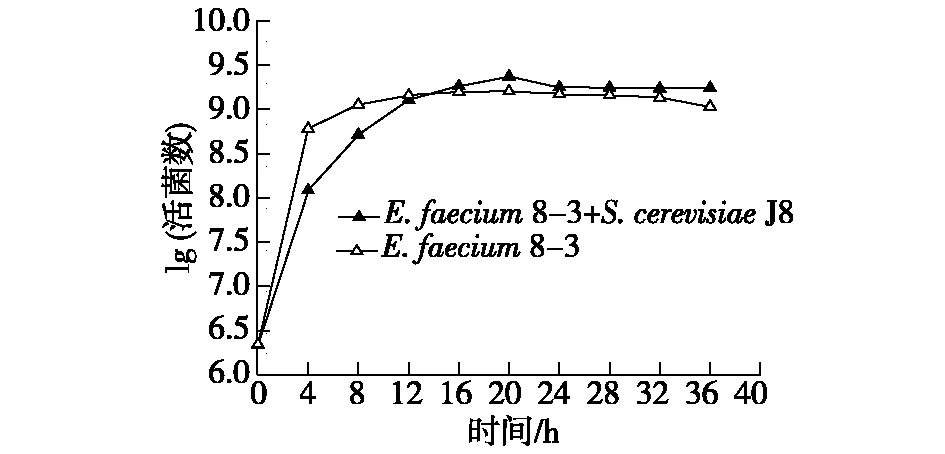
图1 酿酒酵母J8对屎肠球菌8-3活菌数的影响 Fig.1 Effects of S. cerevisiae J8 on viable counts of E .faecium 8-3
2.2 酵母菌对乳酸菌发酵特性的影响结果
2.2.1 酵母菌对乳酸菌产游离氨基氮的影响结果
E.faecium8-3和S.cerevisiaeJ8共培养对发酵液中游离氨基氮含量的影响结果如图2所示。游离氨基氮主要是由蛋白质降解形成的氨基酸和小分子量的短肽组成。

*表示差异显著,P<0.05图2 酿酒酵母J8对游离氨基氮浓度的影响 Fig.2 Effects of S. cerevisiae J8 on free amino nitrogen content
由图2可知:与E.faecium8-3单菌培养相比,S.cerevisiaeJ8的添加对发酵液游离氨基氮的含量产生一定影响。在0~36 h的培养过程中,E.faecium8-3单菌培养的发酵液中游离氨基氮的含量在0~4 h时呈下降趋势,之后呈上升趋势且在20 h时达到10.8 mmol/L。添加S.cerevisiaeJ8后,发酵液中游离氨基氮的含量在0~12 h呈上升趋势且在12 h达到12.1 mmol/L。同时,在4、12和16 h时,共培养菌株的发酵液中游离氨基氮的含量显著高于E.faecium8-3单菌培养时的含量。以上结果说明,E.faecium8-3和S.cerevisiaeJ8共培养可以提高发酵液中游离氨基氮的最高含量并缩短最高游离氨基氮的产生时间。
2.2.2 酵母菌对挥发性有机酸含量的影响结果
发酵乳制品中有机酸主要是通过乳酸菌代谢产生,E.faecium8-3和S.cerevisiaeJ8共培养对发酵液中挥发性有机酸含量的影响结果如图3所示。
由图3可知:发酵液中测定的挥发性有机酸有乳酸、甲酸、乙酸、丙酸、丁酸、戊酸和异戊酸,在12~36 h的培养过程中,实验组和对照组中乳酸的含量均呈上升趋势,在12 h时,S.cerevisiaeJ8明显降低了发酵液中乳酸的含量,但在24 h和36 h时无明显影响。同时,在36 h时,实验组中乳酸为15.302 g/L,对照组中乳酸为15.126 g/L。结果说明,当环境中存在S.cerevisiaeJ8时会降低发酵液中乳酸产生的速率,但对乳酸的最高生成量无影响。
实验组中甲酸质量浓度呈先上升后下降的趋势并在24 h达到1.503 mg/L,而对照组中甲酸含量一直呈上升趋势并在36 h到达1.681 mg/L。在36 h时,实验组中甲酸的量急剧下降(0.230 mg/L),比对照组有明显的降低。与乳酸和甲酸相比,在12~36 h的培养过程中,实验组和对照组中乙酸含量的变化相对较小,S.cerevisiaeJ8的添加没有改变乙酸含量的变化规律。
在12~24 h的培养过程中,实验组中丙酸的含量高于对照组,当培养时间达到36 h时,实验组和对照组中丙酸的含量无明显差异,说明S.cerevisiaeJ8的添加会提高丙酸的生成速率,但对其最高生成量无影响。在实验组和对照组中,丁酸含量的变化基本保持一致,在12~36 h时基本保持稳定,36 h时实验组中丁酸为0.118 mg/L,而对照组中为0.120 mg/L,说明S.cerevisiaeJ8对E.faecium8-3发酵产丁酸无明显影响。
在12 h和36 h时,实验组中戊酸含量比对照组相对较低,在24 h时,实验组中戊酸的含量比对照组相对较高,且实验组组戊酸质量浓度在24 h达到0.351 mg/L,对照组在36 h时戊酸质量浓度达到0.411 mg/L。实验组中异戊酸的质量浓度在12 h时基本达到最高值并在12~36 h的培养过程中基本保持稳定,且其最大生成量为0.546 mg/L,而对照组中异戊酸的含量随培养时间的延长呈上升趋势并在36 h达到最大值(0.588 mg/L),结果说明S.cerevisiaeJ8可以提高E.faecium8-3发酵产异戊酸的速率。

图3 酿酒酵母J8对挥发性有机酸产量的影响 Fig.3 Effects of S. cerevisiae J8 on volatile organic acids content
因此,通过比较实验组和对照组中挥发性有机酸含量的变化可知:S.cerevisiaeJ8会降低E.faecium8-3产乳酸的速率,但对其乳酸最大生成量无明显影响,同时,可明显降低36 h时甲酸和戊酸的含量;S.cerevisiaeJ8可以提高E.faecium8-3发酵产丙酸和异戊酸的速率,但是,对乙酸和丁酸含量的变化无明显的作用。
2.2.3 酵母菌对不挥发性有机酸含量的影响结果
E.faecium8-3和S.cerevisiaeJ8共培养对发酵液中不挥发性有机酸含量的影响结果如图4所示。
由图4可知:发酵液中测定的不挥发性有机酸有苹果酸、酒石酸和柠檬酸。在0~12 h的培养过程中,实验组中3种不挥发性有机酸的形成速率比对照组有所降低,这可能是由于在0~12 h时的培养环境更有利于S.cerevisiaeJ8的生长代谢,而不利于E.faecium8-3的生长,所以3种酸的生成速率有所下降。在12~36 h的培养过程中,实验组中3种不挥发性有机酸的含量均随培养时间的延长呈上升的趋势,而对照组中有机酸的含量随培养时间的延长呈下降趋势,在36 h时,实验组中3种不挥发性有机酸的含量均高于对照组。同时,由对照组中3种酸含量的变化趋势可知,E.faecium8-3在培养代谢的过程中可能会转化部分酸,使得3种酸含量降低。

图4 酿酒酵母J8对不挥发性有机酸含量的影响 Fig.4 Effects of S. cerevisiae J8 on nonvolatile organic acids content
通过比较实验组和对照组中不挥发性有机酸含量的变化可知,S.cerevisiaeJ8会降低E.faecium8-3在0~12 h时不挥发性的生成速率,但是却可以提高36 h时3种酸的最大生成量,对苹果酸、酒石酸和柠檬酸的形成有促进作用。
2.2.4 酵母菌对乙醛和丁二酮含量的影响
在乳制品的发酵过程中,乳酸菌分解基质物质,除形成乳酸、乙酸等有机酸类风味物质外,还可以通过代谢产生乙醛、丁二酮和3-羟基丁酮等物质,而这些都是酸乳的风味物质。E.faecium8-3和S.cerevisiaeJ8共培养对发酵液中乙醛和丁二酮含量的影响,结果如图5所示。
由图5可知:实验组和对照组中乙醛和丁二酮的含量均随培养时间的延长而不断增加,但二者的变化规律略有差异。
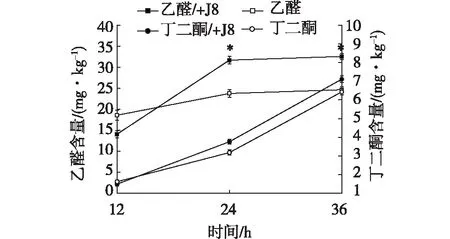
*表示差异显著,P<0.05图5 酿酒酵母J8对乙醛和丁二酮质量浓度的影响 Fig.5 Effects of S. cerevisiae J8 on acetaldehyde and butanedione content
在12 h时,实验组中乙醛的含量明显低于对照组,这可能是因为此时的培养条件更适宜S.cerevisiaeJ8生长,因此,培养环境影响了E.faecium8-3的生长和代谢。但随着培养时间的延长,实验组中乙醛含量迅速增加且均显著高于对照组,在36 h时,实验组和对照组中的乙醛分别可达32.56和24.64 mg/mL,说明当E.faecium8-3和S.cerevisiaeJ8共培养时可以促进E.faecium8-3代谢产乙醛。
在12~36 h的培养过程中,实验组和对照组中丁二酮的含量差异不显著,因此,当E.faecium8-3和S.cerevisiaeJ8共培养时对E.faecium8-3代谢产丁二酮无显著影响。这可能是因为丁二酮主要通过乳酸菌的柠檬酸代谢途径产生[27],而脱脂乳中柠檬酸的含量相对较少,因此对E.faecium8-3单菌培养、与S.cerevisiaeJ8共培养产丁二酮的影响较小。
2.2.5 酵母菌对维生素含量的影响结果
在36 h时,E.faecium8-3和S.cerevisiaeJ8共培养对发酵液中维生素含量的影响,结果如图6所示。
由图6可知:发酵液中测定的维生素有脂溶性维素VA和VE以及水溶性维生素VB1和VB2。实验组中4种维生素的含量均低于对照组,说明S.cerevisiaeJ8和E.faecium8-3共培养会降低发酵乳中VA、VE、VB1和VB2的含量,这可能是因为在乳酸菌和酵母菌共培养的过程中存在代谢产物的相互利用及降解作用。
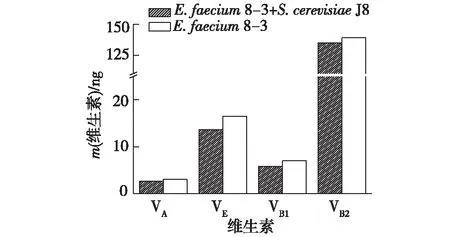
图6 酿酒酵母J8对维生素含量的影响 Fig.6 Effects of S. cerevisiae J8 on vitamin content
2.3 酵母菌对信号分子AI-2活性的影响结果
2.3.1 酵母菌代谢产物信号分子AI-2活性检测
检测S.cerevisiaeJ8 CFS的相对荧光强度,结果如表1所示。
由表1可知:S.cerevisiaeJ8 CFS的相对荧光强度与介质对照的相对荧光强度无显著差异,说明S.cerevisiaeJ8的代谢产物中不含有信号分子AI-2。因此,排除了酵母菌可能分泌信号分子AI-2对E.faecium8-3造成的影响。

表1 酿酒酵母J8 CFS的相对荧光强度
2.3.2 酵母菌对信号分子AI-2活性的影响
E.faecium8-3和S.cerevisiaeJ8共培养对乳酸菌信号分子AI-2活性的影响,结果如图7所示。
由图7可知:当E.faecium8-3与S.cerevisiaeJ8共培养时,除34 h外,其余培养时间E.faecium8-3信号分子AI-2的活性均有所下降,且呈现显著或极显著的抑制作用,这可能是由于S.cerevisiaeJ8大量繁殖,培养基中营养物质消耗迅速,使得E.faecium8-3分泌信号分子AI-2的能力下降。此结果说明,当S.cerevisiaeJ8与E.faecium8-3共培养时会抑制其信号分子AI-2的分泌。
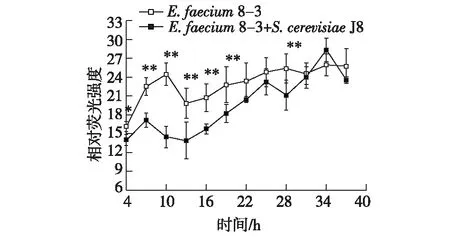
*表示差异显著,P<0.05;**表示差异极显著,P<0.01图7 酿酒酵母J8对屎肠球菌8-3信号分子 AI-2活性的影响 Fig.7 Effects of S. cerevisiae J8 on AI-2 activity of E. faecium 8-3
2.4 讨论
2.4.1 乳酸菌和酵母菌共培养对发酵产物的影响
乳酸菌和酵母菌在共培养的过程中形成了稳定的互作关系,二者的共培养对发酵产品中多种物质的含量都产生了一定的影响。氨基酸态氮的含量可以作为评判发酵程度的指标之一,实验中S.cerevisiaeJ8可以提高发酵液中游离氨基氮的最高含量并缩短最高游离氨基氮的产生时间,这可能是因为二者共培养后乳酸菌可以分泌更多的蛋白酶,这些酶类物质可以将蛋白质水解为氨基酸和肽类,进而增加了游离氨基氮的含量[28]。有机酸的含量会影响产品的酸性口感,乳酸菌可以通过戊糖磷酸途径产生乳酸和乙酸,S.cerevisiaeJ8会降低E.faecium8-3产乳酸的速率和甲酸、戊酸的含量,但可以提高丙酸和异戊酸的生成速率,对乙酸和丁酸含量的变化无明显的作用,这可能是由于S.cerevisiaeJ8对不同有机酸的利用存在差异。利用高效液相色法对发酵乳中有机酸的含量进行测定,结果显示,乳酸含量显著高于乙酸、柠檬酸等,这也与田辉等[29]结果相同。龙兴瑶等[28]对藏灵菇牦牛酸乳发酵过程中的有机酸含量进行测定,结果发现,乙酸和柠檬酸的含量均随发酵时间的延长而减少,这是因为柠檬酸是许多风味物质的前体物,在酸乳发酵后期柠檬酸可以转化成其他风味物质,导致柠檬酸的含量下降[30]。但在本实验中,乙酸和柠檬酸的含量随发酵时间的延长均未下降,这可能是由于酵母菌促进了乳酸菌有机酸的形成,使其形成与风味物质的转化保持同步水平。
乳酸菌利用苏氨酸可以生成乙醛,是酸奶制品形成特殊风味的主要物质,由于乳酸菌水解脂肪酸和蛋白质的能力有限,因而,大部分的必需氨基酸都是从牛乳中获取[31-32]。酵母菌分解基质物质能够分泌苏氨酸,因此,当乳酸菌和酵母菌共培养时可能会提高乙醛的生成量[33],这也与本实验的结果相一致,Gadaga等[34]的研究也有类似的结果。维生素是许多活性酶类的辅酶,可以调节多种物质的代谢过程。S.cerevisiaeJ8和E.faecium8-3共培养会降低发酵乳中VA、VE、VB1和VB2的含量,这可能是由于酵母菌的多种生理代谢均与维生素有关,进而影响了维生素的含量。
2.4.2 酵母菌对乳酸菌信号分子AI-2活性的影响
早期对乳酸菌和酵母菌互作机制的研究主要是在营养方面,二者可以利用彼此的代谢产物影响自身的生长及代谢。随着QS的发现,环境中乳酸菌分泌的信号分子是否会影响菌株间的交流还不得而知。E.faecium8-3和S.cerevisiaeJ8共培养时,其信号分子AI-2的活性会受到显著抑制,这可能是由于酵母菌与乳酸菌共培养改变了培养环境中的pH、营养条件等,不同的培养环境会对乳酸菌信号分子AI-2的活性产生影响[35]。廉雪花[36]在对乳酸菌和酵母菌共培养过程中信号分子AI-2活性进行研究时发现,克鲁克酵母 J6、厚壁孢酵母 J23-1、有孢圆酵母 J11的代谢产物在一定培养时间内也对E.faecium8-3信号分子AI-2的产生有促进作用。燕彩玲[37]的研究结果显示,不同乳酸菌和酵母菌组合对信号分子AI-2活性的影响具有一定的差异性。
3 结论
S.cerevisiaeJ8可以促进E.faecium8-3的生长,同时,二者共培养可以提高发酵乳中游离氨基氮、苹果酸、酒石酸、柠檬酸和乙醛的含量,并提高乳酸、丙酸和异戊酸的生成速率,降低甲酸、戊酸和维生素的含量,但对乙酸、丁酸和丁二醛的影响较小。同时,S.cerevisiaeJ8对信号分子AI-2的活性会产生一定影响,S.cerevisiaeJ8和E.faecium8-3共培养极显著抑制信号分子AI-2的分泌,因此,S.cerevisiaeJ8和E.faecium8-3共培养会影响乳酸菌的LuxS/AI-2群体感应系统。

