水产品腐败菌群体感应系统及群体感应抑制剂研究进展
丁 婷,李婷婷,王当丰,梅永超,赫彬彬,高娜娜,杨亚茹,孙晓嘉,励建荣,
(1. 江南大学食品学院,江苏无锡214122; 2. 大连民族学院生命科学学院,辽宁大连116600;3. 渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁锦州121013)
水产品营养丰富,低脂肪、高蛋白、营养平衡性好,深受消费者的喜爱[1]。近年来,我国对水产品的需求量不断增加,消费者也对水产品感官品质、营养价值和安全性的要求越来越高。由于水产品水分含量高、不饱和脂肪酸易氧化、pH偏中性、肌肉组织疏松、结缔组织含量低以及存在自溶酶等因素,水产品在收获、运输、加工和贮藏过程中极易发生腐败,造成大量经济损失[2]。微生物是引起食品腐败变质的主要原因,也是影响水产品货架期的最主要因素,约30%的捕获鱼类是由于微生物单独因素导致损失的[3]。在水产品腐败过程中,通常只有一种或几种主要的微生物起主要作用,这些细菌就是特定腐败菌(specific spoilage organisms,SSOs)。虽然SSOs通常以极低的数量存在,但它们的生长速度比其他微生物快且致腐能力强[4]。它们能够将水产品中的含氮物质(如氨基酸和蛋白质)分解成胺、硫化物、醇、酮、醛和有机酸等物质,产生令人难以接受的异味,致使水产品腐败[5]。研究表明,新鲜水产品的微生物种群一般由嗜冷的革兰氏阴性棒状细菌和革兰氏阳性细菌组成[6]。在冷藏好氧条件下储存的水产品的SSO多为假单胞菌属(Pseudomomasspp.)和希瓦氏菌属(Shewanellaspp.)[7],而发光杆菌属的Photobacteriumbeijerinck多为鱼类和虾类的主要腐败微生物[8-9]。
随着研究的深入,人们发现细菌之间存在一种信息交流机制,称为群体感应(quorum sensing,QS)或细胞密度依赖的基因表达(cell density dependent control of gene expression),其主要依赖于小分子的自体诱导物(autoinducers,AIs)的生成、分泌和响应,以激活或抑制特定的靶基因表达,从而调控细菌中的各种生理过程,包括共生、发光、细胞胞外酶的产生、质粒转移、毒力因子表达、抗生素合成和生物被膜形成等[10-13]。腐败菌的一些腐败特性,如胞外蛋白酶的产生、生物被膜、黏液的分泌等也受到QS系统的调控[14]。
本文中,笔者重点探究导致水产品腐败变质的微生物QS系统及其致腐机制,寻找群体感应抑制剂(quorum sensing inhibitors,QSI)来干扰或破坏其参与调控的生物学功能,可阻断依赖QS的细菌侵染,为解决细菌耐药性、控制水产品品质变化、延长水产品的货架期提供新的途径。
1 微生物的QS机制
QS是一种细菌间的通讯机制,也是细菌根据自身群体密度来调整其生理和生化特性的过程。因此,QS机制也被认为是一种允许细菌像多细胞生物一样表现其生物学功能的机制[15]。细菌能够产生、释放和识别被称为自诱导物的胞外信号分子,其随着细菌细胞密度的增加而累积,一旦达到阈值浓度,就会引起特定基因表达,进而引起多种细菌群体性行为,如生物发光、遗传物质交换、生物被膜的产生等[16]。微生物在自然界为抵御环境压力所产生的生物被膜,会黏附于在食品加工设备表面、传送带和容器内,造成食品腐败,且成熟的生物被膜是一种复杂的胞外聚合物,较难清除彻底。腐败菌和食源性病原菌产生的毒素,也会引起食物中毒[17-19]。因此,控制食品中各种病原菌的污染,特别是防止其形成生物被膜交叉污染食品,可有效控制食源性疾病的发生。目前,通过调控基于细菌QS系统的生物被膜相关基因的表达,进而抑制其形成已成为研究的热点。
由于细菌的QS现象主要依赖于多样性的信号分子实现,因此常以信号分子种类对QS系统进行命名和分类,如图1所示。

(a)N-酰基高丝氨酸内酯(AHL);(b)N-3-羟基酰基-高丝氨酸内酯;(c)N-(3-氧代酰基)-1-高丝氨酸内酯;(d)呋喃糖基硼酸二酯(AI-2);(e)喹诺酮信号(PQS);(f)扩散信号因子(DSF);(g)羟基-棕榈酸甲酯(PAME);(h)金黄色葡萄球菌自诱导肽1(AIP-1)图1 革兰氏阴性菌和革兰氏阳性菌的信号分子分类 Fig.1 QS signals of gram-negative and gram-positive bacteria
由图1可见:目前研究较多的主要有革兰氏阴性菌中高丝氨酸内酯类(N-acyl-L-homoserine lactones,AHLs)介导的AI-1型QS系统;革兰氏阳性菌中由寡肽(autoinducing peptides,AIP)介导的AI-3型QS系统;由呋喃硼酸二酯类(autoinducer-2,AI-2)介导的种间(内)信息交流的AI-2型QS系统。此外,其他类型信号分子还包括喹诺酮类信号分子PQS、扩散信号因子DSF、羟基-棕榈酸甲酯PAME等[20]。
1.1 AI-1型QS系统
AHLs介导的AI-1型QS系统,也被称为LuxI/R型QS系统,是人们最早发现的一类QS系统[21]。目前,已经在近100种革兰氏阴性细菌中发现,也是人们研究最为广泛和深入的一类QS系统[22]。该系统主要由luxI/R调控基因组成,其中luxI表达信号分子合成酶,在其催化作用下,S-腺苷甲硫氨酸(SAM)的氨基与酰基载体蛋白(ACP)结合的酰基衍生物相互作用,使SAM 的氨基酰化,随着分子内的亲核取代,甲硫蛋氨酸脱去,最终生成信号分子AHL;而luxR表达转录激活因子(图2)。研究显示,该转录蛋白结构存在2个主要功能域,即信号分子结合域(ligand-binding domain,LBD)和靶基因结合域(DNA-binding domain,DBD)。通常信号分子结合LBD,使其形成AI-LuxR复合蛋白,随后DBD暴露,并与下游靶基因启动子结合,开启基因转录,表达相应的生物性状[23]。如铜绿假单胞菌可以产生2种AHL分子3-oxo-C12-HSL和C4-HSL,它们与各自对应的转录调节子LasR和RhlR结合。其中,形成的RhlR-AI复合物可直接开启下游毒力基因表达,而LasR-A1复合物则通过激活下游调节因子RhlR和RhlI来实现调控目的[24]。目前,在水产品腐败菌领域,研究人员在荧光假单胞菌(Pseudomonasfluorescens)、温和气单胞菌(Aeromonassobria)、蜂房哈夫尼亚菌(Hafniaalvei)等菌中均发现了基于LuxR型转录子调控的QS系统。2018年,王飞飞[25]报道了二酮哌嗪(DKP)-LuxR型QS系统对大黄鱼特定腐败菌Shewananllabaltica致腐能力的调控,并首次在体外模拟了AI与LuxR蛋白的结合过程。这为确定LuxR型QS系统作为水产品防腐保鲜的靶点,提供了有力证据。
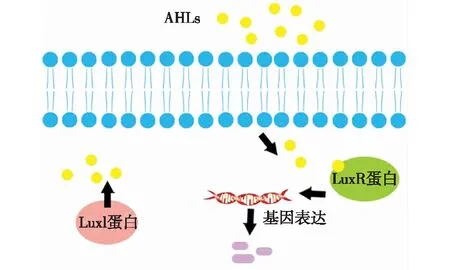
图2 革兰氏阴性菌中LuxI/LuxR群体感应模式 Fig.2 LuxI/LuxR quorum sensing circuit in gram-negative bacteria
1.2 AI-2型QS系统
呋喃硼酸二酯类介导的AI-2型QS系统在革兰氏阴性菌和阳性菌中分布广泛(500多种细菌)[26],且由于AI-2可以同时被不同种间微生物的受体识别,因此被认为是细菌进行种间(内)信息交流的通用机制。AI-2信号分子也被形象地称为是细菌间进行交流的“通用语言”。该系统中关键的调控基因被认为是luxS型基因,AI合成途径通常如下(图3):S-腺苷高半胱氨酸(SAH)作为S-腺苷甲硫氨酸(SAM)的中间体,由S-腺苷高半胱氨酸核苷酸酶(Pfs)催化产生S-核糖高同型半胱氨酸(SRH)。随后,LuxS酶将SRH转化为AI-2的前体物4,5-二羟基2,3-戊二酮(DPD)和高半胱氨酸。最终,由于 DPD不稳定,其自发环化形成信号分子AI-2[27]。
在水产品腐败菌中,目前对AI-2型群体感应系统调控机制的理解还多集中于单一菌株,如波罗的海希瓦氏菌(Shewanellabaltica)和腐败希瓦氏菌(Shewanellaputrefaciens)。叶晓峰[28]构建了波罗的海希瓦氏菌的luxS基因缺失突变株,通过与野生株比较发现,其具有减弱菌株生物被膜形成和迁移的能力,但不影响致腐表型的表达。而朱素芹[29]发现,外源添加A1-2的前体物质DPD可以延长腐败微生物的延滞期,降低其生长速率,减缓对虾腐败。因此,AI-2群体感应系统在水产品腐败进程中的作用还有待进一步探索。

图3 细菌中AI-2的合成途径 Fig.3 AI-2 synthesis route in bacteria
1.3 AI-3型QS系统
QS信号分子还有其他种类,如在肠出血性大肠杆菌中还发现能调控毒性蛋白释放以及运动性的AI-3型信号分子[30]。AI-3型QS系统比前两种系统调控过程更为复杂。
1.4 革兰氏阳性菌QS系统
AIP介导的QS系统是革兰氏阳性细菌交流的主要方式。作为信号分子的AIP,通常由氨基酸残基数为5~10的环状寡肽经修饰后组成,由ABC转运蛋白(ATP binding cassette exporter protein)运输至胞外,其信号识别由双组分磷酸激酶系统实现[31]。随着细菌密度增加,AIP在环境中累积到一定的阈值后,AIP与受体激酶结合,其组氨酸残基上的激酶活性开启,使受体磷酸化。随后,被激活的受体激酶与胞内应答调节子的天冬氨酸残基结合,使之磷酸化并被激活。最终,活化的应答调节子通过调控AIP基因、受体激酶、应答调节子基因以及ABC转运蛋白基因的转录,来实现QS系统[32]。目前该系统的研究多集中于金黄色葡萄球菌等致病菌,对于水产腐败菌的研究较少,因此对于水产品腐败菌的QS系统有待于进一步研究。
2 水产品中腐败菌的群体感应现象
腐败菌的代谢产物引起的不良气味和味道是导致水产品鲜度下降和感官不可接受的主要因素。研究表明,低温冷藏鱼类的主要腐败菌有腐败希瓦氏菌(Shewanellaputrefaciens)、热杀索氏菌(Brochothrixthermosphacta)、假单胞菌属(Pseudomonasspp.)、气单胞菌属(Aeromonasspp.)和乳酸菌(lactic acid bacteria)等[33]。
近年来,对于特定腐败菌群体感应系统的研究已在水产品保鲜领域广泛开展。希瓦氏菌(Shewanellabaltica)是水产品中常见的腐败菌。希瓦氏菌为革兰氏阴性嗜冷菌,能产生H2S,具有还原氧化三甲胺为三甲胺及产生多种生物胺的能力,是大黄鱼等富含蛋白类水产品在冷藏过程中的特定腐败菌[34-35]。通过对希瓦氏菌的群体感应系统及其与水产品腐败之间的联系进行研究发现,在希瓦氏菌所分泌的AI-2型及4种二酮哌嗪类化合物DKPs(diketopiperazines)活性信号分子中,仅cyclo-(L-Phe-L-Leu)能够促进水产品的腐败[36-38]。为阐明希瓦氏菌的致腐机制,Fu等[39]通过对2株希瓦氏菌的全基因组进行测定分析,发现了3个受QS调控的致腐基因,即torT、cysM和trxB,而通过蛋白质序列比对和三维蛋白质结构模拟发现,TorT半胱氨酸合酶B的C端和N端以及硫氧还蛋白还原酶146~160位的氨基酸在2株菌株中差异较大,通过荧光定量PCR 测定这2株希瓦氏菌中腐败基因的表达水平,结果发现在较强的腐败菌株中,torT和cysM的表达水平较高。TorT作为氧化三甲胺(TMAO)受体,能够支配Tor呼吸系统的触发。在与TMAO结合后,TorT保护组氨酸激酶TorS降解并因此导致响应调节物TorR磷酸化,其随后诱导下游torCAD操纵子转录和功能性TMAO还原酶表达,其最终将TMAO脱氧还原成TMA,产生腥臭味。
荧光假单胞菌(Pseudomonasfluorescens)是一种典型的革兰氏阴性腐败菌,广泛存在于生鱼(特别是寿司或生鱼片)、肉类、乳制品以及新鲜蔬菜中。笔者所在课题组Li等[40]研究表明荧光假单胞菌的腐败特性如胞外蛋白酶、生物被膜产生等均受QS的调控,且当其处于不利环境时,荧光单胞菌可刺激并激活自身群体感应系统以维持自身生长。Liu等[41]研究发现,在荧光假单胞菌中,RpoS因子能够调节其AHLs的合成,并通过比较荧光假单胞菌RpoS缺失株与野生株在不同环境胁迫下的耐受能力,证明了RpoS是调节荧光假单胞菌QS致腐能力的主要调控因子。
气单胞菌属是冷藏水产品的特定腐败菌。嗜水气单胞菌(Aeromonashydrophila)属弧菌科,能导致鱼类的出血性败血症,是水产品较常见的致病菌和腐败菌[42-43]。嗜水气单胞菌可产生多种致腐因子,包括外毒素、胞外蛋白酶、生物膜和脂多糖等,且这些致腐因子均受到嗜水气单胞菌QS系统的调控。当外界环境变化时,嗜水气单胞菌能启动相关基因的表达来适应环境对QS系统造成的影响,进而达到保护自身菌群密度的目的[44]。嗜水气单胞菌存在AI-1和AI-2两种QS系统[45]。由于不同的AI调控不同的QS系统,有效地控制AI合成,或阻断其与受体蛋白结合便可抑制QS调控的毒力因子的表达。因此,以腐败菌 QS 系统为靶点的新型药物可以更好地控制细菌群体感染并预防细菌耐药性的产生,为水生生物源致病菌的控制与预防提供新思路。李学鹏等[46]研究发现,1 mg/mL的丹皮提取物可较好地抑制嗜水气单胞菌生物被膜的形成及ChromobacteriumviolaceumCV026紫色菌素的产量。温和气单胞菌是革兰氏阴性、兼性厌氧的杆状细菌。常见于陆地和水生环境中,也是温血动物的主要条件致病菌。Chan等[47]通过分析温和气单胞菌159的全基因序列发现该菌的AveR核酸序列与A.sobria[WP_042019486]具有较高亲缘关系,且InterPro结果表明AveI具有自诱导合成和酰基-CoAN-酰基转移酶保守位点,符合作为AHL合成酶的标准。此外,AveR蛋白含有自诱导物结合结构域和LuxR型蛋白靶基因结合域,符合LuxR转录受体的基本要求。梅永超等[48]利用气相色谱-质谱(GC-MS)检测到腐败大菱鲆中温和气单胞菌具有分泌信号分子的能力,且干扰QS系统可减弱其致腐表型。因此,温和气单胞菌对水产品致腐能力受QS系统调控。
蜂房哈夫尼菌(Hafniaalvei)是一种能运动、有鞭毛、兼性厌氧的革兰氏阴性条件致病菌,常见于乳制品、肉类和水产品中,在真空包装产品中分离的几率较高,尤其是真空包装食品。蜂房哈夫尼菌耐低温,低温条件下可正常生长繁殖,因此该菌在冷链运输过程中会造成严重的经济损失[49]。Viana等[50]发现H.alvei可产生3-oxo-C6-HSL,该菌的腐败和生物膜形成与QS活性有关。Hou等[51]从腐败的即食海参中分离出的3株H.alvei(H2、H4和H7)均能产AHLs,且外源信号分子的添加可增强该菌形成生物被膜的能力。
3 群体感应抑制剂
群体感应抑制剂(quorum sensing inhibitors,QSIs)是指对细菌种内或种间信息交流具有阻断作用,可以干扰或抑制细菌群体感应现象,且对细菌体内的正常生命活动不造成影响的物质[52]。QSI最早发现于海洋生物的代谢产物中。其中海洋真菌中聚酮化合物的衍生物、海洋活性天然产物蓝细菌的多种代谢物、黄青霉、海绵提取物、海洋藻类分离得到的卤化呋喃酮、花色苷和羟乙磺酸以及苔藓动物的代谢产物等都对细菌的QS具有明显的抑制效果[53]。目前,已发现多种具有群体感应抑制活性的物质。根据化学成分可将QSI分为两类,即非肽类小分子化合物及肽类化合物。其中非肽类小分子化合物主要有呋喃酮类物质以及信号分子的结构类似物,而肽类化合物多数为AIPs的同系物以及QS降解酶等[54]。
QSI的作用机制主要有3种途径:①降低受体蛋白活性,产生信号分子类似物与信号分子受体蛋白竞争性结合,从而阻断QS通路。如二酮哌嗪(diketopiperazine,DKP)可与信号分子竞争从而阻止信号分子与受体蛋白结合,抑制QS系统所调控基因的表达,降低腐败菌的侵染能力[55]。而天然成分如穿心莲内酯衍生物、槲皮素等,由于其结构与信号分子类似,可竞争性抑制信号分子与受体蛋白LasR或PqsE的结合,从而阻断其蛋白转录途径[56]。②抑制信号分子合成,可通过抑制信号分子合成酶活性或消除底物等信号合成过程来实现。如姜油酮能显著抑制铜绿假单胞菌AHL合成酶的活性,从而阻碍腐败菌QS系统的正常运行[57]。而二氯苯氧氯酚被证实可以限制AHL类分子脂酰-ACP的生物合成,并干扰AHL的组装,以达到抑制前体合成的目的[58]。③降解信号分子,使其在胞外难以达到发挥QS调控作用的阈值浓度。酶类作为降解信号分子的主要物质之一,从作用方式上可分为信号分子降解酶和淬灭酶。常见的酶类有AHL内酯酶、AHL 脱酰基酶、对氧磷酶以及氧化还原酶等。前2种可直接降解AHL分子,而后两者主要是将信号分子中的羰基还原,使信号分子失活实现淬灭[54,59]。
细菌群体感应信号分子复杂多样,作用机制十分复杂。研究表明,与水产品腐败相关的细菌多为能够产生信号分子的革兰氏阴性菌[60]。因此,通过寻找QSI来抑制水产品的腐败成为可能的途径。目前,针对水产品腐败菌群体感应抑制剂的研究主要集中于一些天然提取物及合成类似物[61]。食用植物素(dietary phytochemicals)对人体有益并具有抗菌活性,在非致死量浓度下具有对QS的抑制作用[62]。葡萄柚汁(grapefruit juice)中所含的呋喃香豆素是细菌AI活性和生物被膜形成的有效抑制剂,也可作为卤化呋喃的替代物,可抑制大肠杆菌、鼠伤寒沙门氏菌和铜绿假单胞菌等病原菌生物被膜的形成[63]。酸橙种子中含有类胡萝卜素、莽草酸和去乙酰基苯胺酸17β-D-吡喃葡萄糖苷等柠檬苦素类似物,在一定浓度下对哈氏弧菌中的AI活性具有明显的抑制作用,同时也能有效抑制HAI和AI-2介导的生物发光效应[64]。Vikram等[65]发现槲皮素和柚皮素可抑制哈维氏弧菌BB120和大肠杆菌O157∶ H7的生物被膜形成。Zhu等[66-67]和Bosgelmez等[68]分别从食用真菌黑木耳和银耳子实体中以及洋葱中提取到了具有抑制群体感应系统的物质。此外,还有一些具有QS抑制活性的天然小分子化合物被发现,如香草提取物、玫瑰提取物、姜黄素等[69-71]。这些抑制剂的发现为抑制细菌群体感应系统以减弱病原菌致病性提供了可能,而且从天然植物原料中获取的抑制剂更具安全性。因此,QSI可开发用作新一代的生鲜、水产类食品的防腐剂和保鲜剂。
4 讨论
尽管微生物的群体感应研究在医学、制药学以及生物防治等领域已经取得了瞩目的成就,但对于食品领域,尤其是水产品腐败菌群体感应的研究尚处于起步阶段,而且其对于水产品腐败的相关调节机制尚不明晰,因此未来研究依然面临巨大的挑战。
首先,食品的腐败变质过程是一种由食品内生变化以及多种微生物活动共同引起的复杂变化过程,且在腐败过程中微生物之间会相互合作、竞争,从而使种群结构不断变化。目前对于食品中群体感应现象的研究多以单一的纯培养微生物为研究对象,而在这种培养条件下,AIs的种类及活性均与多菌相并存的自然腐败环境存在较大差异,因此研究结果并不能真实反映腐败菌的群体感应现象在食品腐败过程中的实际作用,如何系统研究真实情况下的食品腐败菌群体感应现象亟待解决。
其次,群体感应作为一种微生物之间的信息交流机制,对细菌之间的合作机制研究较多。但最近研究发现,细菌群体感应系统所参与调控的群体行为不仅包含细菌之间相互交流的合作行为,还存在仅享受公用物质而不参与协作的窃听欺骗行为,表明微生物作为一种种群实质上具有某些社会学行为。此外,微生物的窃听现象还能破坏种群之间原有的合作关系,消耗公用物质加速自身生长代谢,从而导致欺骗者快速生长并最终占据种群的绝对优势。Zhu等[72]对波罗地希瓦氏菌(Shewanellabaltica)的窃听现象进行了研究,发现其自身不能分泌环二肽类信号分子cyclo-(L-Pro-L-Leu),但它能够窃听并利用环境中外源的cyclo-(L-Pro-L-Leu)来提升自身luxR基因的表达,从而提高其致腐能力。Ghoul等[73]对不同培养条件下铜绿假单胞菌△lasR突变株的欺骗现象进行了研究,发现当牛血清蛋白为培养环境中的唯一氮源时,△lasR突变株因无法自身调控分泌蛋白酶,因此窃听并利用了野生株所分泌的蛋白酶。但当酪蛋白氨基酸为培养环境中唯一氮源时,△lasR突变株无需蛋白酶便可直接利用酪氨酸,因此其相较于野生株并没有明显的生长优势。这些研究共同表明了微生物的欺骗性竞争优势与公用物质的必要性有关。鉴于此,细菌群体感应欺骗现象的发现极大地拓宽了群体感应现象的研究领域,为有害微生物的控制提供了新的思路。因此,关于细菌群体感应合作-欺骗的关系及相应机制应成为今后研究的重点。
再次,群体感应抑制剂作为目前常用的群体感应控制手段,其筛选及验证工作普遍存在低效、盲目的问题,从而极大地制约了群体感应抑制剂在水产品保鲜方面的应用。因此,如何更加高效地筛选安全的群体感应抑制剂并将其应用于食品中也是需要解决的问题。目前,计算机辅助的虚拟筛选技术能够较好地解决这一问题。目前这一技术已被广泛地用于药物的虚拟筛选以及研究配体-受体蛋白之间相互作用中。通过分析配体与受体之间的相互作用,如氢键作用、疏水作用等来预测两者之间的最佳结合模式,并通过打分系统对分子对接结果进行综合评价,从而更好地分析两者之间的相互作用,为阐明群体感应抑制剂的抑制机制提供依据。Zeng等[74]通过分子模拟手段从51种传统中草药的活性成分中筛选得到了5种潜在的群体感应抑制剂,实验发现其均具有良好的群体感应抑制效果。此外,Ding等[75]通过分子对接的方法研究了姜黄素等对水产品腐败菌的群体感应抑制机制。
最后,随着研究的不断深入,对于微生物群体感应现象的研究逐渐进入分子生物学层面。转录组学及基因组学等相关技术的应用,有助于深层次地揭示群体感应现象的作用机制。然而以检测菌株为基础的传统群体感应抑制剂的筛选及相关实验也逐渐暴露出局限性。Defoirdt等[76]指出,目前进行的群体感应相关实验存在部分缺陷,即大多数实验没有证明群体感应表观现象不受如菌活力等其他因素的影响,实验中也多缺乏明确的作用靶标。因此,在以后的研究中如何改进这些缺陷也是亟待解决的问题。
5 展望
尽管目前对于水产品腐败菌的群体感应作用机制的研究尚有不足,但可以确定的是,通过调控微生物的群体感应现象来干预食品的腐败变质问题已成为不可忽视的研究趋势。随着科技的发展以及分子生物学、组学等技术的不断成熟,对于水产品腐败菌群体感应的机制将会更加明确,为控制水产品新鲜度,延长其货架期提供新途径。

