细菌生物被膜中群体感应调控机制及其控制研究展望
舒 琴,牛永武,陈启和
(浙江大学食品科学与营养系,浙江杭州310058)
近些年来,微生物感染导致的人类疾病多与细菌生物被膜密切相关,生物被膜形成的调控机制已经成为研究热点[1]。抗生素作为抗感染的主要药物,对维护人类健康发挥了重要作用。抗生素的滥用导致的细菌耐药性问题、不良反应及其他危害已经越来越严重,因此,细菌生物被膜引起的相关顽固性和慢性疾病急需有效的控制方法[2-3]。单细胞微生物增殖到一定数量,形成多细胞体,嵌合在惰性或者活性基质中,从而形成生物被膜[4]。面对不利环境条件,生物被膜具有生长缓慢、基因表达差异、侧向基因水平提高、抗生素耐药性和抗逆性提高以及破坏宿主防御系统等优势[5-7]。生物被膜的形成需要经历3个阶段:细菌黏附阶段、生物被膜成熟阶段和生物被膜分散阶段[1,8-9]。临床发现几种重要的致病菌都是通过生物被膜的形成介导人体感染,包括囊性纤维化相关的铜绿假单胞菌,下呼吸道和手术部位相关的金黄色葡萄球菌,肺炎引起的流感嗜血杆菌、链球菌、牙髓变形链球菌、血链球菌、核梭杆菌、干酪乳杆菌和内氏放线菌等[5,10]。
单一菌种的生物被膜由遗传物质相同但功能不同的细胞构成三维立体结构,这些细胞分化成不同类型的组织在生物被膜的建立、维持和扩散等方面起到重要作用。生物被膜可对营养缺乏、环境变化及外源侵袭作出响应。当细胞密度达到一定阈值,生物被膜中微生物可通过群体感应(QS)传递信息触发这种抗性机制[11]。生物被膜中由自体产生的胞外聚合物基质主要包括胞外多糖、脂质、核酸[12-13]以及其他提供刚性和附着性的不溶性成分,包括纤维素、淀粉类、表面黏附分子、菌毛和鞭毛等[14]。在生物被膜结构中,多种结构蛋白表达,有助于其发挥流变学特性[14-15]。
Curli是一种功能性淀粉样蛋白纤维,是胞外基质的关键成分,多产生于肠杆菌属(包括大肠杆菌和鼠伤寒沙门氏菌)。这些纤维对干燥环境、氧化应激反应、蛋白酶及抑菌剂都具有抗性,在生物被膜的形成过程中起着至关重要的作用。作为功能性物质,Curli纤维具有非常强的稳定性,可作为生物被膜的支架,而且在致病机制、宿主细胞黏附、侵袭以及免疫激活中都显示出重要功能[15]。
在生物被膜形成的3个阶段中,扩散是导致致病性细菌分散并定殖于宿主器官和组织的主要原因,但是其机制并没有研究清楚[16]。生物被膜扩散的调节已经成为医学研究的一个新兴领域,包括对处于自由分散状态的耐药菌的研究和对继发性生物被膜感染的预防[8,17]。通常情况下,脱氧核糖核酸酶(脱氧核糖核酸酶I)和糖苷水解酶(分散素B)等酶可作为以胞外聚合物基质为靶点的生物被膜传播剂。抗生物被膜肽(cathelicidin)、分散信号(NO和顺式-2-癸烯酸)、抗基质分子(壳聚糖、鼠李糖脂及尿素)和多价螯合分子(EDTA和lectoferrin)也可用于生物被膜的传播[18]。为了在多细胞生态位中同步发挥作用,细菌必须采用有效可靠的通信手段来进行种内和种间的交流。已有研究在几种食源性致病菌的生物被膜中观察到这些的相互作用[19]。据Han等[20]报道,由生物被膜导致的抗菌素耐药性、持久性及毒力因子引发了60%的食品安全事故爆发。在复杂生物被膜中,细菌采用群体感应(QS)因子作为通信手段,以协调和合作增殖、维持和传播[21-22]。通过响应阈值密度而触发的QS可调节基因差异性表达,并介导毒力、耐酸性和生物被膜生成[23]。
本文中,笔者将对生物被膜的形成、QS对生物被膜的调控机制和生物被膜的控制策略进行系统性阐述,并对抑制生物被膜感染的途径提出新观点,综述中讨论的概念总结在图1中。
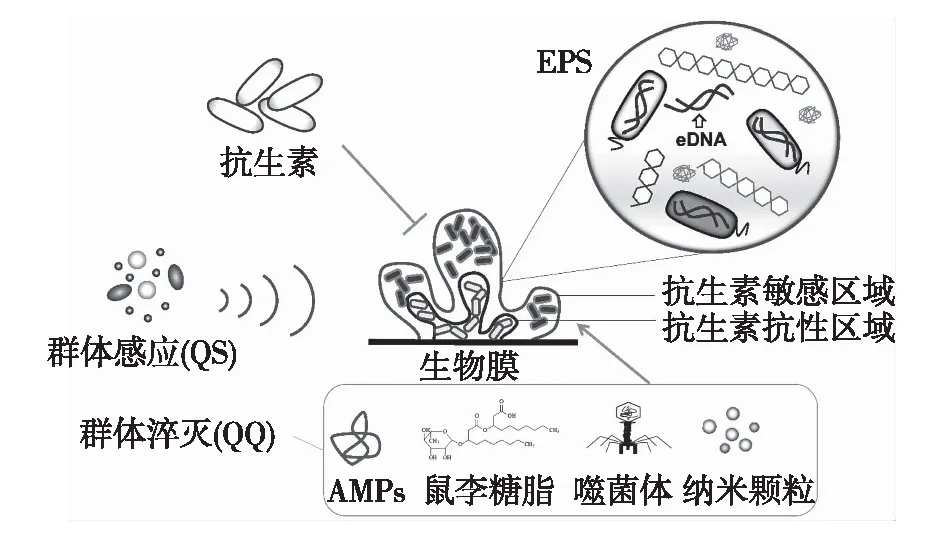
图1 群体感应(QS)与生物被膜形成的关系示意 Fig.1 Schematic diagram of relationship between quorum sensing (QS) and biofilm formation
1 生物被膜的形成
细菌由浮游状态到聚集状态是一个复杂的动态过程,其中涉及细胞表面分子、物质利用途径和毒力因子等多方面的变化,最终达到促进细菌在不利环境中生长的目的[8]。生物被膜由两部分构成:微生物细胞及其分泌的胞外聚合物(extracellular polymeric substances,EPS)。胞外聚合物作为生物被膜的结构成分,主要由胞外多糖、蛋白质和胞外DNA(extracellular DNA,eDNA)构成。多糖可为细胞的凝聚和黏附提供作用位点,蛋白为细菌提供碳源和氮源,eDNA可介导抗性基因在生物被膜中的传递[13]。最新研究发现,在营养充足的环境中,EPS的产量和生物被膜的形成存在直接关联[24],并且其成分也会随着养分供给和温度的变化而变化[8]。丰富的聚合蛋白、纤维素、细胞碎片、凝胶多糖、淀粉样蛋白和eDNA为生物被膜提供了良好的弹性、稳健性和高拉伸强度,且能提高QS对细胞的调控作用[8,14]。细胞外基质也能调节细菌的扩散、聚集和黏附,从而为形成生物被膜创造适宜的酸性环境。此外,致病生物被膜中大细胞生物量有助于降低生物被膜的扩散,并构成扩散的连续抗性模型,这不利于防治处理中抗生素渗透,而弱酸性药物可以增强抗生素的渗透性和有效性[25-26]。基于功能差异性,EPS可以分为三大类:第Ⅰ类为构成参与信号和结构调节的结构性EPS;第Ⅱ类包括提供针对宿主免疫系统和生理应力的保护性EPS;第Ⅲ类包含黏附和生物被膜发育中涉及的聚集类EPS。
在不利的自然环境中,细菌为获得有利的栖息地、营养物质并生存下来,触发默认的防御机制,形成生物被膜[27-28]。虽然细菌生物被膜形成的总体机制相似,但它们之间可能存在细微的差异[28]。 细菌生物被膜的生长通常是物理作用、化学作用和生物作用的统一结果,通常分为3个阶段:①初始附着(可逆和不可逆);②小菌落的成熟;③分散[29]。细菌产生黏附素,附着于表面,而细胞-细胞黏附机制可介导生物被膜的成熟,最后降解生物被膜基质的酶介导生物被膜的分散[30]。
1.1 初始附着阶段
致病性细菌形成生物被膜具有机会性,当浮游细胞与表面接触时,它们通过物理作用或细菌的菌毛或鞭毛[27]黏附于其上,该阶段被称为可逆附着,由于细菌和表面之间的弱相互作用,初始相互作用是瞬时和可逆的[12,31]。细菌细胞附着在表面上,被称为黏附,而细胞间的附着被称为粘连[12,32]。生物被膜对材料的黏附主要受疏水相互作用、空间相互作用、蛋白质黏附、静电相互作用和范德华力的控制[12,31-32]。
当生物被膜中的吸引力大于排斥力时,一些可逆附着的细胞保持固定并形成不可逆地附着[12]。已知葡萄球菌生物被膜具有超过20种相关的黏附素,在介导生物被膜的初始附着和成熟过程中的细胞间粘连中具有重要作用[30]。这些黏附素包括共价的细胞壁蛋白(如SasX)[28,33],以及非共价结合的蛋白和非蛋白因子[28]。Edwards等[35]研究发现,表皮葡萄球菌与聚合物表面的初始附着由表面相关的自溶素(At1E)控制,并且生物被膜形成由生物被膜相关蛋白介导。金黄色葡萄球菌表达2种纤连蛋白结合蛋白FnBPA和FnBPB,可诱导细菌侵入上皮细胞、内皮细胞和角质形成细胞。一些蛋白质通过改变细菌表面的生理化学特征来改变细菌的黏附行为。例如,研究观察到纤连蛋白、纤维蛋白原和层粘连蛋白可促进细菌黏附到生物材料和组织上[34-35]。
1.2 成熟阶段
在这个阶段,黏附的细胞通过产生自身诱导信号相互作用而生长、成熟,这将会导致生物被膜特异性基因的表达[12]。细菌分泌自诱导剂分子可促进毒力的产生和基因调节的信号传导。成熟阶段的细菌开始分泌包围细胞的EPS,从而稳定生物被膜网络并保护自身免受抗生素的侵害[12]。据Gupta等[12]报道,在成熟过程中,铜绿假单胞菌释放出3种多糖(藻酸盐、Pel和Psl),为生物被膜提供稳定性。除EPS外,还发现eDNA负责细胞通讯和稳定化生物被膜。在初始附着中,表皮葡萄球菌多糖细胞间黏附抗原(PIA)起作用,并且还保护增殖细菌免于多形核白细胞的侵袭。在细胞积累和聚集期间,细菌在表面上形成不同的细胞簇层,这些由此产生的微小菌落随后成熟为大孔隙,被包裹在EPS中,其中发生了细胞间信号传导和群体感应[32]。总体而言,成熟过程包括2个阶段:阶段Ⅰ为细胞间通信和自诱导剂信号分子(如N-酰化高丝氨酸内酯(AHL))的产生;阶段Ⅱ为微菌落大小和厚度增加到大约100 mm,形成大孔隙[28,36]。
1.3 分散阶段
分散是生物被膜形成过程中的关键阶段,因为它是细菌一个区域扩散到另一个区域的行为,从而导致相关疾病的传播感染。通常,生物被膜由2个不同的膜层组成:微生物细胞存在的基质膜以及它们扩散到周围环境中的表面膜,以保持生命的延续和菌落的扩大[32]。细胞的分散行为是通过单个细胞或从生物被膜脱落的细胞团进行,Gupta等[32]认为这是由缺氧(在需氧生物被膜的情况下)或饥饿引发的程序化过程。这种饥饿刺激小分子,如脂肪酸DSF(顺式-11-甲基-2-十二碳烯酸),可触发自身磷酸化并活化c-di-GMP磷酸二酯酶,从而降解c-di-GMP。c-di-GMP的降解导致通过剪切力或溶解一部分EPS的浮游细胞从生物被膜中释放[32]。除了参与EPS溶解的基因调控途径外,还有其他机制诱导生物被膜的扩散[37]。例如,生物被膜内的细菌细胞产生糖分解酶,破坏生物被膜稳定多糖,从而释放表面细菌,被释放的细菌细胞可在其他区域建立更多的生物被膜[32]。EPS的溶解是一个引起广泛关注的重要领域,因为它可成为抑制生物被膜和预防相关疾病传播感染的关键。
2 QS在生物被膜形成中的调控作用
2.1 细菌中的QS机制
QS通过介导细胞间的信息传导,对生物被膜的形成起着至关重要的调控作用[32]。当细菌密度达到一定阈值时,浮游状态的细胞触发QS机制,聚集形成多细胞实体并分泌信号小分子进行细胞间交流,这些信号分子对细菌遗传学和生理学都有着广泛影响[4]。群体感应可通过改变细胞的基因表达,表现出介导生物被膜发育、抗生素耐药性、运动和病原体的毒力等功能[38-39]。QS因子介导生物被膜功能的机制受环境因素的影响,如pH、营养和信号流速等[40]。群体感应不仅仅存在于细菌中,也在真核微生物(如念珠菌和组织胞浆菌属)、病毒中发挥作用[22]。细菌中QS突变体使QS系统成为潜在的抑菌靶点,从而降低细菌的毒力[22]。QS作用机制已经在致病性细菌中被广泛研究,包括金黄色葡萄球菌、蜡样芽孢杆菌、铜绿假单胞菌和霍乱弧菌。细菌中的典型QS系统由2个主要组分组成:自身诱导物(autoinducers,AIs)和它们的膜结合同源受体。AI是微小的可扩散的细胞外信号分子,由生长期间的细胞分泌,产生正反馈回路,在细胞密度响应应答中协调诱导或抑制多种靶基因。AHL是最常见的AI,并且它的信号传导机制已经被深入研究。
2.1.1 革兰氏阳性菌QS系统
QS调节革兰氏阳性细菌的多个过程,包括遗传物质的表达、毒力反应和抗菌肽的产生。 革兰氏阳性细菌中的QS利用翻译后修饰的肽,通过双组分适应性应答途径介导其作用,能够适应动态环境条件的改变和磷酸化/去磷酸化级联的信号传递,最终诱导靶基因的转录调控。
金黄色葡萄球菌可分泌多种毒力因子并具有耐药性,可在多种表面形成生物被膜,造成严重的感染风险,是威胁公共卫生安全的常见病原菌。由葡萄球菌agr基因编码的QS系统通过具有双组分系统的经典信号传导模块控制毒力和其他辅助基因的表达。与经典酶诱导不同,金黄色葡萄球菌agr系统可在非最优条件下自动激活,并且能够通过诱导排他性和协调的群体范围响应来区分自身和非自身[41]。agr系统中的AI是寡肽类(autoinducing peptides,AIP),由agrD编码并由AgrB激活和分泌。组氨酸激酶AgrC在与细胞外AIP结合后进行自身磷酸化并激活AgrA。磷酸化的AgrA可诱导RNAIII的表达,RNAIII与细菌生物被膜的附着、毒素和外蛋白酶的产生有关[41]。金黄色葡萄球菌中的生物被膜形成是致病的主要原因,并且可通过agrQS系统的活化将细菌从附着于表面的共生状态转换为入侵化脓性关节炎、骨髓炎和肺部感染的致病因子。
2.1.2 革兰氏阴性菌QS系统
LuxI/LuxR系统是革兰氏阴性菌中QS的原型。LuxI是产生AHL的AHL合成酶,可在高浓度下结合并稳定同源LuxR受体。AHL-LuxR受体蛋白复合物可激发几种基因的表达,同时在前馈反应中自诱导LuxI表达以产生更多AHL,并引起信号放大。几种致病微生物皆利用LuxI/LuxR型QS路径诱导毒力产生[41]。革兰氏阴性细菌利用具有扩散性的AHLs穿过细胞膜并与受体细胞中的调节蛋白结合发挥作用。依赖AHLs的QS系统首先在V.fischeri中被发现,V.fischeri是一种生物发光海洋细菌,栖息在几种鱼类的光合器官中。由V.fischeri产生的AI在光合器官中累积并超过阈值浓度,启动信号级联诱导表达编码荧光素酶复合物的结构组分的luxCDABE基因。在这个LuxI/LuxR的 QS系统中,AI由LuxI产生而自由地扩散进出细胞并变构刺激与pR启动子结合的转录调节因子LuxR[42]。LuxR在没有配体AI的情况下不稳定并迅速降解;然而,生产性AI-LuxR结合发生在阈值AI水平之上。启动逻辑与反馈拓扑的相互作用是LuxI/LuxR系统具有多功能性的基础[42]。LuxR/LuxI正反馈系统报告了不同的响应,而双正/负反馈系统可观察到同步作用。虽然大多数基于AHL的QS系统被称为LuxI型合酶和LuxR型受体,而基本的AHL依赖系统分别由编码AHL合成酶和AHL响应转录激活因子的I和R基因组成,一些革兰氏阴性细菌通常具有更复杂的QS信号机制。
临床上最常见的致病微生物铜绿假单胞菌,也是革兰氏阴性菌,可引起人类慢性肺部感染。铜绿假单胞菌中的QS系统作为一个复杂的等级组织存在,可通过多个途径之间的串扰建立大量基因之间的协调合作[43]。P.aeruginosa中的QS特征在于las和rhl系统,其与来自V.fischeri的lux系统具有相似性。2种系统中的AHL合成均由LuxI型合成酶介导,除了调节毒力因子的表达外,它们还与宿主免疫应答直接相互作用。另外,假单胞菌喹诺酮信号(PQS)QS系统充当las和rhl系统之间的介体调节途径,并调节许多也受las和rhl系统控制的基因,包括毒力因子和生物被膜形成的基因。宿主中铜绿假单胞菌的完全毒力基本上需要3个QS系统相互作用进行调控。
2.2 QS对生物被膜形成的影响
生物被膜形成是一个复杂的发育过程,从弱静电相互作用介导的初始可逆附着开始,例如范德华力和疏水相互作用,然后通过特定黏附蛋白和EPS的作用发生不可逆的附着[44],导致生物被膜的形成过程涉及大量基因表达的变化[45]。微菌落的形成和生物被膜的成熟,是一个涉及复合细胞外基质的合成和分泌(或通过细胞裂解释放)的过程[46]。
鲍曼不动杆菌(A.baumannii)是医院感染的重要病原菌。近年来的感染病例在增多,且其耐药性日益严重,已引起临床和微生物学者的严重关注。A.baumannii主要引起呼吸道感染,也可引发败血症、泌尿系感染、继发性脑膜炎等。多药外排泵是存在于细菌细胞膜上的一类蛋白质,在耐药性、细胞分裂和致病性以及QS信号分泌中发挥着重要作用[47]。临床分离的A.baumannii菌株长时间培养后有60%数量的菌株形成了生物被膜。在A.baumannii中,AdeFGH外排泵参与临床菌株生物被膜形成过程中自诱导剂分子的合成和转运[48]。值得注意的是,A.baumannii临床菌株中的生物被膜诱导形成与abaI和adeG基因的出现呈一致性,表明AdeFGH和AbaI联合上调对生物被膜发育具有显著影响[48]。此外,选择AdeRS(双组分调节系统)过度表达AdeABC外排泵与该病原体中的生物被膜形成和毒力表型相关[49]。
2.3 QS调节生物被膜EPS的合成和释放
由铜绿假单胞菌产生的糖脂主要是鼠李糖脂(Rhl),一种生物表面活性剂,可以促进细菌从生物被膜分离来影响生物被膜形成[50-52]。铜绿假单胞菌产生2种类型的Rhls,第1种是mono-Rhls,由rhlAB操纵子编码的酶合成。鼠李糖基转移酶催化脂肪酸二聚体和TDP-L-鼠李糖形成mono-Rhls。第2种类型为di-Rhls,含有2个鼠李糖基,使用mono-Rhls和TDP-L-鼠李糖作为底物由RhlC鼠李糖基转移酶产生[55]。通过QS系统,Rhl的产生可在转录水平上与弹性蛋白酶和绿脓素等不同的毒力相关性状相协调。这些Rhls在成熟生物被膜的细胞分散中起重要作用。
eDNA是铜绿假单胞菌生物膜基质的主要组成部分之一,主要是由QS控制的喹诺酮2-N-庚基-4-羟基喹啉-N-氧化物(HQNO)介导的细胞溶解释放的[54]。这种喹诺酮是PQS控制的分泌因子之一,但与MvfR受体(HHQ及其衍生物PQS)的特定配体不同,HQNO没有同源的QS受体。相反,HQNO通过在bc1细胞色素水平上抑制Q循环而直接起作用,从而促进活性氧物质(ROS)的生成,如超氧化物和H2O2,进而损害细胞膜,促进细胞溶解和eDNA释放。该过程类似于细胞凋亡,并且显然在临床铜绿假单胞菌菌株中广泛存在。此外,生物被膜基质中eDNA的存在增加了它们的稳健性和抗生素耐受性[54]。另一种为生物膜形成提供eDNA的机制涉及由隐式噬菌体内溶素介导的爆炸性溶解和膜囊泡形成引起的溶解[55]。
3 生物被膜控制策略研究
生物被膜相关疾病中,抗生素抗性的出现导致确认了几种原核和真核来源的抗生物被膜化合物。QS是调节生物被膜形成和细菌毒力的必要条件,已成为鉴定和生成抗生物被膜化合物的目标[21-22]。此类化合物可使群体感应系统沉默,这种现象被称为群体淬灭(QQ)[4]。干扰QS信号,破坏eDNA、蛋白质、脂多糖、EPS和第二信使,构成了生物被膜形成的抑制途径[56]。生物被膜结构上的稳定性和稳健性既能降低抗生素的渗透性,又能促进细菌的抗性传递,因此对抗生素防治处理造成了巨大挑战。在某些情况下,生物被膜的破坏可能需要机械、物理和化学手段[11]。QQ分子、黏附抑制剂、EPS破坏剂和竞争性微生物是清除微生物生物被膜的常见方法[57]。
3.1 群体感应抑制剂(QSI)
针对QS系统的天然/合成化合物被称为群体感应抑制剂(QSI),通过QQ机制发挥作用[10,58-59]。QSI大致分为3个不同类别:第一类包括通过化学修饰降解自身诱导剂的酶。例如,在细菌、古细菌、海洋物种和其他一些微生物中发现的内酯酶、酰胺酶、还原酶和细胞色素氧化酶。Koul等[61]通过比较基因组学分析揭示了分别在假单胞菌属和芽孢菌属中存在编码AHL酰基转移酶和AHL内酯酶的基因[60]。Huma等[62]研究发现,芽孢杆菌属中编码AHL内酯酶基因存在着显著的生物多样性和多态性。第二类包括天然化合物。如,酚衍生物(鞣质、黄酮类、苯基庚烯等)、吲哚衍生物、生物碱、呋喃酮、内酯、有机硫化合物和乙醛[62]。第三类为QS分子的合成类似物。如,AHL类似物(大环内酯类、阿奇霉素、呋喃酰肼和环己酮)和内酯类似物[4]。
天然抗生物被膜物质及合成类似物、螯合剂、羊毛硫抗生素也用于抑制生物被膜生长,包含一种以上抗生素的联合疗法用于治疗由多种异质生物被膜引起的细菌感染[1]。另外,天然存在的或通过基因工程产生的抗微生物肽(广谱杀菌肽R-FV-I16)对抑制生物被膜的分散是有效的。几种特异性靶向抗微生物剂(STAMPs)被设计为选择性地对病原体起作用,而不影响非致病性细菌。
生物被膜降解酶也可用于破坏EPS基质,影响生物被膜稳定性,并且分散剂与抗微生物剂的协同作用有利于破坏刚性生物被膜。目前,已知来自人角质层的脱氧核糖核酸酶I衍生物可破坏铜绿假单胞菌和临床耐甲氧西林金黄色葡萄球菌(MRSA)的生物被膜,而来自枯草芽孢杆菌的α-淀粉酶可抑制铜绿假单胞菌ATCC 10145和葡萄球菌的生物被膜。
3.2 黏附抑制剂
降低生物被膜表面黏附性是控制生物被膜形成的重要手段。在乳制品行业中,表面活性剂消毒是去除金属和玻璃表面生物被膜的常见做法。大多数有效的表面活性剂包括阴离子、离子和碱性化合物,而其他酸性化合物、酚类、碘、氯、苛性物质和过乙酸也可通过改变表面的物理化学性质来抑制生物被膜的形成[63]。表面活性剂会影响鞭毛的生长,导致微生物与基质的黏附性差,从而抑制生物被膜的形成[64]。由假单胞菌属(Pseudomonasspp.)生产的鼠李糖脂作为一种生物表面活性剂,可以抑制金黄色葡萄球菌、肠炎沙门氏菌和单核细胞增生李斯特菌等几种病原体的生物被膜,并有可能作为合成洗涤剂、发泡剂、乳化剂、增溶剂和保湿剂应用于食品工业中[65]。生物制剂,如酶基洗涤剂和噬菌体颗粒等因具有良好的抗生物被膜潜力而越来越受欢迎。用蛋白水解酶和其他酶进行预处理可有效地防止乳制品中的保加利亚乳杆菌和乳酸乳杆菌形成生物被膜。噬菌体颗粒还可杀死伤口生物被膜中的抗性微生物,应用于植入物和导管相关的疾病感染中[66]。
4 结论与展望
与生物被膜相关的微生物感染已经成为公共卫生、食品、农业等部门关注的重要问题。生物被膜的分散性和传播性,对抗生素的耐药性、形成内毒素的能力(革兰氏阴性菌)以及对宿主免疫系统的固有抗性都成为解决病原菌感染的重要障碍。目前,人们致力于开发新型手段控制与生物被膜有关的病原菌感染:①确定生物被膜特异性转录组,以鉴定生物被膜形成不同阶段的基因,从而通过特异性分子阶段控制机制破坏生物被膜;②寻找天然有效的QS抑制剂也成为抑制生物被膜感染的重要途径;③纳米颗粒抗生素成为新兴的研究领域,具有显著的抑菌效果;④开发具有抗生物被膜形成的天然洗涤剂,通过卫生、食品和乳制品行业的消毒杀菌来清除生物被膜。
最近二十年研究人员在生物被膜领域的开创性研究揭示了这种细菌群体生活方式的各个方面,但是微生物群落对生物被膜形成的内在控制机制需要进一步的探究。群落生活作为一种自然现象,经常出现遗传信息类似的细胞为适应环境,通过选择性表达获得表型不同的特征的现象。细菌分化通常来自不对称分裂,获得具有不同特征和功能的后代,而浓度依赖性细胞因子和细菌密度变化可诱导功能性细菌在生物被膜中差异性分布。少量功能衰老的细胞积聚在生物被膜内的复杂区域。因而,介导衰老的触发因素和分子物质,导致表型变异的响应性差异基因表达,劳动分工行为的诱导因素及生物被膜内的化学环境都是未来需要深入研究的问题,从而为理解多物种的动态联盟提供新的研究线索。

