前房注射卡波姆建立大鼠高眼压模型的观察△
赵靖康 韩双羽 刘慧峰 任媛 王霞 刘旭 何媛
青光眼在全球是仅次于白内障的导致视力丧失的主要病因[1]。预计到2040年,全世界的青光眼患者将超过1.1亿[2]。眼压在青光眼的发病机制中发挥着极其重要的作用,因此通过实验升高眼压导致视网膜神经节细胞退行性改变的动物模型一般认为是最适用于模拟人类青光眼的动物模型。高眼压的青光眼动物模型可以更好地筛选出能够商业化的降眼压药物[3]。啮齿类动物和人类的眼睛在解剖学上具有许多共同的重要特征,包括前房引流结构和房水动力学[4]。大鼠和小鼠与人眼的生理机能相似,且具有廉价、易于维持、生命周期相对较短及易于进行遗传操作等优点,故适宜作为青光眼模型[5]。
卡波姆是丙烯酸键合烯丙基蔗糖或季戊四醇而形成的高分子聚合物,有良好的乳化性、增稠性、助旋性和成膜性[6]。卡波姆pH值较低时呈溶液状,随着pH值的升高,其黏稠度逐渐增加。卡波姆进入前房后,与pH值为7.3~7.5的房水形成卡波姆混悬液,随着房水循环卡波姆凝胶阻塞小梁网,从而升高眼压[7-8]。本研究拟通过对大鼠前房注射卡波姆建立稳定的大鼠高眼压模型,观察卡波姆升眼压效果及对大鼠眼前节和视网膜的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物健康8周龄SD大鼠30只,雌雄各半,体质量250~300 g,所有动物均由西安交通大学实验动物中心提供。雌雄鼠分开饲养。实验遵循实验动物保护条例,并通过西安医学院动物实验委员会批准。
1.1.2 卡波姆混悬液的配制取0.15 g卡波姆940(上海索莱宝生物科技有限公司)放入烧杯内,加入蒸馏水30 mL后,用磁力搅拌器(韩国Daihan scientific有限公司)搅拌20 min,使混悬液变成半透明状。使用100 g·L-1氢氧化钠溶液滴定,使混悬液pH值为7.3~7.5。
1.2 方法
1.2.1 注射前的准备每只大鼠注射前均经过连续3 d基础眼压的测量,测量前按摩大鼠,消除其紧张情绪,每次均测量3次取平均值记录。使用100 g·L-1水合氯醛按3.5~4.0 mL·kg-1体质量腹腔注射麻醉大鼠。将大鼠右眼定为实验眼,前房内注射1 mL卡波姆混悬液,左眼为对照眼不做处理。实验眼注射前常规剪去大鼠胡须。
1.2.2 注射方法大鼠麻醉后用显微镊夹住结膜固定眼球。使用1 mL注射器抽取卡波姆混悬液 1 mL,连接到30 G针头上,在显微镜下将注射器针头于角膜缘外1 mm处穿刺进入前房,针头避免与晶状体前囊、虹膜和角膜内皮接触,抽出针头,随着房水的流出,前房变浅,眼球变软。然后从原伤口进针,进入前房后转动针头,使注射器的针头斜面朝向房角,将30 μL 5 g·L-1卡波姆混悬液快速注射并推入前房。此时虹膜血管颜色淡,前房深。随着眼压的升高,部分卡波姆从穿刺口流出,抽出针头的同时,助手立即用无齿镊夹住结膜伤口持续约1 min,然后用左氧氟沙星眼膏(参天制药中国有限公司)涂抹于角膜表面,待大鼠苏醒后放入笼内。之后用左氧氟沙星滴眼液(参天制药中国有限公司)滴眼,每天2次,连续7 d。
1.2.3 眼前节观察分别于注射后即刻及每周末进行眼前节照相,观察并记录眼前节组织结构的变化情况。
1.2.4 注射后眼压的测量大鼠清醒状态下,用回弹式眼压计(天津索维电子技术有限公司)测量眼压,眼压计默认测量3次的平均值作为一个眼压值。注射后每日早10时和晚22时测量眼压。
1.2.5 组织病理学观察注射后4周,保留4只实验眼持续高眼压状态的大鼠继续观察至注射后9周,余26只大鼠均处死后迅速摘除双眼眼球,并于40 g·L-1多聚甲醛中固定,24 h后梯度酒精脱水,将浸蜡的组织包埋,平行于眼轴方向切片,切片厚4 μm,烤片、脱蜡,HE染色后选取实验眼和对照眼均完整切到视神经的切片,用图像处理软件分别测量距离视神经200 μm处的视网膜厚度并对比。同时对比同一只大鼠双眼HE染色切片,观察实验眼和对照眼的房角形态。
1.3 统计学分析应用PASW Statistics 18.0软件进行统计学分析,数据以均数±标准差表示,两组间比较采用组间独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 眼压注射前,实验眼白天眼压为(11.10±0.90)mmHg(1 kPa=7.5 mmHg),夜间眼压为(11.92±1.07)mmHg;对照眼白天、夜间眼压分别为(11.22±1.07)mmHg和(11.76±1.08)mmHg。经统计学分析,大鼠实验眼与对照眼之间,白天、夜间眼压差异均无统计学意义(均为P>0.05);实验眼白天眼压比夜间低(0.80±1.20)mmHg,差异具有统计学意义(P=0.00),对照眼白天眼压比夜间低(0.58±1.38)mmHg,差异具有统计学意义(P<0.05)。注射后,26只实验眼高眼压均可以维持4周,另外4只实验眼眼压可以维持在20 mmHg以上达6~9周。注射后第1天至第27天,实验眼与对照眼夜间眼压相比差异均具有统计学意义(均为P<0.05);注射后第28天,实验眼与对照眼夜间眼压相比差异无统计学意义(P>0.05)。注射后第1天至第19天,实验眼与对照眼白天眼压相比差异均具有统计学意义(均为P<0.05);注射后第20天,实验眼与对照眼白天眼压相比差异无统计学意义(P>0.05)。见图1。

图1 实验眼、对照眼不同时间点眼压的变化。黑色箭头示注射日
2.2 眼前节改变注射后即刻行眼前节照相可见,对照眼眼前节未见异常(图2A);实验眼半透明的卡波姆沉积于前房,由于眼压升高,虹膜血管颜色变淡,瞳孔大小与对照眼相当(图2B)。注射后1周,实验眼出现典型的两种卡波姆存在方式:(1)弥散型:卡波姆弥散在前房,呈薄雾状,虹膜血管窥不清(图3A);(2)沉积型:卡波姆沉积于瞳孔区,呈团块状(图3B)。计算两种卡波姆沉积方式实验眼1周内的平均眼压,弥散型为(17.83±3.54)mmHg,沉积型为(13.00±1.55)mmHg,两者相比差异具有统计学意义(P<0.05)。高眼压维持至实验结束(注射后9周)的大鼠眼前节观察可见,对照眼前房透明,虹膜血管清晰可见(图4A);注射后1周,卡波姆呈云雾状,新生血管长入角膜,卡波姆界限明显,眼球突出于眼睑,使眼睑闭合不全(图4B);注射后3周时卡波姆较1周时局限(图4C),夜间眼压维持在25 mmHg;注射后6周,眼压依然维持在25 mmHg,卡波姆呈团块状沉积于前房,眼球突出更加明显,角膜水肿,有溃疡面(图4E),裂隙灯下检查发现,前房消失(图4F)。
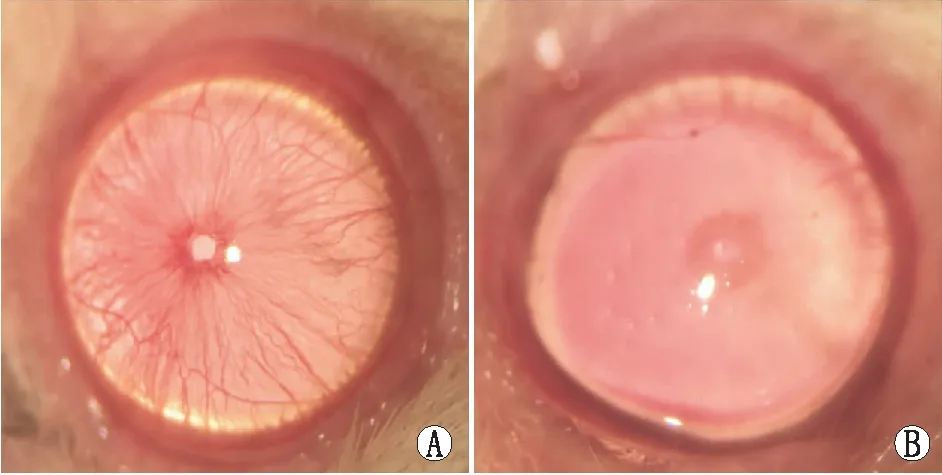
图2 注射后即刻眼前节照相。A:对照眼;B:实验眼

图3 实验眼前房注射卡波姆后的两种存在方式。A:卡波姆呈弥散型;B:卡波姆呈沉积型

图4 高眼压维持的实验眼前房注射卡波姆后不同时间观察。A:对照眼;B:注射后1周;C:注射后3周;D:注射后6周;E:注射后9周;F:注射后9周裂隙灯下
2.3 视网膜形态和厚度对比注射后4周,实验眼视网膜全层变薄,内丛状层厚度减少,内外核层融合为一层,细胞排列紊乱,神经节细胞明显减少;对照眼视网膜各层结构清晰,神经节细胞清晰可见(图5)。实验眼注射后4周视网膜厚度为(254.70±21.80)μm,对照眼为(346.73±24.63)μm,实验眼与对照眼视网膜厚度相比差异有统计学意义(P=0.00)。
2.4 房角形态对比注射后4周,对照眼房角形态正常,可以观察到虹膜血管及睫状体(图6A);实验眼前房充满卡波姆及虹膜的混合成分,紧贴角膜内皮并延伸至房角,堵塞小梁网结构,正常虹膜形态消失(图6B)。
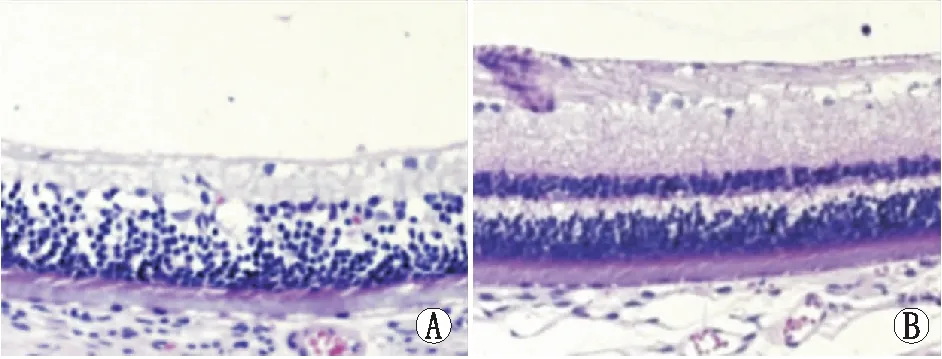
图5 注射后4周实验眼与对照眼视网膜形态对比(HE,×200)。A:实验眼;B:对照眼

图6 注射后4周房角形态对比。A:对照眼;B:实验眼(黑色箭头示前房内卡波姆与虹膜的混合成分)
3 讨论
青光眼动物模型根据眼压升高的机制可分为小梁前、小梁和小梁后模型[9]。小梁前模型由不同类型的外源性物质(如硫酸软骨素、甲基纤维素、聚苯乙烯微珠等)注入前房内来阻碍房水流出,这种方法保留了眼部正常的解剖结构,炎症反应相对较轻。小梁模型最广泛造模方法是小梁激光光凝术,这种方法通常需要多次激光光凝才能维持数周的高眼压,由于啮齿类动物眼睛尺寸太小而难以施行。小梁后模型针对巩膜后静脉进行不同方法的处理,如激光凝固、烧灼或高渗盐水注射等[10]。小梁后模型实现了快速但短期的持续眼压升高,但它们存在诸如眼球突出和角膜内皮失代偿等不利因素[11];激光对静脉的处理也可能损伤睫状神经,巩膜静脉阻塞可引起角膜缘或脉络膜局部缺血、缺氧变化,以上弊端可能会对实验结果产生根本性的影响[12-13]。国内外报道的前房注射外源性物质阻塞房水排出的模型,注射体积一般都小于15 μL,但我们的预实验发现,注射15 μL卡波姆混悬液时,卡波姆容易沉积在瞳孔区,升眼压效果并不明显[14],而注射30 μL卡波姆混悬液,可以使前房充满卡波姆,升眼压效果稳定。Frankfort等[15]使用22 G玻璃针对大鼠前房注射6 μm和10 μm的混合微珠从而升高眼压,其采用透明角膜的穿刺方法,通过特殊制成的针头,在针管末端抽取黏弹剂,黏弹剂的作用是使微珠漏出的量减少。该方法用针头较本实验粗,在透明角膜上的穿刺口有感染的风险。
本实验的重点在于手术过程中如何将尽可能多的卡波姆留在前房内。在模型优化过程中,我们比较了不同浓度卡波姆混悬液的升眼压效果,发现5 g·L-1的卡波姆混悬液是获得大鼠持续高眼压的最有效浓度。30 G的注射器针头可以顺利排出浓度为5 g·L-1的卡波姆混悬液,更高浓度的混悬液不利于卡波姆的排出。采用结膜下进针、穿刺进入前房及针头斜面朝向角膜缘的方法,可以使卡波姆沿着房角分布[16]。出针时用无齿镊夹住伤口避免卡波姆从前房漏出,可使更多的卡波姆留在眼内[17]。
注射后前房深度、前房混浊程度及虹膜血管颜色是判断眼压高低的指标。我们发现,注射后实验眼前房混浊、卡波姆呈弥散状、虹膜血管颜色淡的大鼠眼压相对较高,并且可以维持高眼压水平较长时间;而注射后卡波姆分布不够均匀、虹膜血管部分清晰可见、卡波姆最后沉积在瞳孔区的大鼠,升眼压效果相对较差,维持时间相对较短。产生这种现象的原因可能是弥散的卡波姆会产生不同质量的卡波姆凝胶颗粒,对小梁网的阻塞效果更好,而凝聚成团的卡波姆无法释放小分子卡波姆凝胶颗粒。以往的大鼠高眼压模型均只取白天眼压作为读数,并未提及夜间眼压,本实验发现,实验眼夜间眼压明显高于对照眼及白天眼压。吉富健志[18]使用荧光光度计进行家兔房水产生的测定,发现房水的产生量在明室内下降,在暗室内增加。所以推测本组大鼠高眼压产生昼夜波动的原因可能是夜间暗室环境中产生的房水大量增加引起。实验眼眼压升高4周可出现视网膜改变,4周后,眼压下降的大鼠数目增多,视网膜修复可能出现。
本实验方法属于小梁前模型,通过卡波姆阻塞房水流出通路来升高眼压,单次注射可维持眼压升高4周以上,注射后眼压的昼夜波动符合人类青光眼的特点。
综上,卡波姆前房注射建立大鼠高眼压模型引起昼夜眼压升高的效果理想,操作简便,重复性好,副作用少,升高的眼压维持稳定,是较为理想的大鼠高眼压模型,值得进一步研究。

