糖尿病黄斑水肿患者病变程度与脉络膜厚度的关系△
徐静 唐晓娟 于健 林淑玫 谭青 刘琼 吴京
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的微血管并发症之一。血-视网膜屏障(blood-retinal barrier,BRB)破坏被认为是DR发生的重要事件,BRB破坏导致血管通透性增加,血管内液体及蛋白成分渗漏到组织中,引起黄斑水肿形成[1]。糖尿病黄斑水肿(diabetic macular edema,DME)是DR患者视力丧失的主要原因,可以发生在DR的任何一个阶段[2]。脉络膜是一个高度血管化的结构,负责外层视网膜血液和营养的供应,是中央凹无血管区营养代谢交换的唯一来源[3]。持续高糖会对脉络膜血管组织造成损伤,糖尿病中的脉络膜血管病变又称为糖尿病脉络膜病变(diabetic choroidopathy,DC),主要表现为脉络膜毛细血管扩张和阻塞,血管无灌注区和新生血管形成等[4]。此外,脉络膜的炎症和缺血可能破坏与脉络膜紧邻的血-视网膜外屏障,导致视网膜下液形成[5]。由于内、外屏障关系紧密,一旦外屏障遭到破坏,进一步也会导致内屏障失衡[6]。近年,随着频域光学相干断层扫描增强技术(enhanced depth imaging spectral domain optical coherence tomography,EDI SD-OCT)在临床的广泛应用,使得脉络膜的研究更深入至解剖结构层面[7]。脉络膜厚度(choroidal thickness,CT)与脉络膜循环密切相关,目前利用EDI-OCT测量DR患者CT变化的研究尚少,过去有研究报道了DR或DME不同阶段患者的CT改变[8-9],但研究结果在某种程度上存在相互矛盾,CT的变化与DR或DME严重程度之间的关系仍未明确。因此,本研究拟测量不同DME阶段患者的CT,以探讨CT与DME严重程度的关系。
1 资料与方法
1.1 一般资料收集2015年10月至2017年4月在南方医科大学南方医院眼科就诊的2型糖尿病患者123例(204眼),其中男64例、女59例,年龄为(56.6±10.3)岁。所有患者均接受完整的眼科检查,包括眼前节、屈光度、最佳矫正视力、眼压、眼轴长度,并在散瞳状态下接受直接检眼镜和裂隙灯显微镜+90 D前置镜的眼底检查,最后确诊经荧光素眼底血管造影(fundus fluorescein angiography,FFA)和OCT检查。
1.2 纳入和排除标准纳入标准:(1)处于任何DR阶段糖尿病患者,年龄30~80岁;(2)根据ETDRS临床显著性黄斑水肿的标准,经FFA及OCT综合诊断为DME;(3)糖尿病接受正规治疗,血糖控制平稳者(空腹血糖≤6.1 mmol·L-1,餐后血糖≤11.1 mmol·L-1)。排除标准:(1)超过±3.0 D的屈光不正;(2)白内障或显著屈光介质混浊,无法获取清晰图像;(3)有青光眼病史;(4)合并其他视网膜及脉络膜病变,如年龄相关性黄斑变性、视网膜静脉阻塞、息肉状脉络膜血管病变、葡萄膜炎等;(5)有局灶和(或)格栅视网膜激光光凝术、玻璃体切割术、玻璃体内注药术或其他眼科手术史。
1.3 DME分型DME诊断标准按照ETDRS推荐“临床有意义的黄斑水肿诊断标准(clinically significant macular edema,CSME)”[10],应具备以下情况一项或一项以上:(1)视网膜增厚位于距黄斑中心凹500 μm范围或以内区域;(2)眼底见硬性渗出及邻近视网膜水肿增厚区距黄斑中心凹500 μm以内的区域;(3)至少有1个视盘直径范围的视网膜水肿增厚,并且有部分病变发生于距黄斑中心凹1个视盘直径的范围内。根据OCT形态学将DME分为3型[11]:视网膜弥漫性增厚(diffuse retinal thickening,DRT)型、黄斑囊样水肿(cystoid macular edema,CME)型和浆液性视网膜脱离(serous retinal detachment,SRD)型。
1.4 CT测量所有患者EDI SD-OCT(Spectralis;Heidelberg Engineering,Heidelberg,Germany)扫描于 1500 到1800之间进行,所有操作均由同一位经验丰富的医师进行。使用OCT Heidelberg Eye Explorer软件中的卡尺工具在中央凹处手动测量垂直于视网膜色素上皮(retinal pigment epithelium,RPE)的黄斑中心凹下CT(subfoveal choroidal thickness,SFCT)。从RPE层到巩膜-脉络膜界面的反射线间距离即为CT[12]。使用相同的方法在鼻侧、颞侧、上方和下方象限(分别距离黄斑中心凹500 μm、1000 μm、1500 μm、2000 μm)测量旁中心凹CT(parafoveal choroidal thickness,PFCT)。

2 结果
2.1 一般结果本研究对照组135眼,DME组69眼,DME组包括DRT型(34眼)、CME型(19眼)和SRD型(16眼)。每组患者的基本信息(年龄、性别分布、高血压和高脂血症、CRT和SFCT)见表1。DME组与对照组患者年龄和性别分布差异均无统计学意义(P=0.589、0.527),DME组的不同亚型患者年龄和性别分布差异亦均无统计学意义(P=0.659、 0.936)。由于高血压或血脂异常病例数量有限,未对其进行统计分析。
典型患者的眼底彩照、FFA和EDI SD-OCT图像见图1。
2.2 与DME严重程度和形态学分型有关的SFCT变化DME组、对照组SFCT分别为(326.72±90.15)μm、(320.17±106.46 μm),两组间SFCT差异无统计学意义(P=0.645),但与对照组相比,DME组的SFCT略有增加。对不同DME形态进一步分析,SRD型的SFCT[(401.63±88.80) μm]最厚,与对照组、DRT型[(303.94±81.47) μm]、CME型[(304.42±73.98)μm]比较,差异均有统计学意义(均为P<0.05)。而DRT型和CME型的SFCT较对照组轻度下降,但差异均无统计学意义(均为P>0.05)。
DME组SFCT与CRT之间相关性分析结果显示,二者呈正相关(r=0.270,P=0.025)。见图2。
表1 研究对象的基本特征

项目对照组DME组DRT型CME型SRD型眼数/眼135341916年龄/岁55.78±11.8457.97±8.4956.42±13.8254.38±10.66性别 (男/女)65/7019/1511/89/7高血压/例7120109高血脂/例40671CRT/μm 220.79±18.23284.91±47.09∗398.74±47.09∗410.31±143.30∗SFCT/μm320.17±106.46303.94±81.47304.42±73.98401.63±88.80∗
注:与对照组相比,*P<0.05
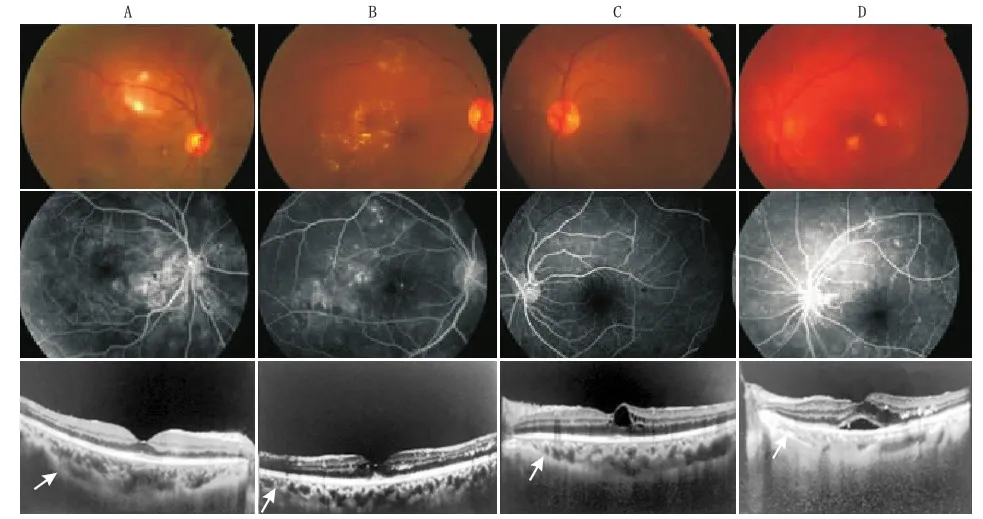
图1 典型病例图像。A:无DME;B:DRT型DME;C:CME型DME;D:SRD型DME。第1行为眼底彩照、第2行为FFA检查、第3行为EDI SD-OCT图像。EDI SD-OCT图像上箭头标示为脉络膜-巩膜连接处

图2 DME组CRT与SFCT之间相关性散点图
2.3 各组黄斑周边不同部位CT的变化除SRD型DME,其余组CT均显示一致的变化趋势:与上方、下方、颞侧相比,所有分组的鼻侧脉络膜均最薄(DME、对照组、DRT、CME,均为P<0.05)。但在SRD型DME中央(500 μm)和内环(1000 μm、1500 μm),鼻侧CT比颞侧更厚,鼻侧CT在外环(2000 μm)处厚度突然减小并且变得比颞侧更薄(P<0.05)。见图3。
在所有组别内,尽管上方的CT几乎保持不变甚至随着距离的增加而略微增加(P=0.996、0.936、0.855、0.185),但整体CT的变化倾向于随着与中心凹距离的增加而减少。鼻侧CT对距离有很强的敏感性,鼻侧CT在对照组、DRT型和CME型中随距离增加而下降显著(P<0.05),但在SRD型中下降趋势则更平缓(P=0.195)。与对照组相比,DME组的平均总体CT仍有增加。对于DME不同形态学亚型,结果与SFCT相似,SRD型CT显著高于其他3组(P<0.05),然而,对照组与其他两种亚型之间的差异不显著。见图3。
图3 各组黄斑周边不同部位CT比较
3 讨论
本研究中我们运用EDI SD-OCT初步探究了CT在DME病理生理过程中的可能作用。结果显示,不论是对于SFCT还是PFCT,SRD型DME患者的CT均显著增厚,而与对照组相比,DRT型和CME型患者的CT稍有变薄。糖尿病是一种可累及全身血管系统的代谢性疾病,尽管DR、DME等疾病的病理改变主要发生在视网膜脉管系统,但近年来研究发现,脉络膜血管层也存在一定病理改变[13]。本研究结果显示,与对照组或SRD型DME相比,DRT型及CME型DME患者的CT变薄,这与既往研究结果一致[8,13-14]。但目前关于CT变薄的机制解释尚存在争议,现多认为CT与脉络膜血流量密切相关[14];既往有研究报道,无临床意义视网膜病变的糖尿病患者CT显著下降,提示脉络膜血流充盈量的下降和循环代谢系统紊乱可能先于视网膜病变临床症状的出现[14-15]。Manjunath等[16]研究也进一步显示,DR患者的脉络膜毛细血管内皮发生明显损害。因此,在DR发展过程中,病变早期的脉络膜持续处于缺血缺氧环境,使得脉络膜毛细血管收缩,血流循环障碍,脉络膜血流减缓,随着病情加重,脉络膜毛细血管出现狭窄、闭锁甚至萎缩,最终导致脉络膜血管床变薄。
本研究还发现,SRD型DME患者的CT明显厚于其他组患者。既往有研究报道,脉络膜的增厚可能由脉络膜大血管的局灶性或弥漫性扩张引起,因此除了脉络膜毛细血管的原发性萎缩,内部脉络膜血管层(包括中、小血管层)的变薄也可能由于扩张的大血管层压迫所致[17],而视网膜神经上皮层与RPE层的脱离常可发生在扩张的血管处,可能的解释是由于增厚的脉络膜层压迫引起RPE机械应力增加,导致二者机械性分离,这在中心性浆液性脉络膜视网膜病变中也有过报道[18]。此外,本研究也显示DME患者的CRT和SFCT之间呈正相关,这与Kim等[8]的研究结果一致。CRT在一定程度上可以反映黄斑水肿的严重程度,严重的DME导致VEGF或其他细胞因子生成显著增多,刺激纤维血管增生和脉络膜层增厚,而在另一项随访6个月的临床研究中,玻璃体内注射抗VEGF药物,DME患者CT发生显著变薄[19],这样的结果也从侧面证实了这一观点。
目前,DME患者发生神经上皮层脱离的机制尚不清楚,过去有临床研究数据指出神经上皮层的脱离与眼球内渗透压的增高相关[19-20]。DME患者的血管内皮屏障受损,血管通透性增加可以导致此类渗透压的增加。Ota等[21]研究发现,CME患者外丛状层的囊腔可以发生破裂形成SRD,提示BRB破坏后血液内成分可能直接渗漏进入SRD处。
我们进一步测量了黄斑周围不同方向、不同距离处的CT,从整体结果来看,DME患者脉络膜呈现均匀一致的增厚,不仅在黄斑中心凹下,黄斑区周围CT也均较非黄斑水肿患者增加。此外,相对于其他区域,CT在黄斑鼻侧和视盘附近较薄,这与以往研究结果一致[22],并且CT在鼻侧方向是随着远离黄斑,靠近视盘方向而呈现递减趋势[23]。Ferrara等[17]曾报道,视盘周围包含一个“分水岭区域”,此处脉络膜毛细血管仍存在,但缺乏脉络膜中、大血管层,是导致脉络膜变薄的重要原因。
脉络膜-巩膜轮廓的改变是产生CT测量误差的重要因素,正常眼球具有凸面或碗状的平滑的脉络膜-巩膜边界,脉络膜表现为在黄斑中心凹下方最厚,到周边部逐渐变薄。而DR患者眼球的脉络膜-巩膜边界多呈现不规则的凹凸形或S形,导致脉络膜最厚点从黄斑中心凹向旁边移位[24-25]。由于SRD型DME患者脉络膜的血管通透性和血管渗透压均较高,因而这种类型的DME更易引起脉络膜的变形,我们推测这是导致SRD型DME患者鼻侧CT变化趋势不同于其他两种类型,鼻侧相对较厚,并且鼻侧CT下降趋势更平缓的重要原因。
综上,本研究表明,CT与黄斑水肿的程度和类型都密切相关,DME患者的CT相对增加,尤其SRD型DME患者脉络膜会出现显著并且均匀的增厚。今后,我们将扩大样本量,更深入地研究及探索CT增加与DME发展之间确切的因果关系。

