6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶(PFKFB3)抑制剂3PO对高糖环境下人脐静脉血管内皮细胞新生血管形成的影响△
胡萍 韦芳 顾青 曹阳 田敏 吕红彬
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的微血管并发症之一,是工作人群视力损害和致盲的主要原因[1]。目前认为,糖尿病患者长期慢性高血糖是引起DR病理改变的主要原因[2]。DR晚期常有视网膜异常新生血管形成[3]。血管内皮细胞在新生血管形成中起重要作用,内皮细胞的增殖和迁移可形成毛细血管网络,为新生血管形成提供条件[4]。供应血管内皮细胞活动的85%ATP来自于糖酵解,糖酵解的主要调节剂为6-磷酸果糖激酶-2/果糖-2,6-二磷酸酶(6-phosphofructokinase-2/fructose-2,6-bisphosphatase 3,PFKFB3)[5]。PFKFB3在血管内皮细胞中高度表达[6],PFKFB3 的抑制剂3-(3-吡啶基)-1-(4-吡啶基)-2-丙烯-1-酮[3-(3-pyridinyl)-1-(4-pyridinyl)-2-propen-1-one,3PO]可降低糖酵解速率,抑制内皮细胞增殖和迁移,减少血管萌芽[5,7]。本课题组前期研究表明,PFKFB3在DR患者玻璃体和血清中以及糖尿病大鼠视网膜中表达均升高[8-9]。然而,高糖环境下抑制PFKFB3对血管内皮细胞增殖、迁移及管腔形成的作用尚不明确。本研究通过体外高糖环境模拟糖尿病状态,探讨应用3PO抑制PFKFB3对血管内皮细胞的作用及其机制,为DR的防治提供新的理论依据。
1 材料与方法
1.1 实验试剂与仪器人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC;美国ScienCell公司);细胞外基质培养基 (美国Gibco公司);基质胶 (美国Corning公司);Trizol试剂(美国Invitrogen公司);逆转录试剂盒及SYBR Real-time PCR试剂盒(日本Takara公司);PFKFB3抗体 (英国Abcam公司);细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和磷酸化细胞外信号调节激酶(phospha-extracellular signal-regulated kinase,p-ERK) 抗体和β-actin抗体(美国CST公司);ECL化学发光试剂盒(美国Millipore公司);倒置显微镜(日本 Olympus 公司);实时荧光定量PCR仪、垂直电泳仪(美国Bio-Rad 公司);凝胶成像仪(美国General Electric 公司)。
1.2 方法
1.2.1 细胞培养及分组将HUVEC复苏,2.5 g·L-1胰蛋白酶消化后接种于培养皿,加入ECM培养基,置于37 ℃、体积分数5%CO2恒温培养箱中进行细胞传代培养。将传代培养的HUVEC随机分为4组:正常对照组 (5.5 mmol·L-1葡萄糖)、高渗组 (5.5 mmol·L-1葡萄糖+24.5 mmol·L-1甘露醇)、高糖组 (30.0 mmol·L-1葡萄糖)及高糖+3PO组(30.0 mmol·L-1葡萄糖+10.0 μmol·L-13PO)。细胞同步化后按分组情况更换相应培养基,继续培养细胞,用于后续实验。
1.2.2 MTS实验检测细胞增殖情况将对数生长期的HUVEC以每孔20×103个接种于96孔板,按分组情况更换培养基,每组设置6个复孔,分别培养24 h和48 h后每孔加入20 μL MTS溶液,重新放回培养箱孵育2~4 h后,用酶标仪于490 nm测定每孔的吸光度(A)值,计算细胞增殖率。
1.2.3 细胞划痕实验将对数生长期的HUVEC以每孔200×103个接种于12孔板,待细胞铺满培养皿融合成单层细胞后,用200 μL微量加样枪头垂直在培养孔中央划一条直线,用磷酸盐缓冲液清洗细胞两遍,按照各组处理要求加入相应的培养基继续培养。倒置显微镜下分别于24 h、48 h 观察细胞从划痕处向外迁移的面积。在0 h、24 h及48 h随机选取 6个视野进行拍照,采用Image J软件进行图像分析,计算迁移面积的百分比作为各组细胞迁移率。
1.2.4 体外管腔形成实验将无菌枪头及96孔板置于-20 ℃冰箱过夜,基质胶置于4 ℃冰箱中融化。基质胶置于冰浴中,用预冷的枪头将基质胶缓慢铺于96孔板中,每孔50 μL,水平放入培养箱中静置30 min使基质胶凝固。将细胞消化计数后加入各组培养基,混匀后每孔加入100 μL的细胞悬液 (20×103个细胞),继续培养4~6 h,观察各组细胞成管数量、完整程度及管状结构排列情况等,并随机选择6个视野拍照,应用Image J软件分析细胞成管长度。
1.2.5 实时荧光定量PCR检测分组处理HUVEC 48 h,Trizol试剂提取各组细胞总RNA,逆转录试剂盒将RNA逆转录为cDNA,SYBR Green实时荧光定量PCR法扩增cDNA,反应条件:95 ℃ 2 min,95 ℃ 10 s,58.5 ℃ 30 s,72 ℃ 30 s,共 40个循环。每组设置3个复孔,以β-actin为内参,采用公式△Ct=Ct目的基因-Ct内参基因,△△Ct=Ct实验组-Ct对照组,计算2-△△Ct,得出目的基因的相对表达量。引物序列如下:PFKFB3:正向:5’-CTTGTCGCTGATCAAGGTGA-3’,反向:5’-TTCTGCTCCTCCACGAACTT-3’;β-actin:正向:5’-GGACTTCGAGCAAGAGATGG-3,反向:5’-AGCACTGTGTTGGCGTACAG-3’。
1.2.6 Western blot检测蛋白表达按分组处理HUVEC 48 h,提取细胞总蛋白,每孔中取相同量上样进行SDS-PAGE电泳。浓缩胶 80 V,分离胶120 V,360 mA转膜1.5 h。置于脱脂牛奶内室温摇床上封闭2 h,稀释一抗(11000),4 ℃孵育过夜,室温摇床上 TBST洗3次,每次15 min。稀释二抗 (15000),室温孵育1 h,TBST洗3次,每次15 min,将PVDF膜蛋白面与ECL显影液接触,凝胶成像仪显影成像,采用Image J软件分析处理,计算各目标蛋白相对表达量。
1.3 统计学分析采用SPSS 17.0统计学软件进行数据处理,计量资料用均数±标准差表示,采用单因素方差分析,组间两两比较采用LSD分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较各组间细胞增殖率总体比较差异均有统计学意义(均为P<0.05)。与正常对照组相比,高渗组细胞增殖能力降低(均为P<0.05);24 h高糖组细胞增殖能力无明显升高(P>0.05),48 h高糖组细胞增殖能力升高(P<0.05)。与高糖组相比,高糖+3PO组细胞增殖能力明显被抑制(均为P<0.05)。见表1。
表1 各组细胞增殖率、细胞迁移率及管腔形成长度

组别细胞增殖率/%24 h48 h细胞迁移率/%24 h48 h管腔形成长度/像素正常对照组1.00±0.021.00±0.0217.14±1.6133.38±1.7117 980.0±688.7高渗组0.94±0.030.95±0.0232.13±3.4460.24±3.8510 070.0±543.2高糖组1.04±0.041.06±0.0425.24±3.0134.99±3.7212 450.0±158.7高糖+3PO组0.65±0.040.71±0.0313.30±2.2419.54±2.928692.0±797.0F值145.39193.349.8228.7146.01P值<0.05<0.05<0.05<0.05<0.05
2.2 各组细胞迁移能力比较各组间细胞迁移率总体比较差异均有统计学意义(均为P<0.05)。与正常对照组相比,高渗组细胞迁移率明显升高(均为P<0.05);24 h高糖组细胞迁移率明显升高(P<0.05),但在48 h高糖组中细胞迁移率升高不明显(P>0.05)。与高糖组相比,高糖+3PO组细胞迁移率明显降低(均为P<0.05)。见表1、图1。
2.3 各组细胞管腔形成能力比较各组间细胞管腔形成长度总体比较差异有统计学意义(P<0.05)。与正常对照组相比,高渗组及高糖组细胞管腔形成能力均明显减弱(均为P<0.05)。与高糖组相比,高糖+3PO组细胞管腔形成能力减弱(P<0.05)。见表1、图2。
2.4 实时荧光定量PCR检测各组HUVEC中PFKFB3 mRNA的相对表达量各组间PFKFB3 mRNA的相对表达量总体比较差异有统计学意义(F=26.00,P<0.05)。与正常对照组相比,高渗组PFKFB3 mRNA的表达水平变化不大(P>0.05),高糖组PFKFB3 mRNA的表达升高(P<0.05)。与高糖组相比,高糖+3PO组 PFKFB3 mRNA的表达明显降低(P<0.05)。见图3。

图1 细胞划痕实验检测各组细胞迁移率
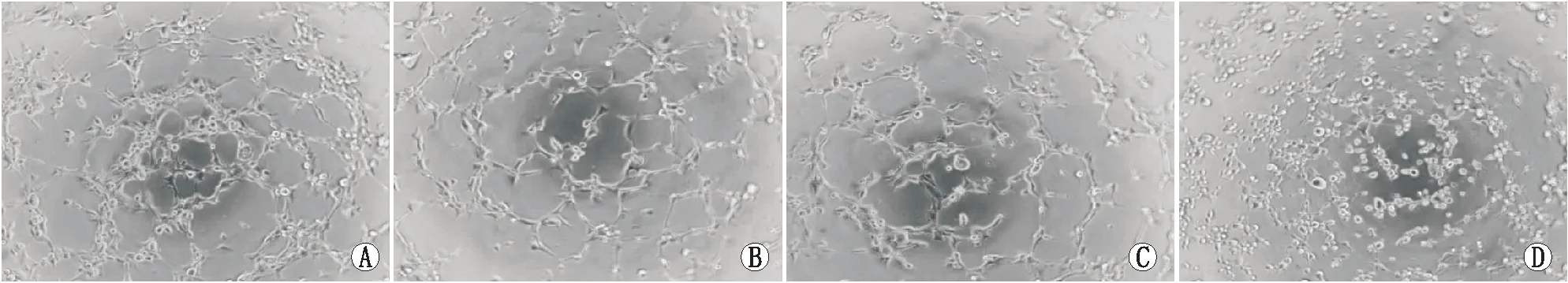
图2 体外管腔形成实验检测各组细胞管腔形成情况。A:正常对照组;B:高渗组;C:高糖组;D:高糖+3PO组
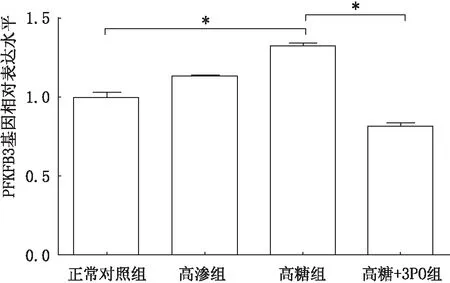
图3 实时荧光定量PCR检测各组HUVEC中PFKFB3 mRNA的相对表达量(*P<0.05)
2.5 Western blot检测各组HUVEC中各蛋白相对表达量各组间p-ERK/ERK蛋白比值及PFKFB3蛋白相对表达量总体比较差异均有统计学意义(p-ERK/ERK:F=11.54,P<0.05;PFKFB3:F=99.81,P<0.05)。与正常对照组相比,高渗组及高糖组中p-ERK/ERK蛋白比值及PFKFB3蛋白表达均升高(均为P<0.05)。与高糖组相比,高糖+3PO组p-ERK /ERK蛋白比值及PFKFB3蛋白表达下降(均为P<0.05)。见图4。

图4 Western blot检测各组HUVEC中各蛋白表达水平
3 讨论
DR是常见的糖尿病微血管并发症,已成为中老年人致盲的重要原因之一,严重影响患者的健康及生活质量[10]。长期慢性高血糖是DR微血管病变发生发展的重要致病因素。长期高血糖可引起局部视网膜组织缺血缺氧,导致视网膜毛细血管周细胞凋亡增加、内皮细胞增殖迁移及基底膜增厚等一系列病理改变,从而使视网膜微血管管腔狭窄。同时高血糖引起的血流动力学改变加重视网膜毛细血管闭塞,进一步加剧视网膜组织缺血缺氧,最终促使视网膜大量新生血管形成[11],导致增生型DR发生[12],甚至出现玻璃体积血、牵拉性视网膜脱离和新生血管性青光眼等并发症,最终导致DR患者失明[4]。目前,视网膜激光光凝、抗血管内皮生长因子药物和玻璃体切割术虽然对DR有一定的疗效,能在一定程度上延缓DR进展,但这些方法费用较高且对视网膜健康组织有一定损伤,治疗后易复发,甚至造成眼部不良反应的发生。因此,进一步寻找相对低廉且安全有效的药物或新靶点来防治DR成为DR的研究热点。
血管内皮细胞的增殖和迁移在新生血管形成过程中至关重要。内皮细胞具有高糖酵解活性,其增殖和迁移所需的大部分能量依赖于糖酵解过程[5]。作为糖酵解关键调节剂的PFKFB3是PFKFB家族的成员之一,具有显著的激酶活性,可正向调节葡萄糖摄取,增加果糖-2,6-二磷酸和乳酸的产量[13]。有研究显示,PFKFB3可增强糖酵解,加速细胞周期,减少细胞凋亡,促进血管生成[5,7,14]以及多种肿瘤生长[15]等,敲除PFKFB3后的内皮细胞在体内外均难以生成血管[6],采用PFKFB3抑制剂 3PO可降低内皮细胞糖酵解速率,抑制内皮细胞增殖和迁移,从而减少血管萌芽[7]。本研究结果显示,3PO抑制PFKFB3后,高糖环境下的内皮细胞增殖、迁移及管腔形成能力明显减弱,几乎不能形成完整管腔,这与Schoors等[7]在肿瘤环境中的研究结果相似,说明当3PO抑制高糖环境下血管内皮细胞糖酵解代谢过程时,新生血管形成能力将明显减弱。
高糖培养血管内皮细胞是体外模拟DR病理状态的常用方式,但高糖环境对内皮细胞增殖、迁移及管腔形成的影响却不尽相同。本研究结果显示,24 h时高糖环境可诱导HUVEC迁移能力升高,但对其增殖能力尚无明显作用;48 h时高糖环境可使HUVEC增殖能力升高,但对其迁移能力却无明显作用,说明在较短时间内高糖环境主要诱导迁移能力升高,在相对长的时间内主要引起增殖能力增强,这与Zhou等[16]研究结果有部分相似之处。本研究表明,高糖及高渗环境均削弱细胞的成管能力,且高糖环境对血管内皮细胞管腔形成能力损伤更大,这与Zhou等[16]及Xing等[17]部分研究结果相似。原因可能与实验条件如细胞的培养代数、葡萄糖处理前的细胞状态、葡萄糖浓度和作用时间等不尽相同有关[18]。大血管内皮细胞与微血管内皮细胞尽管都属于血管内皮细胞,但在高糖环境下细胞功能及表型等存在差异[19]。本研究采用浓度匹配的甘露醇作为高渗透压对照,发现渗透压变化和高糖环境对内皮细胞的迁移、增殖和管腔形成的影响不完全一致,猜测高糖对内皮细胞增殖、迁移及管腔形成的作用少部分由高渗透压引起,但更多的影响是高糖通过调控各种因子的级联反应起作用。
已有研究证实,MAPK/ERK通路促进内皮细胞增殖和迁移,以响应血管内皮生长因子刺激、缺氧等细胞外环境变化,其强效抑制剂PD98059可阻断ERK活化,减弱HUVEC的增殖和迁移能力[20]。本研究结果表明,高糖环境下ERK的活性明显增加,当采用3PO抑制PFKFB3后其活化被明显抑制,从而减弱HUVEC的增殖和迁移能力。有研究表明,PFKFB3在多种肿瘤中表达升高,对肿瘤中新生血管的形成起重要作用[15]。本课题组前期研究表明,增生型DR患者玻璃体和血清中的PFKFB3水平较对照组升高[8],2型糖尿病大鼠视网膜中PFKFB3表达较对照组升高,且PFKFB3主要表达于视网膜的神经节细胞层和内核层[9]。因此,本实验模拟体内高糖环境作用于HUVEC,观察到高糖环境下PFKFB3的mRNA及蛋白表达以及ERK蛋白活性均升高,当采用3PO处理细胞后PFKFB3的mRNA及蛋白表达和ERK蛋白活性则降低,血管内皮细胞的增殖、迁移及管腔形成能力也减弱,说明抑制PFKFB3对高糖环境下血管内皮细胞增殖、迁移及管腔形成能力均有影响,抑制新生血管形成,其作用机制可能与MAPK/ERK信号通路影响有关。

