miR-182靶向调控FOXO3a表达对胶质瘤细胞增殖和侵袭能力的影响
余振兴,邓 磊,张先斌, 胡祖力,祝新根, 吴淼经
神经胶质瘤亦被称为胶质细胞瘤,是颅内最常见的恶性肿瘤之一,约占颅脑肿瘤的50%。按照肿瘤的起源可分为:星形细胞瘤、胶质母细胞瘤、髓母细胞瘤、室管膜瘤及少突胶质细胞瘤[1]。由于胶质瘤细胞所处特殊位置,药物治疗疗效差、手术难度大、易转移、复发[2]。小分子RNA-182(microRNA,miR-182)为编码区序列,通过调控下游基因的转录而影响相关蛋白的表达,影响细胞的增殖、凋亡和分化[3]。研究[4]显示,miR-182在癌细胞组织中高表达。“叉头蛋白”的O亚家族(forkhead, FOXO3a)是由FOXO3基因编码的一类蛋白质,FOXO3a蛋白在肝癌、肺癌、胃癌、前列腺癌、结肠癌、卵巢癌、淋巴瘤、白血病等多种恶性肿瘤细胞中均有表达[5]。该研究通过对胶质瘤U251细胞系中miR-182与FOXO3a的相互作用关系,探讨miR-182通过对FOXO3a蛋白的调控对胶质瘤细胞的增殖与侵袭能力的影响。
1 材料与方法
1.1 主要试剂与仪器胶质瘤细胞U251购自上海中科院细胞所;DMEM高糖培养基、胰酶及脂质体Lipofectamine2000均购自美国Invitrogen公司;胎牛血清及双抗(100 U/ml青霉素与100 g/L链霉素组成)购自美国Gibco公司;FOXO3a一抗(兔抗)购自美国Cell Signaling公司;FOXO3a二抗(羊抗兔)购自北京康为世纪公司;β-action内参购自德国Tiangen公司;BCA蛋白浓度试剂盒、PCR扩增仪购自购自美国Thermo公司;miR-182与抑制剂及逆转录试剂盒购自美国ABI公司;荧光素酶基因检测试剂盒购自美国Promega公司;低温离心机购自德国Eppendoff公司;倒置显微镜购自日本Olympus公司。
1.2 细胞培养与转染向U251细胞与正常人星型细胞分别加入含10%胎牛血清与1%双抗的DMEM高糖培养基溶液,制成悬液,放入培养箱(37 ℃、5% CO2)中培养。待细胞生长至对数期,加入胰酶进行消化,获得U251细胞悬液,按照分组分别加入对照组、无义序列miR-182、miR-182 micmics已整合成功的脂质体,完成细胞转染,继续培养约48 h直至转染成功后的细胞进入对数期。
1.3 构建FOXO3a质粒使用pc DNA3作为空载体质粒,报告强化绿色荧光蛋白(enhanced green fluorescent protein, EGFP)质粒载体,分别将野生型(亦称无干扰型)FOXO3a 3′-非翻译区(untranslated region, UTR)与突变型(亦称过表达型)FOXO3a 3′-UTR序列复制后导入pc DNA3载体,得到无干扰型与过表达型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒。
1.4 进行荧光素酶报告实验将长满瓶底约80%的U251细胞消化后接种于96孔板,正常培养过夜,显微镜下观察,细胞密度超过75%时分别加入:A组突变型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒;B组共转染突变型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒和无义序列;C组共转染突变型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒和miR-182 mimics;D组野生型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒;E组共转染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒和无义序列;F组共转染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒和miR-182 mimics。待质粒与脂质体转染成功后,按照荧光素酶试剂盒操作,测定对应荧光素酶活性。
1.5 Western blot检测FOXO3a蛋白表达收集转染成功后不同处理的U251细胞,得细胞悬液,PBS清洗3次,取下层细胞,加入蛋白裂解液(PMSF与 RIPA按照1 ∶100)提取蛋白;4 ℃、12 000 r/min离心15 min,收集蛋白沉淀;BCA试剂盒测定标准蛋白曲线;按照实验流程配制好分离胶与浓缩胶,依次加入样品,设定电压80 V/120 V;待溴酚蓝出现在胶底附近时,电泳结束;按照胶块、PVDF膜处于正中间,两边依次为三层滤纸、海绵的顺序放置好,进行转膜,持续时间为90 min;使用TBST溶液洗脱3次,边洗边振摇,每次10 min;5%脱脂牛奶封闭结束后,孵育对应1抗过夜,继续TBST洗膜3次,每次10 min,加入对应辣根过氧化物标记的二抗,孵育1 h;选用ECL显影液显影结束后,应用Image J软件进行灰度分析。
1.6 qRT-PCR测定FOXO3a mRNA表达采用TRIzol裂解液快速提取不同处理细胞中mRNA,加入TRIzol溶液与氯仿(5 ∶1)混合液,4 ℃、12 000 r/min离心15 min,得到3个相层;轻轻吸取上层无色含RNA水层,加入等体积异丙醇混匀,离心,保留下层沉淀;加入TRIzol溶液与75%乙醇混合液(1 ∶1),对RNA继续清洗以去除杂质,离心,得到纯度更高的RNA提取物;将EP管倒扣于吸水纸上进行干燥,加入无RNase的水,混合均匀后备用。依次加入2 μl 10×RT工作液、4 μl 25 mmol/L MgCl2、2 μl 0.1 mol/L DTT、1 μl RNaseOUT(40 U/μl)、1 μl SuperScript RT(200 U/μl)合成引物序列,按照预变性95 ℃、10 min;变性95 ℃、15 s;退火56 ℃、60 s;延伸72 ℃、32 s程序设置PCR扩增。选用GAPDH作为内参。引物序列见表1。
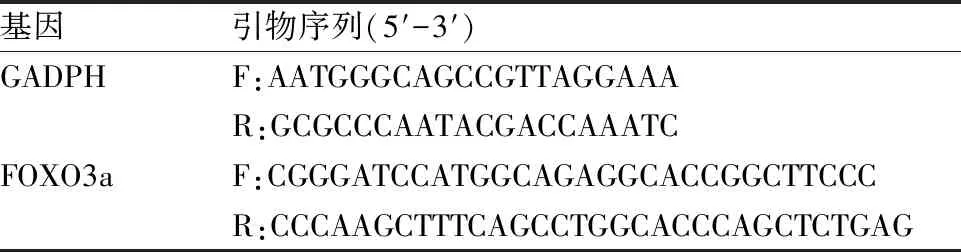
表1 基因GADPH、FOXO3a引物序列
1.7 MTT法测定细胞增殖将正常U251细胞与转染siRNA-miR-182、miR-182 mimics及过表达FOXO3a成功的细胞进行培养,48 h后收集细胞,制备细胞悬液,按照3 000~8 000个/孔进行96孔板点板,每种设6个复孔;培养箱继续培养1~5 d后,每孔加入20 μl MTT溶液,继续培养4 h,加入100 ml DMSO,摇床低速振荡10 min,酶标仪490 nm处测定吸光度值。
1.8 Transwell法测定细胞侵袭能力将转染不同处理的细胞分别接种于Transwell上室(有/无Metrigel胶),下室为含10%胎牛血清的完全培养液,培养36 h后,苏木精染色封片,测定穿过孔的细胞数目。
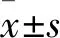
2 结果
2.1 MTT法测定转染miR-182对U251增殖能力的影响培养第1天,各组转染后的U251细胞增殖数量差异无统计学意义(P>0.05);培养第2~3天,与对照组及无义序列组比较,转染miR-182 mimics组细胞数显著增加(P<0.01);第3~5天,miR-182 mimics组细胞数虽有减小,但与对照组及无义序列组比较,其细胞数量仍呈显著性增加(P<0.05)。第1~5天,无义序列组U251细胞,细胞数量开始呈增加趋势后逐渐减少;与对照组细胞数比较,无义序列组细胞数无显著变化(P>0.05)。见图1。
2.2 Transwell法测定转染miR-182对U251侵袭能力的影响3组间穿过小室的细胞数差异有统计学意义(P<0.05);与对照组比较,miR-182 mimics组穿过小室细胞数显著增多(t=5.577,P=0.005)。见表2、图2。
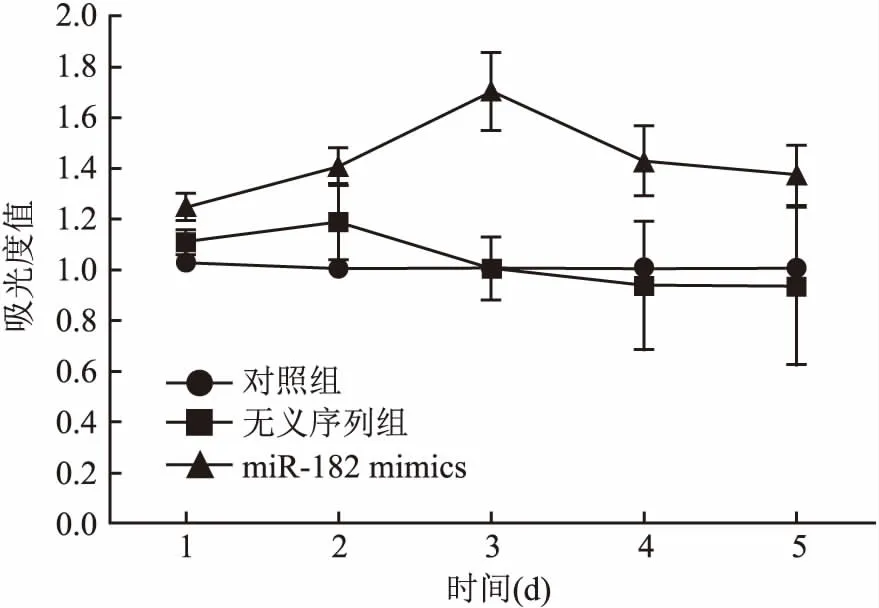
图1 MTT法测定转染miR-182 U251细胞的增殖能力

组别细胞数对照36.9±3.4无义序列34.6±2.7miR-182 mimics54.3±4.2F值6.551P值<0.05
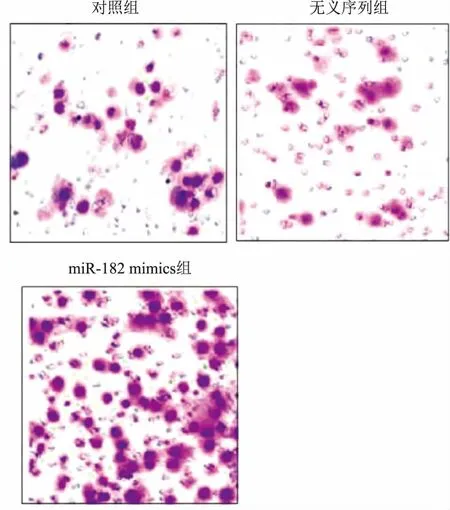
图2 Transwell法测定转染miR-182对U251侵袭能力的影响×100
2.3 荧光素酶活性验证结果经Microma/miRBase/TargetScan靶基因数据库筛选,将FOXO3a暂定为miR-182调控的下游靶基因。经荧光素酶报告实验验证,A ~E组荧光素酶对应活性,见图3;两两比较,差异有统计学意义(P<0.05),miR-182 mimics与pc DNA3/ EGFP-FOXO3a 3′-UTR共转染组(C组)荧光素酶活性明显较其他组低(P<0.01),证实miR-182可抑制突变型质粒的荧光素酶活性,FOXO3a是miR-182调控的直接作用靶点。
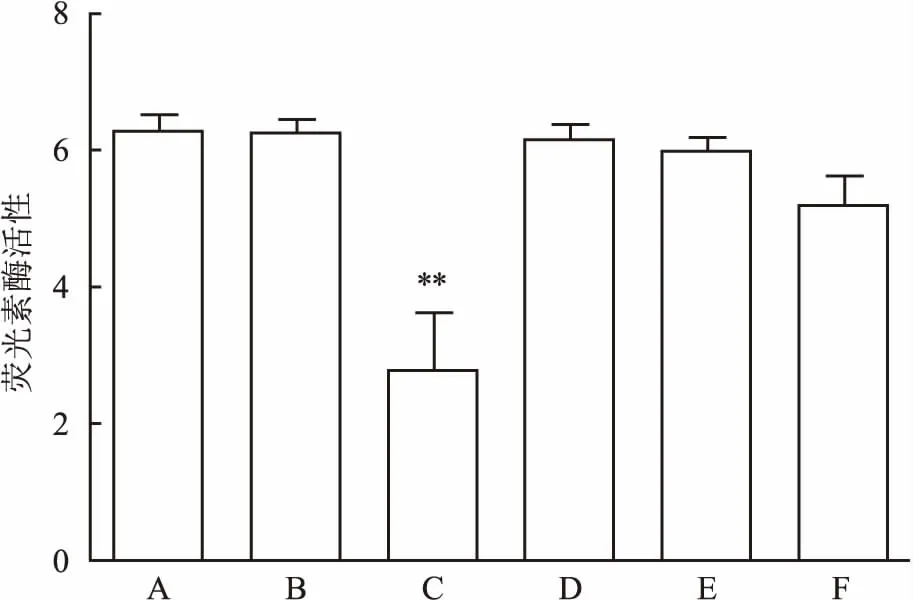
图3 荧光素酶活性验证结果
A组:突变型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒; B组:共转染突变型pc DNA3/ EGFP -FOXO3a 3′-UTR质粒和无义序列; C组:共转染突变型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒和miR-182 mimics; D组:野生型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒; E组:共转染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒和无义序列; F组:共转染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR质粒和miR-182 mimics;与A组比较:**P<0.01
2.4 转染miR-182后U251细胞内FOXO3a的蛋白表达情况Western blot 检测FOXO3a蛋白的表达,3组之间差异有统计学意义(F=13.128,P<0.05);与对照组比较,miR-182 mimics组FOXO3a蛋白含量显著降低(P<0.05)。在qRT-PCR实验中,3组之间差异有统计学意义(F=17.227,P<0.05);与对照组比较,miR-182 mimics组FOXO3a mRNA含量显著降低(P<0.05)。见图4。
2.5 突变型FOXO3a干扰U251细胞增殖与迁移变化与野生型FOXO3a干扰U251细胞组比较,MTT实验测定第1~3天,突变型组细胞数显著增加(P<0.05);第4~5天,突变型组细胞数有减小趋势,与野生型组比较,其细胞数仍显著偏多(P<0.05)。在Transwell小室实验中,培养36 h后,与野生型组穿过细胞数(37.8±2.8个)比较,突变型组穿过小室的细胞数(25.2±2.64个)显著减少(P<0.05)。见图5。
3 讨论
胶质瘤是中枢神经系统细胞异常增殖与转移引起的恶性肿瘤之一,约占中枢神经系统肿瘤的3/5[6]。胶质瘤细胞极易向周围浸润,导致胶质瘤手术切除难度大,术后易出现复发;尽管随着现代科学技术的进步,胶质瘤患者的5年生存率仍然低至5%[7]。生命体的正常生长发育得益于基因精准的、多方位的整体调控。无论是基因本身的碱基序列发生微小改变,还是非编码区的调控序列发生异常,都会使机体的生理活动发生异常,这种异常超出机体的自我调节承受范围,即出现病理状态。miRNAs是一类自身无法直接表达蛋白质、可对下游基因蛋白质表达进行调控的小分子密码子[8]。有研究[9]者提出,下游靶mRNA的3′UTR为调控miRNA的主要结合位点。如miRNA-663可通过调控下游靶基因转移生长因子-β抑制胶质瘤细胞的增殖、转移与侵袭;miRNA-506可调控下游靶基因胰岛素样生长因子2 mRNA的结合蛋白1抑制胶质瘤细胞的增殖[10-11]。miR-182为miR-183-96-182家族一员,位于人类第7号染色体,被证实为具有癌基因功能。在多种胶质瘤细胞信号通路中均显示miR-182扮演着重要角色,Feng et al[12]证实miR-182过表达可调控神经突起生长素(neuritin,NRN1)基因与NRN1蛋白表达从而控制胶质瘤细胞的增殖与转移;Xue et al[13]等证实miR-182-5p的促进与抑制均可激活信号转导转录激活因子3信号通路,从而调控胶质母细胞瘤的增殖与迁移。本研究中,对对照组、无义序列组、miR-182 mimics组的U251细胞进行培养后显示,与其他两组比较,转染miR-182 mimics组的U251细胞增殖速度明显加快,提示miR-182可促进胶质瘤U251细胞的生长;在进行Transwell小室实验显示,转染miR-182 mimics组的U251细胞穿过小室的细胞数明显较其他两组多,提示miR-182可促进胶质瘤U251细胞的转移;经荧光素酶活性实验验证,miR-182 mimics与pc DNA3/ EGFP-FOXO3a 3′-UTR共转染组(C组)荧光素酶活性明显较其他组低,证实FOXO3a是miR-182调控的直接作用靶点。
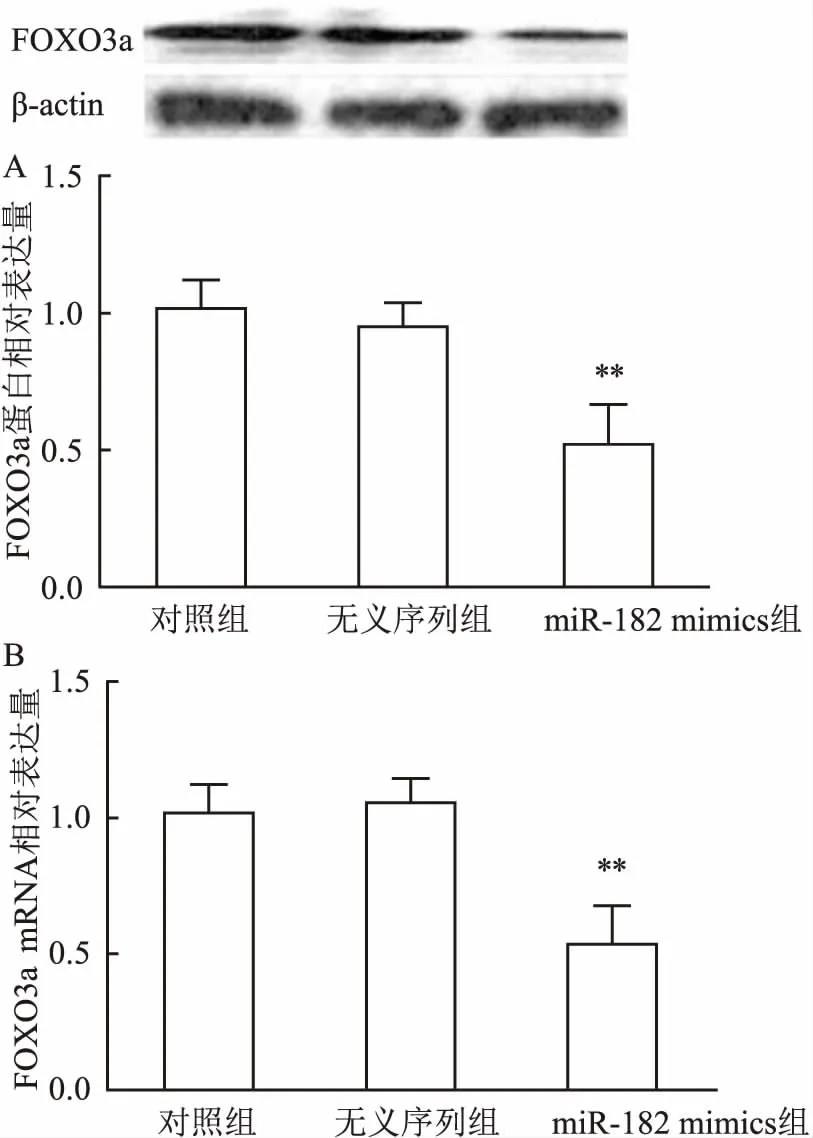
图4 转染miR-182后U251细胞内FOXO3a的
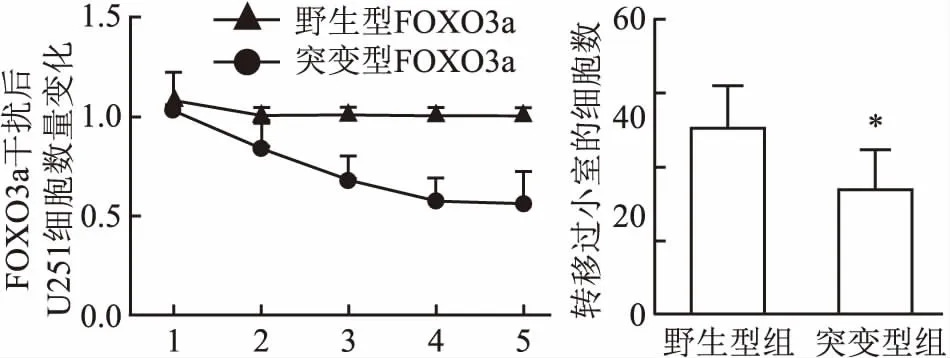
图5 突变型FOXO3a干扰U251细胞增殖与迁移变化与野生型组比较:*P<0.05
FOXO3a是分子量为75 ku的蛋白质,含有高度保守的翼螺旋结构域,可被磷酸化或乙酰化激活。FOXO3a蛋白已被证实在受到蛋白激酶B与核因子κB激酶β的抑制剂等修饰激活后,其活性发生改变,可参与肿瘤细胞的生长与增殖。p53是一种重要的抑癌基因,当受到外界刺激时,FOXO3a与p53可相互促进以抑制肿瘤细胞的生长,且被证实二者为协同作用[14]。为近一步探讨miR-182对FOXO3a调控趋势,本研究选用脂质体进行转染,使FOXO3a进入突变状态,在体内过表达,结果显示:与对照组比较,进入FOXO3a蛋白突变状态的U251细胞增殖速度与侵袭速度均显著减小,突变状态U251细胞中miR-182的mRNA含量显著减小。

