TPD52L1(D53)蛋白在膀胱尿路上皮癌中的表达和预后
戴 维,梁朝朝,2,3,张 力,2,3,陈先国,2,3,邰 胜,2,3,尹 玉,徐雨辰,2,3,汪 赛
膀胱癌是泌尿生殖系统常见恶性肿瘤,目前膀胱癌全球发病率排名第9位。2015年,全球约有541 000例膀胱癌事件,其中188 000例死亡,每59例男性中有1人在79岁之前被诊断出膀胱癌,而女性中约每239人有1人确诊[1]。在我国,膀胱癌发病率排名13位,死亡率排名14位,均居于泌尿系肿瘤首位[2]。膀胱癌由于局部浸润易转移、术后高复发率的特点[3],其筛查诊断、预后评估、复发监测是治疗的重要环节,针对膀胱癌的发生的发展分子机制和对诊断预后监测新手段的研究一直是泌尿外科研究的重点。
TPD52L1已被认为是一种新的乳腺癌治疗靶点,并在多种肿瘤中检测到其高表达。但其在泌尿系肿瘤中的表达水平和生理作用尚未见报道。该研究使用免疫组织化学(二步法)和半定量免疫反应评分(IRS评分)量化TPD52L1在膀胱癌中的表达,评估其与临床和病理特征的潜在关联。根据疾病特异性生存期测试TPD52L1的表达水平对膀胱尿路上皮癌预后的影响。
1 材料与方法
1.1 病例资料回顾性分析2013~2017年安徽医科大学第一附属医院泌尿外科收治的膀胱癌患者临床资料,纳入标准:① 病理证实为膀胱尿路上皮癌;② 行根治性膀胱切除术;③ 术前未接受治疗的初发膀胱癌。排除标准:① 临床资料不完整;② 随访记录缺失;③ 合并其他恶性肿瘤。符合纳入标准的患者共计72例,其诊断年龄为38~86岁,中位数66岁(四分位距61.25~74.00);随访时间为3~44个月,中位数17个月(四分位距11.25~26.00),其余资料特征见表1。调取患者腊块制切片行免疫组化分析,使用癌旁组织作为对照。该研究中所有患者知情同意,标本按照道德规范和法律标准处理并匿名。组织学分级采用WHO2004膀胱尿路上皮癌恶性程度分级系统,肿瘤分期采用国际抗癌联盟(UICC)2009TNM分期法。
1.2 免疫组织化学染色
1.2.1主要试剂和仪器 膀胱癌组织切片由安徽医科大学第一附属医院病理科统一制作。烤箱使用上海一恒科学仪器有限公司的电热鼓风干燥箱,一抗使用武汉三鹰生物技术有限公司的TPD52L1抗体(兔抗人,编号14732-1-AP ),二抗使用北京中杉金桥公司的兔二步法试剂盒(山羊抗兔,编号PV-6001),DAB工作液使用北京中杉金桥公司的浓缩型DAB试剂盒,黏附载玻片及显微镜盖玻片均购自江苏世泰公司。
1.2.2实验方法 切片经脱蜡水化后,使用0.01 mol/L柠檬酸盐缓冲液(pH 6.0)微波辐射行抗原修复。去除内源性过氧化物酶方法为切片置于按 1 ∶9 配置的3%过氧化氢与甲醇溶液中室温下反应12 min,使用2% BSA+1% Triton+97% PBS封闭液封闭1 h,使用1% BSA将TPD52L1兔抗浓度稀释至1 ∶50作为一抗工作液,置于湿盒中4 ℃过夜。二抗反应工作液来自兔二步法试剂盒,室温反应1 h后,使用1 ∶20 DAB稀释液显色,置于显微镜下观察,按出现阳性棕色且棕色不再增加,背景为无色的原则,根据多次实验结果将显色时间统一定为5 s,之后放入去离子水中终止反应。随后经复染脱色反蓝脱水封片,封片剂为中性树脂与二甲苯1 ∶1混合物,晾干后观察结果。
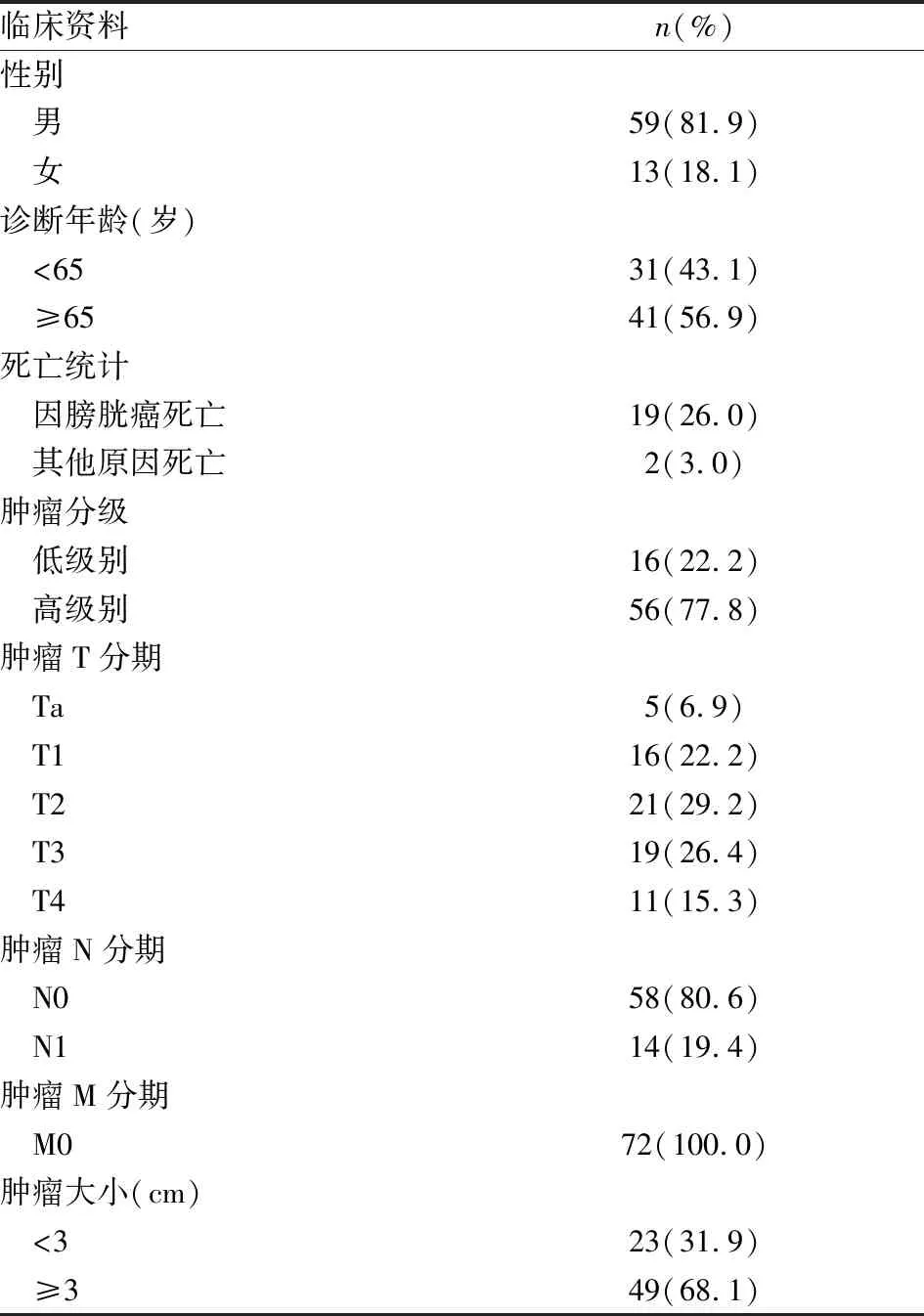
表1 膀胱尿路上皮癌患者资料
1.3 免疫组化评分使用半定量免疫反应评分(IRS评分)对所有免疫组织化学染色进行评分,按染色强度[0(无染色反应)、1+(弱染色反应)、2+(中等染色反应)、3+(强染色反应)]和阳性染色细胞的百分比[0(0)、1(<10%)、2(10%~50%)、3(51%~80%)、4(>80%)]相乘得出IRS值(0~12)[4]。上述评分由两位高年资病理医师分别作出,总结果差异无统计学意义,评分不同个例选取了IRS评分较大的一方。
1.4 统计学处理采用SPSS 22.0软件进行分析,排除2例意外死亡病例,以手术治疗开始到因疾病而死亡的时间作为疾病特异性生存期(disease specific surivial,DSS),使用ROC曲线将T分期和IRS评分各分为两组,组间比较选用χ2或Fisher确切概率法,单因素生存分析使用Kaplan-Meier法和Log Rank检验,多因素生存分析使用Cox回归模型,以P<0.05为差异有统计学意义。
2 结果
2.1 IRS评分和T分期的分组通过ROC曲线将IRS评分分为高表达组和低表达组。结果显示最佳分界点为7,曲线下面积为0.730,P=0.002,95%CI:0.595~0.865(图1A),定义IRS评分高于最佳分界点(7)的为高表达组,小于最佳分界点的为低表达组。由于总样本量较小,肿瘤T分期分组相对过多,同样采用ROC曲线分析,结果显示最佳分界点为2.5,曲线下面积为0.871,P<0.001,95%CI:0.787~0.954(图1B),定义大于最佳分界点(2.5)的值为≥T3组(T3、T4),小于最佳分界点的值为≤T2组(T0、T1、T2),病理上体现为按肿瘤是否突破膀胱全层分为2组。
2.2 TPD52L1在膀胱癌中的表达免疫组化结果显示94.4%的膀胱尿路上皮癌中TPD52L1呈阳性表达,而周围正常尿路上皮细胞均呈阴性。其中IRS评分小于7的阳性为低表达组,IRS评分高于7的为高表达组,见图2 。
2.3 TPD52L1表达与临床病理特征的相关性分析使用χ2检验对各组资料分析,结果表明,TPD52L1的表达水平与膀胱尿路上皮癌患者的性别(P=0.054)、诊断年龄(P=0.208)、肿瘤分级(P=0.377)、肿瘤N分期(P=0.154)、肿瘤大小(P=0.944)无明显相关性,而与肿瘤是否突破膀胱全层有明显相关性(P=0.001),见表2。
2.4 单因素生存分析通过Kaplan-Meier法进行单因素生存分析,潜在的混杂变量包括性别、诊断年龄、TNM分期、肿瘤病理分级和肿瘤大小,结果显示在膀胱癌中,膀胱尿路上皮癌特异性生存率与TPD52L1表达强度(P=0.001,Log Rank检验)、肿瘤是否突破膀胱全层(P<0.001)、N分期(P<0.001)、病理分级(P=0.020)有明显相关性,而诊断年龄(P=0.332)、性别(P=0.376)、肿瘤大小(P=0.294)无明显相关性,生存函数见图3。

图1 ROC曲线图
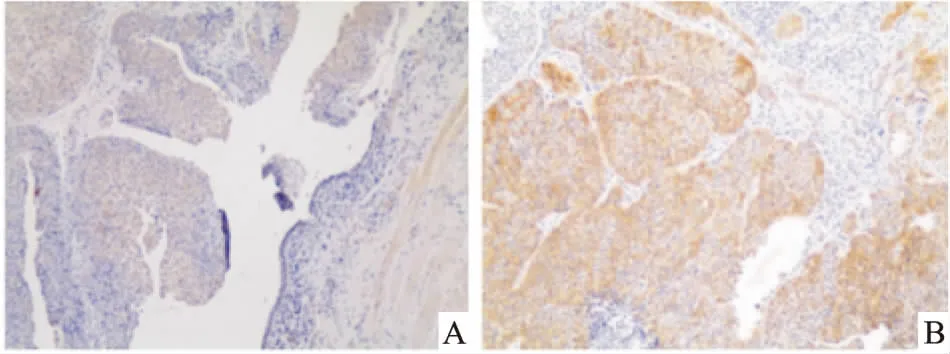
图2 膀胱尿路上皮癌及癌旁正常组织中的TPD52L1表达 ×100
A:左侧为TPD52L1低表达的膀胱尿路上皮癌细胞,右侧可见呈阴性的部分正常尿路上皮细胞;B:视野内大量高表达TPD52L1的膀胱尿路上皮癌细胞,右上方有部分呈阴性的正常尿路上皮细胞
2.5 多因素生存分析目前公认的非肌层浸润性膀胱癌预后主要危险因素包括高病理分期、高级别尿路上皮癌、≥3 cm的肿瘤、肿瘤数量≥8个、复发频率大于1次/年和伴随原位癌;肌层浸润性膀胱癌预后主要危险因素是肿瘤浸润深度和淋巴结情况。根据单因素分析结果,使用Cox回归进行多因素生存分析,见表3。
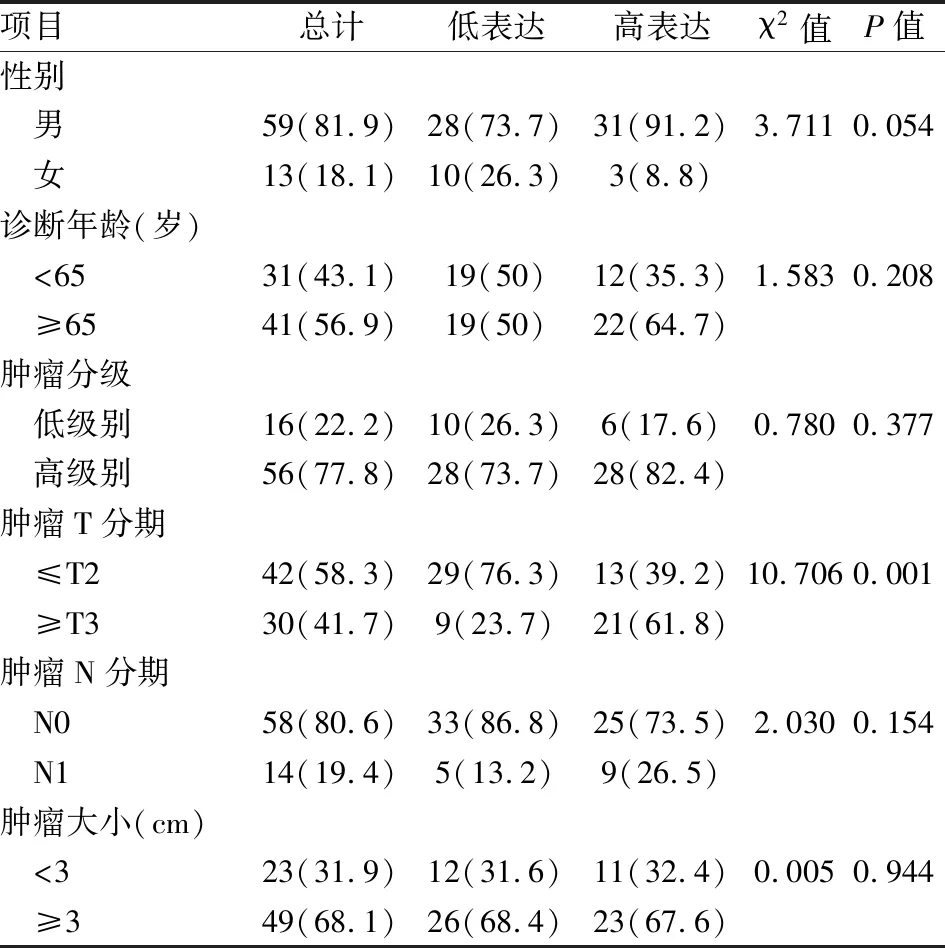
表2 临床病理特征的χ2检验结果[n(%)]
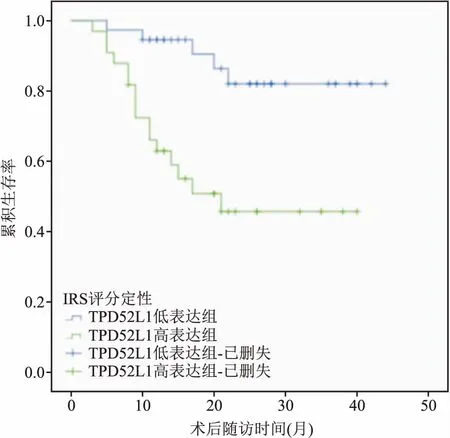
图3 TPD52L1高、低表达组的DSS生存曲线
3 讨论
TPD52L1分子是肿瘤蛋白家族D52(tumor protein D52,TPD52)的成员之一,该家族蛋白特征结构是N端具有相类似的双股卷曲螺旋结构,成员包括TPD52(又称D52、PrLZ、PC-1)、TPD52L1(TPD53、D53)、TPD52L2(TPD54、D54)和TPD52L3(TPD55、D55)。第1个D52样基因被鉴定已过了二十多年,其表达的同名蛋白家族成员间可以相互作用[5],功能涉及细胞增殖、细胞凋亡和囊泡运输。其中研究最多的是D52,早期研究[6]显示D52最常见的生理作用是调节囊泡运输和外部细胞分泌,通过响应胃壁或胰腺腺泡细胞的分泌刺激而磷酸化。研究表明其在多种癌组织中过表达如乳腺癌[7]、卵巢癌[8]、结直肠癌[9]、前列腺癌等。D52在前列腺癌中研究较多,结果显示其可显著降低前列腺癌细胞G0/G1 比例并增加S期细胞比例,促进细胞周期进程;抑制雷帕霉素诱导的细胞自噬(可能是通过显著促进PI3K家族激酶mTOR蛋白下游分子4E-BP1水平升高及对细胞周期相关蛋白的调节);通过wnt/beta-catenin途径促进c-myc基因在前列腺癌细胞中的表达,并促进前列腺癌向激素抵抗型进展;通过磷酸化Akt/Stat3并上调Bcl-2表达,抑制低雄激素水平诱导的前列腺癌细胞凋亡过程,进而促进肿瘤进展为激素难治性前列腺癌[10]。最新研究显示在鼻咽癌[11]和宫颈癌[12]细胞的体外实验中抑制TPD52可抑制细胞增殖,诱导细胞凋亡。

表3 DSS的多因素生存分析
关于TPD52L1的研究较少,这种TPD52样蛋白是卷曲螺旋基序蛋白,首先通过其在人乳腺癌中的表达被鉴定出来,在结肠癌、卵巢癌和乳腺癌细胞系中表达强烈,被认为代表信号中间体和囊泡运输的调节剂。TPD52L1可与其他TPD52家族成员形成同源二聚体或异二聚体[5],并参与细胞增殖和钙信号传导。有报道称其在体外增加了突触融合蛋白1和VAMP2蛋白之间的相互作用,而最重要的研究结果显示其在乳腺癌中高表达并被认为是乳腺癌细胞中的细胞周期调节蛋白,TPD52L1的表达在乳腺癌细胞的G2-M转换时特异性地显著上调,并且在G2至早前期的细胞中达到最大值,这与细胞周期蛋白B1表达呈平行关系,而其在中期降至几乎间期水平,并且其表达在转录后和翻译后水平均受到调节,这表明TPD52L1表达在有丝分裂期间受到严格调节。此外,富集的G2-M转换细胞显示TPD52L1和14-3-3之间的相互作用增加,这是一种负调节G2-M转换的衔接蛋白[13-14]。考虑TPD52L1作为与D52结构相似且可互相作用的蛋白家族成员,其在泌尿生殖系肿瘤中或存在高表达情况,本研究选用膀胱癌进行实验,通过二步法免疫组化检测到94.4%的膀胱尿路上皮癌中有TPD52L1的表达,而周围正常尿路上皮细胞普遍呈阴性,随后行IRS评分并用ROC曲线分为高、低表达组,使用χ2检验分析各组资料显示TPD52L1表达水平与肿瘤是否突破膀胱全层相关,之后本研究用单因素生存分析显示膀胱尿路上皮癌的特异性生存率与TPD52L1的表达强度有明显相关性,研究最后通过根据多因素生存分析证实了TPD52L1的高表达与肿瘤突破膀胱全层、已有淋巴结转移、病理分级为高级别一样可作为膀胱尿路上皮癌预后的独立风险因子,而后三者是公认的膀胱癌预后主要危险因素。
总之,本研究显示膀胱尿路上皮癌组织中TPD52L1的表达明显高于正常膀胱尿路上皮组织中的表达,其表达水平的高低与癌组织是否突破膀胱全层相关,并且随着其表达水平的增高,其疾病特异性死亡率上升。本实验研究价值主要在于:① TPD52L1作为膀胱尿路上皮癌预后的独立危险因素,有望成为新的膀胱癌预后标志;② 术前活检若发现为高表达TPD52L1的膀胱尿路上皮癌,提示肿瘤很大可能已突破膀胱全层。本实验不足之处在于总样本数较少,其临床作用需待进一步验证。

