中性-淋巴细胞比和预后营养指数在膀胱癌根治术患者预后评估中的价值
汪 赛,梁朝朝,2,3,周 骏,2,3,施浩强,2,3,杨 诚,2,3,王建忠,2,3
膀胱癌是临床上常见的泌尿系统恶性肿瘤之一,其发病率位于全身恶性肿瘤的第9位,死亡率位于第13位[1]。根治性膀胱切除术是重要的手术方式,适用于肌层浸润性膀胱癌、高级别T1期肿瘤,多发复发的高级别肿瘤等[2]。患者预后受多种因素的影响,先前研究[3-4]表明系统性炎症反应和免疫状态的改变与肿瘤的发生发展有关。中性粒细胞-淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)作为系统性炎症反应的有效指标之一,有研究[5-6]证实其与多种肿瘤的预后相关,如胃癌、肺癌等。预后营养指数(prognostic nutritional index,PNI)最早是用来评估外科手术患者的营养状况、手术风险及术后并发症,目前研究[7-8]显示PNI与多种肿瘤的预后情况有关,是判断预后的有效指标。该研究通过联合检测NLR和PNI,来探讨其在膀胱癌根治术患者预后评估中的价值。
1 材料与方法
1.1 病例资料回顾性分析2012年1月~2017年11月安徽医科大学第一附属医院泌尿外科收治的膀胱癌患者临床资料。纳入标准:① 病理证实为膀胱癌;② 行根治性膀胱切除术;③ 术前无感染、血液系统疾病等影响血常规的因素。排除标准:① 临床资料不完整;② 无随访记录;③ 围手术期出现严重并发症;④ 术前接受放化疗。符合纳入标准的患者共213例,收集患者的临床病理资料:性别、年龄、吸烟史、高血压史、糖尿病史、有无肾积水、肿瘤分期、肿瘤大小、肿瘤是否多发、脉管有无癌栓、组织学分级、淋巴结有无转移等。其中男182例,女31例,年龄38~86(64.95±10.02)岁;病理类型:尿路上皮癌199例,鳞癌5例,腺癌4例。
1.2 研究方法所有患者在术前1周内抽查血常规和生化,按照以下公式进行计算:NLR=外周血中性粒细胞数/淋巴细胞数;PNI=血清白蛋白(g/L)+5×外周血淋巴细胞数(×109/L)。根据受试者工作特征曲线(ROC曲线)确定NLR和PNI的最佳分界点,分为高低两组。
1.3 随访情况采用电话随访或门诊随诊,术后第1~2年每3~6个月随访1次,之后每6~12个月随访1次。随访内容包括血常规、生化、胸片、腹盆腔超声或CT。生存时间起点为手术日期,终点为死亡日期、失访日期或随访至2018年7月。
2 结果
2.1 NLR和PNI高低组分界点确定NLR的ROC曲线下面积0.665,P<0.001,最佳分界点为2.89,敏感度63.1%,特异度70.5%,约登指数0.336;PNI的ROC曲线下面积0.626,P=0.002,最佳分界点为46.08,敏感度79.8%,特异度42.9%,约登指数0.227。根据最佳分界点将患者分为高NLR组(NLR≥2.89)和低NLR组(NLR<2.89);高PNI组(PNI≥46.08)和低PNI组(PNI<46.08)。
2.2 NLR和PNI与膀胱癌患者临床病理特征的关系在213例膀胱癌患者中,NLR两组之间在性别、年龄、吸烟史、高血压、糖尿病、组织学分级、淋巴结转移、脉管癌栓上的差异无统计学意义(P>0.05);在病理T分期、肿瘤大小、是否多发上差异有统计学意义(P<0.05)。PNI两组患者在性别、高血压、糖尿病、组织学分级、病理T分期、淋巴结转移、脉管癌栓、肿瘤大小、是否多发上的差异无统计学意义(P>0.05);在年龄、吸烟史上差异有统计学意义(P<0.05)。见表1。
2.3 预后的单因素及多因素分析本研究的随访时间为2~78个月,平均生存时间为(28.62±20.52)个月,1、3、5年生存率分别为82%、57%、48%。通过Cox比例风险模型对影响患者无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)的因素进行分析。Cox单因素分析显示,年龄(OS:P=0.021)、肾积水(PFS:P<0.001,OS:P<0.001)、组织学分级(PFS:P=0.001,OS:P<0.001)、病理T分期(PFS:P<0.001,OS:P<0.001)、脉管癌栓(PFS:P<0.001,OS:P=0.001)、淋巴结转移(PFS:P=0.001,OS:P=0.009)、肿瘤大小(PFS:P=0.048)、NLR(PFS:P<0.001,OS:P<0.001)、PNI(PFS:P=0.001,OS:P<0.001)与膀胱癌根治术后患者PFS或OS密切相关(P<0.05)。为了排除各因素之间的相互影响,将单因素分析中有意义的变量纳入多因素分析,结果显示肾积水(P=0.014)、组织学分级(P=0.043)、病理T分期(P<0.001)、NLR(P=0.023)、PNI(P=0.038)是影响患者PFS的独立危险因素(表2)。年龄(P=0.029)、肾积水(P=0.002)、组织学分级(P=0.009)、病理T分期(P<0.001)、NLR(P=0.008)、PNI(P=0.012)是影响患者OS的独立危险因素(表3)。通过Kalpan-Meier法构建NLR和PNI的生存曲线(图1),提示NLR≥2.89及PNI<46.08预示膀胱癌根治术患者的预后较差。
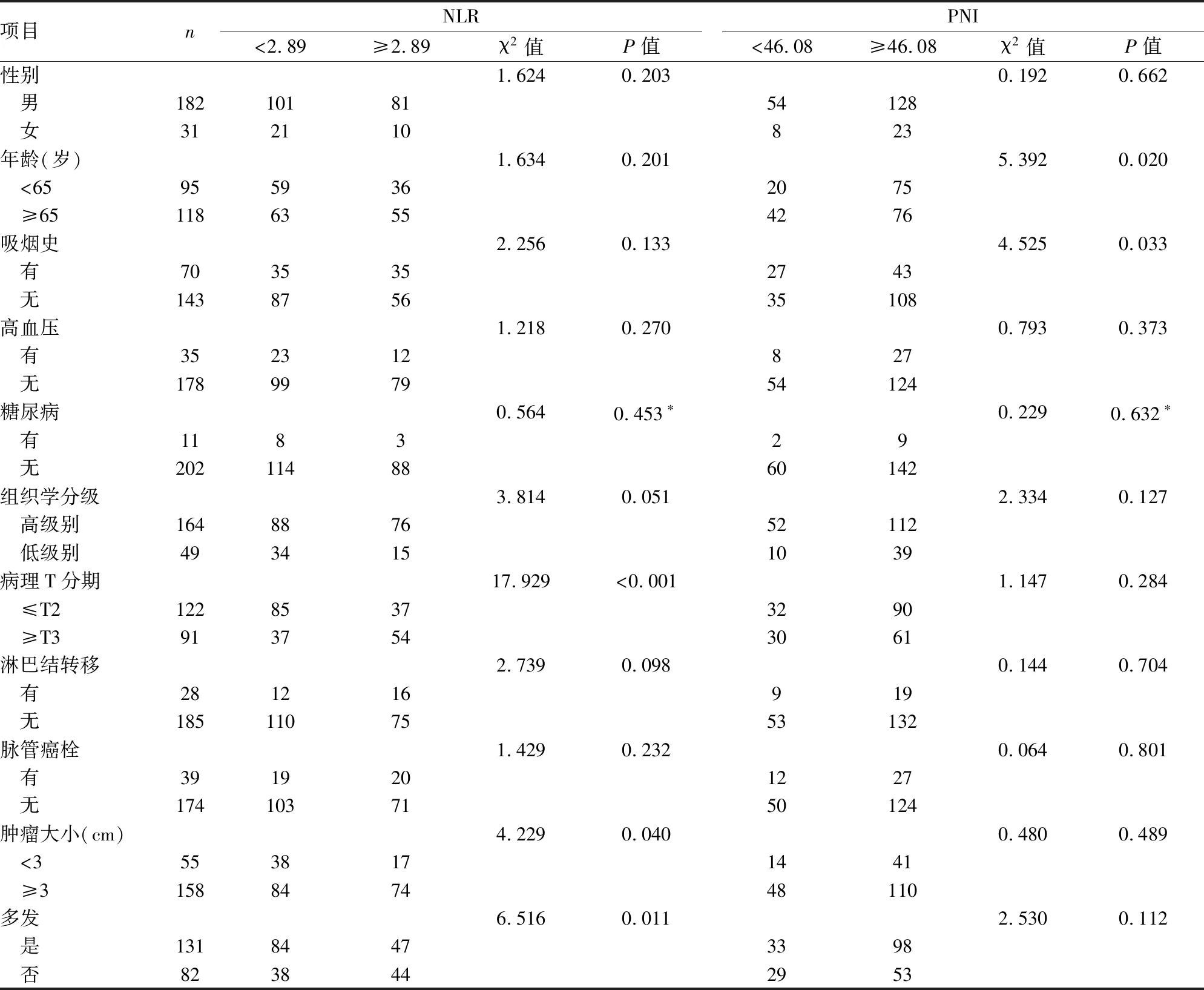
表1 NLR和PNI与膀胱癌患者临床病理特征的关系
*采用连续矫正
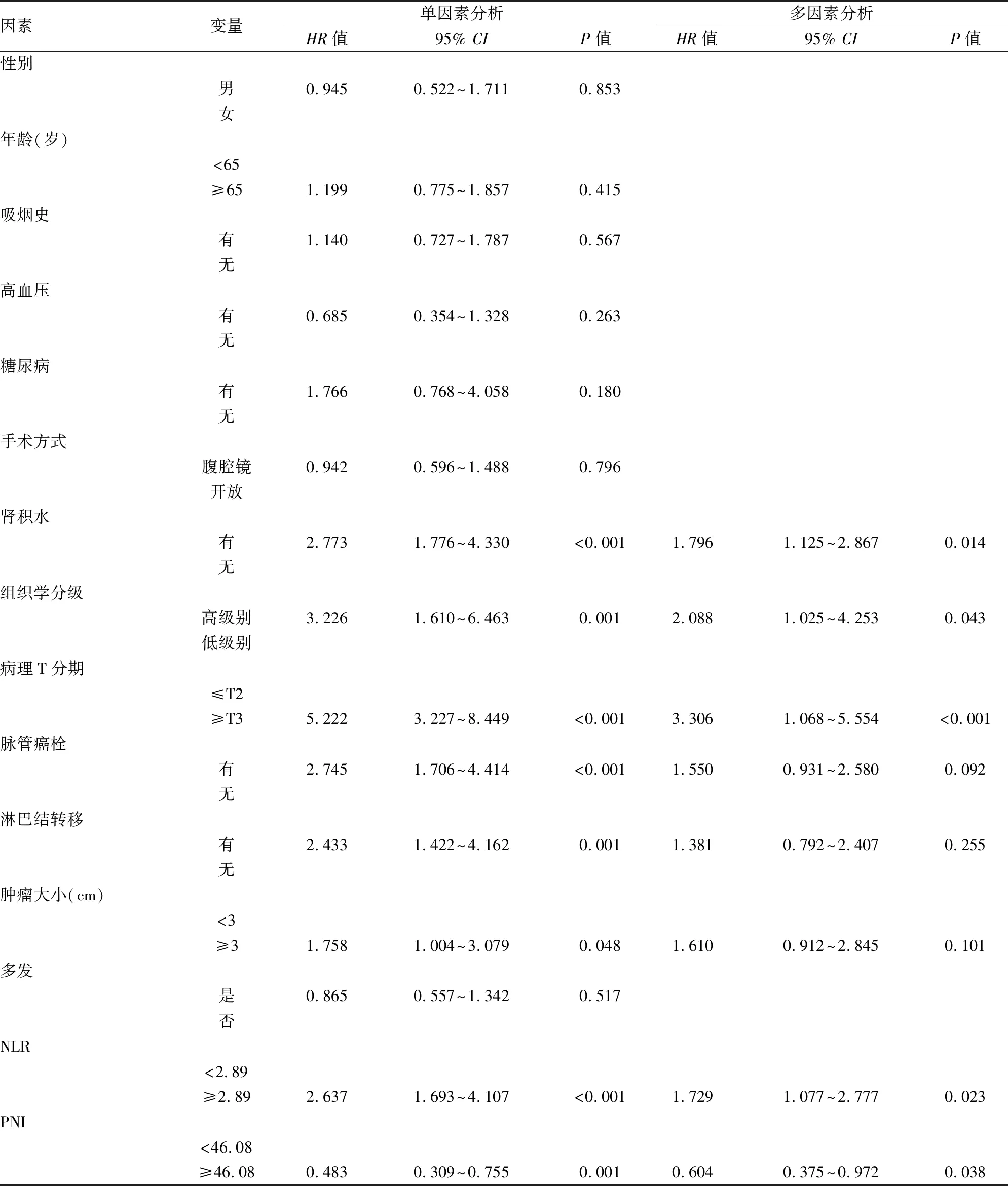
表2 PFS的单因素及多因素分析
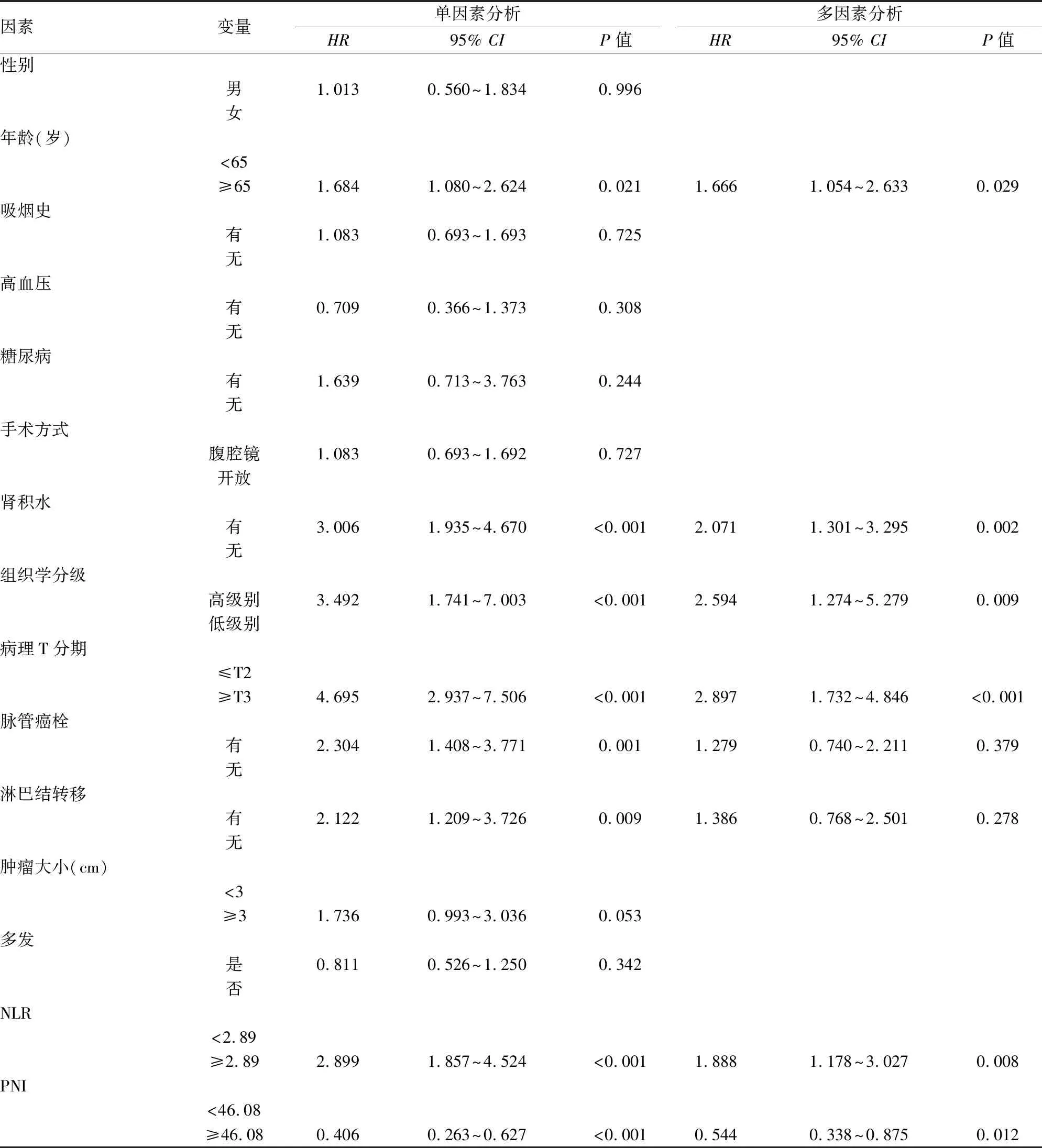
表3 OS的单因素及多因素分析
3 讨论
越来越多的证据表明,肿瘤的发生、发展、转移与全身炎性反应及机体免疫状态有关[3-4],NLR作为系统性炎症反应的有效指标,其升高代表着中性粒细胞计数升高和(或)淋巴细胞计数降低。肿瘤可以表达许多趋化因子、细胞因子参与中性粒细胞的募集[9],而中性粒细胞可以通过产生可溶性因子、蛋白酶来增强肿瘤生长,以及通过产生血管生长因子促进肿瘤血管生成,此外中性粒细胞可以抑制效应T细胞和NK细胞等功能,促进肿瘤生长和转移[10]。当机体淋巴细胞计数降低时,也预示着机体>免疫功能下降、对肿瘤的免疫监视作用减弱,使肿瘤更加容易转移。因此NLR可以反映机体系统性炎症反应与免疫功能,可以作为判断肿瘤患者预后的指标。
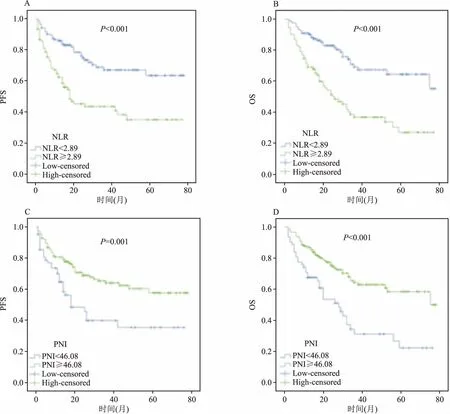
图1 NLR和PNI与患者预后的生存曲线
本研究中,NLR的高低与患者病理T分期有关,高NLR组比低NLR组具有更高的肿瘤浸润深度,病理分期较晚。Tang et al[11]研究表明,NLR与膀胱癌患者的组织学分级有关,高级别膀胱癌比低级别膀胱癌有着更高的NLR,而本研究中,NLR与肿瘤级别高低无明显相关性。在既往NLR对膀胱癌患者预后的研究中,Rajwa et al[12]分析了144例胱癌患者,认为高NLR(≥3.0)患者术后肿瘤特异性生存期和总生存较短、预后较差。本研究通过对患者预后进行多因素分析,结果显示NLR与患者的PFS及OS相关,高NLR提示患者预后较差,提示NLR可以用于判断膀胱癌患者术后的预后。
PNI最初是用来评估患者的营养状况、手术风险及并发症。Onodera et al[13]经过修改,通过血清白蛋白和外周血淋巴细胞计数来进行计算。PNI反映了机体的营养和免疫状态,恶性肿瘤是消耗性疾病,在发生发展过程中会导致机体营养不良。Tobert et al[14]认为,营养不良不仅可以导致免疫功能障碍,而且增加了围手术期的并发症,对患者术前进行营养补充可降低患者并发症。本研究中PNI与患者年龄相关,可能由于高龄患者本身机体脏器功能降低、生理机能低下、合成代谢减弱有关。PNI与多种肿瘤的预后相关,如卵巢癌、肾癌[7-8]。Cui et al[15]对329例非肌层浸润性膀胱癌患者的研究中发现,PNI可以有效预测患者术后PFS。本研究中PNI与膀胱癌患者的预后相关,低PNI组的患者预后更差,PNI作为影响患者预后的独立危险因素,具有一定的临床价值。
综上所述,通过对213例膀胱癌患者术前的NLR和PNI进行分析,结果表明高NLR、低PNI的膀胱癌患者预后较差,具有良好的判断预后作用。在临床工作中,这两项指标检测方便、廉价易得,可以通过术前常规检查得出,进而可评估患者预后。本研究的局限性在于单中心回顾性研究、病例数量有限,仍需要大样本、前瞻性研究,使该研究结果得到进一步证实。

