褪黑素的抗胃癌效应及其对TNF-α、NO 表达的调节作用
王开放,林清花,张荣,郑灵辉,庄锦坤,陈琪萍,周瑞祥,刘卉
(福建医科大学基础医学院人体解剖与组织胚胎学系,干细胞工程与再生医学福建省高校重点实验室,福州 350122)
国际癌症研究中心发布的2018 年《全球癌症报告》[1]显示,东亚区是全球胃癌发病率和死亡率最高的区域,中国的胃癌发病率和死亡率也位居全球前列。大量研究[2]表明机体免疫功能状态对肿瘤的发生发展及预后影响重大。褪黑素(melatonin,MLT)主要是由松果体合成分泌的吲哚胺类神经内分泌激素,众多前期实验结果[3-6]表明,褪黑素具有调节生物节律、机体免疫调节及抗肿瘤等生物功能。巨噬细胞作为生物体内非特异性免疫的重要组成部分,合成和分泌多种细胞因子,如:白介素、肿瘤坏死因子(tumor necrosis factor α,TNF-α)、一氧化氮(nitric oxide,NO)等,在肿瘤微环境调节和抗肿瘤的免疫调节中发挥着重要作用[7-9]。其中TNF-α 对胃癌等肿瘤细胞造成杀伤作用,NO 水平的升高也发挥抑制肿瘤的恶性发展作用[8-9]。褪黑素作为一种具有调节机体免疫抗肿瘤功能的内分泌激素,能否通过调节生物体内TNF-α 和NO 水平达到抗肿瘤的作用研究,目前尚未见报道。
本研究通过构建褪黑素体内外干预胃癌细胞模型,探究褪黑素的抗癌作用及其对细胞因子TNFα、NO 表达的影响,为褪黑素通过调节非特异性免疫调节途径发挥抗癌作用相关研究提供一定的实验依据。
材料与方法
1 动物模型建立及分组
SPF 级6~8 周龄BALB/C 小鼠24 只,雌雄各半,体重(22±2)g,由福建医科大学实验动物中心提供。饲养条件控制在20~25℃,自然光照循环,自由饮水和摄食。小鼠前胃癌细胞株(murine foregastric carcinoma, MFC)细胞计数后,按1.0×106个细胞于每只小鼠右腋皮下注射种植,将24 只小鼠全部荷瘤后随机分组,每组6 只,雌雄各半,共4 组。6d 后荷瘤小鼠右腋下可触及明显肿块,说明荷瘤模型成功建立。荷瘤后第7d 起每天16∶30 腹腔注射褪黑素(Sigma,纯度>98%)给药,连续注射14d 后取肿瘤组织。褪黑素临用前以无水乙醇溶解,再加生理盐水配制,乙醇浓度为0.1%,置4℃避光保存备用。具体分组如下:对照组:荷瘤且腹腔注射含0.1%无水乙醇的生理盐水0.4ml;褪黑素低剂量组:荷瘤且腹腔注射含50mg/kg 褪黑素的生理盐水0.4ml;褪黑素中剂量组:荷瘤且腹腔注射含100mg/kg 褪黑素的生理盐水0.4ml;褪黑素高剂量组:荷瘤且腹腔注射含150mg/kg 褪黑素的生理盐水0.4ml。
2 分离腹水巨噬细胞及取材测量
连续给药两周后次日上午8∶00 对小鼠称重,并摘取眼球获其外周血,1000×g 离心20min 后吸取上层血清于1.5ml EP 管中,-80℃冰箱保存。
各组小鼠用75%酒精冲洗残留血液后,将小鼠浸没入75%酒精中静置消毒3min,暴露出腹膜壁。向小鼠腹腔中注射适量低温生理盐水。充分压揉腹膜壁5min,使液体在腹腔内流动,然后静止5min。充分引流出腹腔灌洗液体于离心管,1500g 离心5min,弃去上清,加入含有10%胎牛血清的RPMI1640 培养基1ml 重悬,将细胞悬液接种于12 孔板,5% CO2培养箱中37℃培养4h 后除去培养液,用低温生理盐水洗涤各培养孔去除未贴壁细胞,纯化巨噬细胞,再次加入含有10%胎牛血清的RPMI1640 培养液2ml/孔培养24h,每孔取出1ml 培养液于EP 管于-80℃保存。弃去残留培养液加胰酶消化后进行对纯化后的巨噬细胞计数,将细胞悬液离心浓缩后按比例稀释混匀后制成细胞悬液,首先吸取20μl 4%台盼蓝溶液沿血球计数板上盖玻片边缘滴入,然后吸20μl混匀后的细胞悬液沿盖玻片边缘缓慢滴入,统计四大格未被染色的细胞数,按照公式:(细胞悬液的细胞数)/ml=(四个大格子细胞数/4)×2×104,计算悬液细胞密度。
将取完腹腔液的小鼠进行剥离肿瘤、胸腺和脾脏并称重,对肿瘤的长轴和短轴进行测量。其肿瘤体积计算公式:(长径×短径2)/2;胸腺指数计算公式:胸腺质量/动物质量;脾指数计算公式:脾脏质量/动物质量。
3 肿瘤组织的HE 染色
将剥离的肿瘤组织切成大小约0.5cm3的组织块,浸入10%福尔马林固定液中固定24h,随后放入包埋盒中,流水冲洗60min 后置于低浓度到高浓度的酒精进行梯度脱水、透明,后将透明完成的组织块置于保温溶蜡箱中已溶化的石蜡中浸蜡包埋。将包埋好的蜡块制成5μm 的薄片,贴到载玻片上放恒温箱中烘干,脱蜡,再经由高浓度到低浓度酒精,后PBS 冲洗3 次,每次3min,苏木精浸染3min,自来水冲洗1min,0.5%盐酸乙醇分化3 s,0.2%氨水返蓝30s,蒸馏水水洗1min,1%伊红浸染约20s,自来水冲洗1min,乙醇梯度脱水,二甲苯透明,中性树胶封片。
4 酶联免疫吸附法测定TNF-α
操作步骤严格按照试剂盒(Elabscience Biotechnology Co, Ltd)说明书要求进行,首先制备标准品,然后在酶标包被板上标准品准确上样100μl,待测样品孔先加入样品100μl,轻摇混匀,覆膜37℃孵育90min 后弃去液体,加入试剂盒内生物素化抗体37℃孵育60min 后弃去液体,每孔加洗涤液350μl 浸泡1~2min,重复3 次,每孔加酶结合物工作液100μl,加上覆膜,37℃温育30min 后洗涤,具体操作同前,每孔加90μl底物溶液(TMB),酶标板加上覆膜37℃避光孵育15 分钟每孔加终止液50μl 终止反应。立即用酶标仪在450 nm 波长测量各孔的光密度(OD 值)。
5 比色法测定NO
操作步骤严格按照试剂盒(Elabscience Biotechnology Co, Ltd)说明书要求进行,首先制备8 管标准品,每管200μl,样本管加入200μl 各组待测样品,然后按照顺序加入试剂盒内试剂一涡旋混匀后加入试剂二涡旋混匀,室温(20℃)静置15min,3100g离心10min,分别取160μl 上清液加入对应酶标板孔,向每孔加入80μl 显色工作液震荡混匀2min 后室温静置15min,酶标仪562nm 波长测量各孔的光密度(OD 值)。
6 MFC 胃癌细胞培养及分组
小鼠前胃癌细胞MFC 购自中国科学院上海生命科学研究院,细胞接种于六孔板中,培养基为RPMI-1640,含10%胎牛血清,密度3×105个/ml。贴壁24h 后用0、2、4、6mmol/L 不同浓度褪黑素干预,每组设3 个复孔,干预24h 后显微镜观察并拍照,分别将各组细胞培养液收集至离心管,1000g 离心15min,收集各培养液上清于1.6ml 离心管-80℃保存。
7 CCK-8 法检测MFC 细胞增殖活性
将MFC 细胞细胞以5×103个/孔接种于96 孔板,培养24h 后进行0、2、4、6mmol/L 浓度褪黑素干预。每组设6 个复孔,给药24h 后,每孔加入含10μl CCK-8 溶液(日本同仁化学研究所)的培养液100μl,37℃孵育60min 后用酶标仪在450nm 波长测量各孔的光密度(OD 值)。按下列公式计算∶肿瘤细胞存活率=(各加药孔吸光度均值-空白孔吸光度均值)/(对照组吸光度均值-空白孔吸光度均值)×100%。
8 酶联免疫吸附法测定MFC 细胞上清TNF-α 的表达水平
取2.1 收集的细胞上清液样品各100ul 备用,具体检测步骤同1.4。
9 比色法测定MFC 细胞培养上清NO 的表达水平
取2.1 收集的细胞上清液样品各200ul 备用,具体检测步骤同1.5。
1 0 统计学分析
采用SPSS 25.0 统计软件对所有数据行单因素方差(ANOVA)分析,组间两两比较用LSD 检验进行显著性分析,均以P<0.05 为有统计学显著性差异。
结 果
1 荷胃癌小鼠及肿瘤组织HE 染色
本研究成功建立荷胃癌BALB/C 小鼠,肿瘤细胞荷于小鼠右腋皮下部位(图1A)。肿瘤组织切片HE 染色结果显示细胞核大深染,细胞大小不均,细胞异形性明显,组织细胞排列紊乱,呈现出病理性核分裂像(图1B)。
2 褪黑素体内抑制小鼠胃癌增殖
对不同剂量褪黑素对肿瘤质量和体积的影响检测显示,与对照组相比,褪黑素干预组小鼠肿瘤质量和体积均显著降低(图2)。
3 褪黑素对荷胃癌小鼠胸腺及脾指数无明显影响
对不同剂量褪黑素对荷胃癌小鼠胸腺指数和脾指数的影响检测显示,与对照组相比,褪黑素干预各组胸腺指数无明显变化(图3A);与对照组对比,低剂量组脾指数显著增高,中高剂量组脾指数均无明显差异(图3B)。
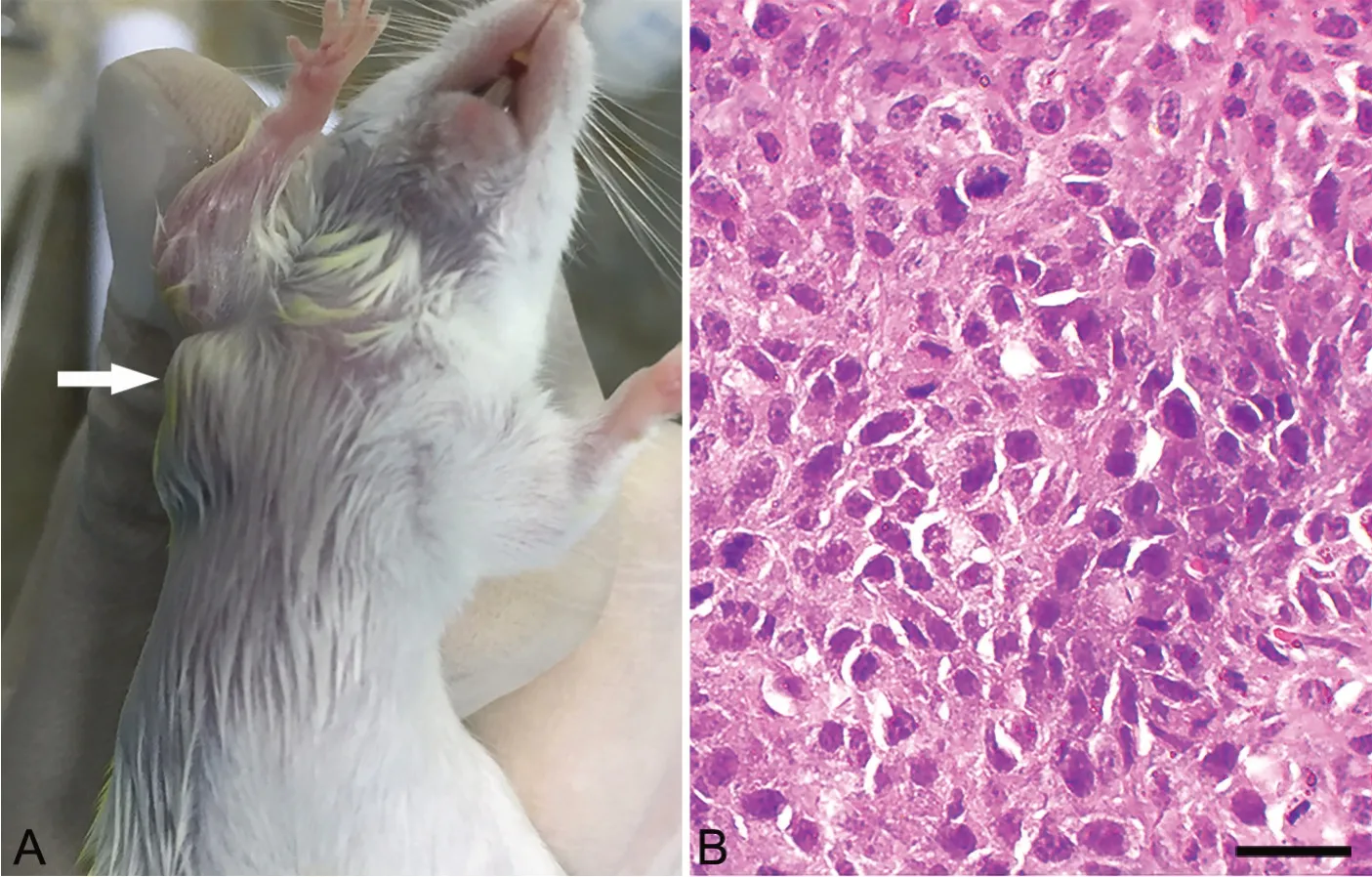
图1 荷胃癌小鼠及肿瘤组织病理学检测。A,小鼠右腋皮下可见明显肿块(白色箭头所示);B,肿瘤组织HE 染色;比例尺:20μmFig.1 Histopathological observation of cancer-bearing mouse and tumor tissue. A, a visible mass was observed under the right sac of the mouse (shown by the white arrow); B, HE staining results of tumor tissue; scale bar, 20μm

图2 褪黑素对小鼠肿瘤质量及体积的影响。A,各组肿瘤质量数据统计学分析;B,各组肿瘤体积数据统计学分析; #,褪黑素干预组与对照组(0mmol/L 褪黑素)比较,P <0.01Fig. 2 Effect of melatonin on tumor weight and volume in mice. A, statistical analysis for the tumor weight data of each group; B, statistical analysis for the tumor volume data of each group; #, P <0.01,melatonin intervention group compared with control group (0mmol/Lmelatonin)

图3 褪黑素对小鼠胸腺及脾指数的影响。A,各组胸腺指数数据分析;B,各组脾指数数据分析; *,褪黑素干预组与对照组(0mmol/L 褪黑素)比较0.01<P <0.05Fig. 3 Effect of melatonin on thymus and spleen indexes in mice. A, statistical analysis of thymus index data of each group; B, statistical analysis of spleen index data of each group; *, 0.01<P <0.05, melatonin intervention group compared with control group (0mmol/L melatonin)
4 褪黑素促小鼠血清TNF-α 和NO 的表达水平升高
对不同剂量褪黑素对荷胃癌小鼠外周血清TNF-α 和NO 表达的影响检测显示,与对照组相比,除MLT 100mg/kg 剂量组小鼠TNF-α 外,褪黑素干预组小鼠外周血TNF-α 和NO 表达显著升高(图4)。

图4 褪黑素对小鼠血清TNF-α、NO 水平的影响。A,各组血清TNF-α 水平数据分析;B,各组血清NO 水平数据分析;#,褪黑素干预组与对照组(0mmol/L 褪黑素)比较,P <0.01Fig. 4 Effect of melatonin on expression of TNF-α and NO in mice serum. A, statistical analysis for serum TNF-α levels in each group; B, statistical analysis for serum NO levels in each group; #, P <0.01, melatonin intervention group compared with control group (0mmol/L melaotonin)
5 褪黑素对小鼠腹水巨噬细胞数量无明显影响
分析不同剂量褪黑素对荷胃癌小鼠腹水巨噬细胞数量的影响显示,与对照组相比,褪黑素干预组小鼠腹水巨噬细胞数量无明显变化(图5)。
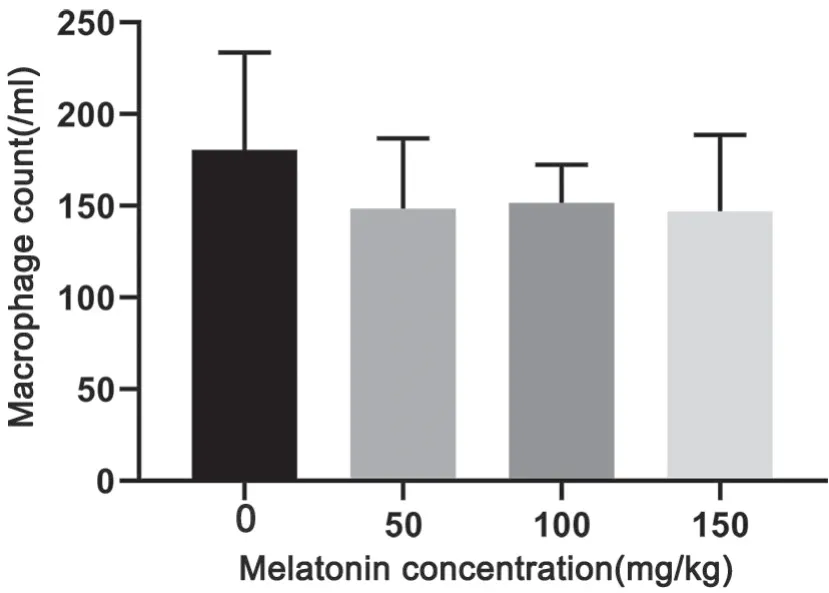
图5 褪黑素对小鼠腹水巨噬细胞数量的影响。Fig. 5 Effect of melatonin on the number of ascites macrophages in mice
6 褪黑素增强腹水巨噬细胞TNF-α 和NO 的分泌
检测不同剂量褪黑素对荷胃癌小鼠腹水巨噬细胞TNF-α 和NO 表达水平的影响,结构显示:与对照组相比,褪黑素干预组小鼠腹水巨噬细胞TNF-α和NO 表达显著升高(图6)。
7 褪黑素体外抑制小鼠胃癌增殖
CCK-8 法检测不同剂量褪黑素对胃癌细胞活性的影响显示,与对照组(0 mmol/L 褪黑素处理)相比,各剂量褪黑素干预组小鼠胃癌细胞活性均显著降低,且呈一定剂量依赖性(图7)。
8 褪黑素增强小鼠胃癌细胞TNF-α 的表达
检测不同剂量褪黑素对胃癌细胞表达TNF-α的影响显示,与对照(0mmol/L 褪黑素)组相比,4mmol/L 和6mmol/L 褪黑素干预组小鼠胃癌细胞TNF-α 表达量显著升高(图8)。
9 褪黑素使小鼠胃癌细胞NO 的表达下调
检测分析不同剂量褪黑素对胃癌细胞合成NO的影响显示,与对照组相比,褪黑素干预使小鼠胃癌细胞NO 表达显著降低(图9)。
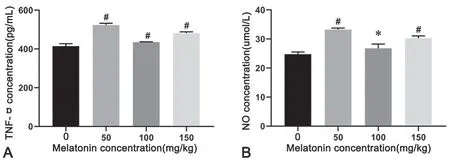
图6 褪黑素对腹水巨噬细胞培养上清TNF-α 和NO 水平的影响。A,各组腹水巨噬细胞培养液TNF-α 水平数据;B,组腹水巨噬细胞培养液NO 水平数据;褪黑素干预组与对照组(0mmol/L 褪黑素)比较:*,0.01<P <0.05;#,P <0.01Fig. 6 Effect of melatonin on the expression of TNF-α and NO in supernatants of ascites macrophages culture medium. A, the data of TNF-α level in the ascites macrophages culture medium in each group; B, the data of NO level in the ascites macrophages culture medium in each group; melatonin intervention group compared with control group (0mmol/L melatonin)∶ *, 0.01<P<0.05; #, P<0.01

图7 褪黑素体外对小鼠胃癌细胞增殖活性的影响。A,对照(0mmol/L 褪黑素)组; B,2mmol/L 褪黑素干预组;C,4mmol/L 褪黑素干预组;D,6mmol/L 褪黑素干预组;比例尺,20μm; E,CCK-8 法检测MFC 细胞增殖活性数据分析:#,与对照组比较,P <0.01Fig.7 Melatonin inhibits proliferation of gastric cancer cells of mice in vitro. A, Control (0mmol/L melatonin) group; B, 2mmol/L melatonin intervention group; C, 4mmol/L melatonin intervention group; D, 6mmol/L melatonin intervention group; scale bar, 20μm; E, statistical analysis for MFC cell proliferation activity detected by CCK-8 method∶ #, P <0.01, compared with control group

图8 褪黑素对MFC 培养液中 TNF-α 表达的影响。#,与对照(0mmol/褪黑素)组比较,P <0.01Fig. 8 Effect of melatonin on TNF-α expression level in MFC culture medium. #, P < 0.01, compared with control group (0mmol/L melatonin)

图9 褪黑素对MFC 培养液NO 水平的影响。#,与对照(0mmol/褪黑素)组比较,P <0.01。。Fig. 9 Effect of melatonin on NO expression level in MFC culture medium. #, P < 0.01, compared with control (0mmol/L melatonin) group
讨 论
褪黑素作为一种内分泌激素,能够通过多种途径达到抗肿瘤和调节机体免疫的作用。本研究结果显示,褪黑素体内、外干预组小鼠胃癌细胞增殖活性均受到明显抑制,与本课题组前期实验结果[10]相一致。另外,褪黑素对中枢免疫器官胸腺无明显影响,对脾有一定影响。结果显示低剂量褪黑素组小鼠脾指数增大,中剂量和高剂量无显著变化。从脾脏外观来看,对照组及低剂量组脾的颜色暗红发黑,提示脾脏作为外周免疫器官可能存在较强免疫应答及出血等损伤,而中、高剂量组脾脏颜色鲜红。在褪黑素对脾脏的保护作用的相关研究中表明,较高浓度的褪黑素对小鼠的脾脏具有一定的保护作用。而在低剂量褪黑素干预组出现的脾指数和颜色的变化具体原因尚不明确,有待进一步研究[11]。
机体防御体系中特异性免疫对肿瘤发生发展起主要抑制作用,但非特异性免疫在抗肿瘤的作用中也不可忽视。大量研究表明[12-17],巨噬细胞的两种极化细胞群M1 型与M2 型对机体的炎症反应和抗肿瘤效应具有很大差异,TNF-α 和NO 作为M1 巨噬细胞分泌的重要细胞因子,其能通过调节细胞代谢和相关基因表达而达到抗多种肿瘤发生发展的作用。有资料表明[17-18],M1 型巨噬细胞合成NO 是其功能被激活的重要标志,其激活后分泌白介素因子和TNF 因子显著增强,TNF-α 则是主要由机体内M1型巨噬细胞受刺激后分泌的标志性免疫因子。相关研究显示[16],TNF-α 能够在胃癌的发展过程中通过诱导癌细胞坏死和凋亡,并介导免疫细胞毒性和炎性细胞因子的产生进而发挥抑癌作用。肿瘤微环境中NO 水平的升高能够通过调节肿瘤酸碱度影响其代谢发挥抗肿瘤作用[17]。
本研究结果显示,褪黑素处理使血清和腹水巨噬细胞培养液上清NO 与TNF-α 浓度水平均显著升高,表明褪黑素可能通过提升机体内巨噬细胞合成分泌NO 与TNF-α 的能力,从而提高外周血清NO 与TNF-α 的表达水平,提示褪黑素能够通过促进体循环中的NO和TNF-α的表达从而达到抗胃癌效应,此结果与前期研究结果[19-20]一致。褪黑素干预组小鼠腹水巨噬细胞数量较对照组无显著变化,可能是由于幼稚型巨噬细胞在受到不同刺激后分化成功能不同的M1 型和M2 型两种巨噬细胞群,导致褪黑素干预后的腹水巨噬细胞群中两类巨噬细胞数量比例发生变化但总体巨噬细胞数量未发生较大改变,进而导致TNF-α 与NO 表达水平发生明显改变的结果。
另外细胞实验发现4mmol/L 和6mmol/L 褪黑素能够显著上调肿瘤细胞TNF-α 的合成分泌,提示褪黑素体外也是通过促进胃癌细胞TNF-α 的表达从而达到抗胃癌效应。但随着褪黑素剂量的升高,NO 表达水平反而降低,可能由于褪黑素在抑制胃癌细胞活性的过程中,导致胃癌细胞内一氧化氮合酶的活性降低,同时由于成活胃癌细胞数量减少,也是导致NO 水平降低的重要原因。
综上所述,褪黑素体内外均能抑制胃癌细胞增殖活性,该作用与TNF-α 表达上调、NO 表达水平改变有关;也与体内巨噬细胞分泌TNF-α、NO 水平增强有关。

