男性不育患者精子鱼精蛋白表达的研究*
孙昌瑞,冯 林
(1.四川省医学科学院·四川省人民医院检验科,四川成都 610072;2.四川省妇幼保健院检验科,四川成都 610091)
全世界15% 的育龄夫妇不孕不育,而男性因素占30%~40%,其中精子异常占了14%~15%[1-3]。越来越多的研究表明,鱼精蛋白的表达与精子的形成、活力和染色体有密切相关性[4-5],鱼精蛋白的组成成分缺失、含量过低或过高温度,都会导致精子DNA断裂或组成比例异常,使得精子DNA损伤加剧[6-8]。研究发现在成都地区男性不育的调查报告中,未见有关于鱼精蛋白1(PRM1)和鱼精蛋白2(PRM2)的mRNA表达的报道,因此,本研究采用荧光定量聚合酶链反应(FQ-PCR)方法,检测了男性体检健康者30例、少精子症83例、畸形精子症61例的不育患者的精子PRM1和PRM2 mRNA表达情况,用基因分析方法来探讨成都地区男性不育患者少精子症与鱼精蛋白基因表达的相关性,现将结果报道如下。
1 资料与方法
1.1一般资料 选取年龄24~36岁的男性体检健康者30例作为体检健康组,年龄24~35岁的83例少精子不育症患者作为少精子症组,年龄23~36岁的畸形精子不育症患者61例作为畸形精子症组。不育症患者均来自本院生殖辅助研究中心,采集标本前研究对象禁欲3~5 d,采集后在37 ℃、20~30 min液化完全后,采用计算机精液分析系统和巴氏改良染色法进行检测,不育症患者均符合世界卫生组织(WHO)第5版不育症临床诊断标准,同时排除由染色体核型异常、Y染色体微缺失、隐睾、生殖系统感染、阻塞性无精子症、性腺发育不良、免疫或内分泌疾病等引起的不育患者。所有标本均需本人签署医学伦理知情同意书。
1.2精液纯化和提取RNA 将液化后的精液标本离心后弃上清,用磷酸缓冲盐溶液(PBS)反复混匀,离心,弃上清,重复2~3次。采用异硫氰酸胍-酚-氯仿一步法提取RNA,检测RNA浓度、纯度及完整性。
1.3FQ-PCR引物 采用PE公司Primer Express软件设计PRM1、PRM2和GAPDH引物序列,由广州达安基因生物公司合成。PRM1的序列如下,F:CAG CCC ACA GAG TTC CAC CT,R:GCA CCT CAT GGC TCT CCT C;PRM2的序列,F:GCA AGA GCA AGG ACA CCA C,R:AGC CTC TGC GAT GCC TCC T;GAPDH的序列,F:GCC AGT GGA CTC CAC GAC,R:CAA CTA CAT GGT TTA CAT GTT C。
1.4cDNA合成 FQ-PCR反应体系(美国Invitrogen公司)20 μL:总RNA 1 μg,反转录酶20 U,随机引物200 ng,5×反应缓冲液4 μL,42 ℃反应50 min。
1.5FQ-PCR反应 扩增PRM1、PRM2和GAPDH,循环条件:50 ℃ 2 min,95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火40 s,循环40次,72 ℃末次延伸5 min。标准曲线的制备:采用BIECHE的标准曲线制备方法,在每次扩增均使用标准品制备标准曲线,范围为102~106copy/mL[9]。定量分析:根据标准曲线,仪器自动计算出标本中PRM1、PRM2和GAPDH的每毫升拷贝数,以PRM1、PRM2和GAPDH比值作为PRM1和PRM2的mRNA表达水平。

2 结 果
2.1PRM1和PRM2在精液中的表达 以GAPDH为内参基因,分别计算体检健康组、少精子症组和畸形精子症组PRM1和PRM2 mRNA相对表达水平,精液中PRM1和PRM2在少精子症组精液中表达率显著低于体检健康组和畸形精子症组,差异有统计学意义(P<0.05);体检健康组和畸形精子症组PRM1和PRM2表达率比较,差异无统计学意义(P>0.05)。见表1。

表1 各组PRM1和PRM2 mRNA相对表达水平比较
注:与体检健康组比较,*P<0.05;与畸形精子症组比较,#P<0.05
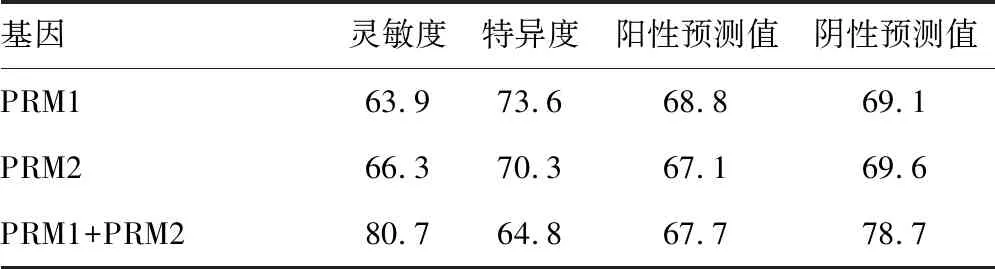
表2 PRM1和PRM2单独及联合检测用于少精子症
2.2PRM1和PRM2检测用于诊断少精子症的灵敏度和特异度 结果初步显示,将PRM1和PRM2联合检测,可提高对少精子症诊断的灵敏度和阴性预测值,见表2。
3 讨 论
随着分子生物学的不断发展,人们更多地从遗传学角度对男性不育进行分析,比如染色体畸变、单基因突变、Y 染色体微缺失、遗传多态性等[10-11],其中将鱼精蛋白的核酸和蛋白质进行分析研究,成为特发性男性不育的一大热点,鱼精蛋白广泛存在于人类及其他许多物种精子中,是含有丰富精氨酸的碱性蛋白质,1874年有研究者发现并成功的将其从精子中分离出来,编码PRM1和PRM2的基因位于16p13.3(16号染色体短臂),相对分子质量大约4×103~7×103,鱼精蛋白与精子生成、染色质结构、受精卵发育等紧密相关[12]。
PRM1有50个氨基酸残基,在N 末端有1个高度保守区,和4个高度保守的精氨酸组成的中央核心区,PRM2 富有的精氨酸和组氨酸残基,临床研究表明,PRM1表达量与精子的产生有密切的关联,当它的表达量异常时,会出现精子发育失调导致精子数量减少,而PRM2表达异常会改变精子负电荷量,降低精子染色质的凝聚稳定性,造成DNA的损伤[13-14]。MILLER等[15]研究报道,PRM可以保护精子 DNA,使其免受损伤,这是受精成功的关键因素之一。李俊等[16]采用限制性酶切及DNA测序技术对PRM1 C321A位点进行基因分型,发现不育患者PRM1 C321A位点AA基因型频率显著高于生育男性,导致精子前向运动能力及正常形态比例等参数明显下降,可能是男性不育的主要因素。
目前对成都地区男性不育的流行病学调查中,尚未见关于鱼精蛋白基因表达和少精子症相关性的报道,本研究分别检测了体检健康组、少精子症组和畸形精子症组PRM1和PRM2 mRNA的表达量,发现PRM1和PRM2在少精子症组的表达率显著低于体检健康组和畸形精子症组,差异有统计学意义(P<0.05);而在体检健康组和畸形精子症组表达率比较,差异无统计学异意义(P>0.05),提示PRM1 和PRM2 mRNA表达水平降低极可能是造成精子数量减少而不是精子形态异常的原因,这一结果,与国内学者洪丹等[17]的报道是一致的,即PRM1和PRM2 mRNA表达量减少可能影响精子染色质包装,使得精子形成过程异常,从而导致成熟精子数量减少。另一方面,联合检测PRM1 和PRM2,可提高对少精子症诊断的灵敏度和阴性预测值。
4 结 论
采用FQ-PCR检测精液中PRM1 和PRM2 mRNA表达,方法简便易行,价格便宜,标本来源容易,不会给患者带来痛苦,为个体化治疗提供遗传性依据,同时,也可以进行较大规模的流行病学调查,探究遗传异常发生类型及分布特点,较为全面的评估无精子症、少精子症患者的遗传学缺陷,为辅助生殖患者提供治疗前的遗传咨询,为临床治疗方案的选择夯实基础。

