siRNA沉默ADAM10基因对类风湿关节炎滑膜成纤维细胞凋亡的影响
王培,楚天舒,阎磊,刘冰,朱清,邵凤民
siRNA沉默ADAM10基因对类风湿关节炎滑膜成纤维细胞凋亡的影响
王培,楚天舒,阎磊,刘冰,朱清,邵凤民
450003 郑州,河南省人民医院风湿免疫科(王培、楚天舒),肾病科(阎磊、刘冰、朱清、邵凤民)
探讨小干扰 RNA(siRNA)沉默解整合素金属蛋白酶(ADAM10)基因对类风湿关节炎滑膜成纤维细胞凋亡的影响。
将ADAM10 特异性 siRNA 转染人类风湿关节炎滑膜成纤维细胞 MH7A 细胞,实验分为 3 组,ADAM10-siRNA 组转染 ADAM10 特异性 siRNA,NC-siRNA 组转染 ADAM10 非特异性 siRNA,对照组为未经转染处理的 MH7A 细胞。转染 48 h后采用实时荧光定量聚合酶链式反应(qRT-PCR)和蛋白免疫印迹法(Western blot)检测各组细胞中 ADAM10 表达水平,流式细胞仪检测细胞凋亡情况,qRT-PCR 检测凋亡相关基因 B 细胞淋巴瘤/白血病-2(Bcl-2)和 Bcl-2 相关 X 蛋白(Bax)表达水平,ELISA 测定细胞培养上清液中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)含量。
ADAM10-siRNA 组细胞中 ADAM10 mRNA 和蛋白表达水平较 NC-siRNA 组和对照组低(< 0.05)。沉默 ADAM10 基因后,ADAM10-siRNA 组细胞凋亡率显著高于 NC-siRNA 组和对照组(< 0.05)。ADAM10-siRNA 组细胞中 Bax 基因表达水平明显高于 NC-siRNA 组和对照组(< 0.05),Bcl-2 基因表达水平明显低于 NC-siRNA 组和对照组(< 0.05)。ADAM10-siRNA 组细胞分泌的 TNF-α、IL-6 和 IL-8 显著低于 NC-siRNA 组和对照组(< 0.05)。而 NC-siRNA 组和对照组以上各指标相比较,差异不明显(> 0.05)。
沉默 ADAM10 基因可明显促进类风湿关节炎滑膜成纤维细胞的凋亡,并进一步减少 TNF-α、IL-6 和 IL-8 等炎症因子的分泌,提示通过沉默 ADAM10 基因使减轻/控制类风湿关节炎炎症成为可能。
关节炎,类风湿; 滑膜成纤维细胞; 解整合素金属蛋白酶 10; 细胞凋亡
类风湿关节炎(rheumatoid arthritis,RA)是一种以累及关节为主的慢性全身性系统性自身免疫疾病,其病理特征在于滑膜过度增生,炎性单核细胞浸润,继而造成关节炎症、破坏及功能障碍[1]。越来越多的证据表明,RA 滑膜中存在高度活化的滑膜成纤维细胞(synovial fibroblasts,SFs),SFs 可通过产生促进软骨破坏的促炎症细胞因子(如TNF-α、IL-6 和IL-8 等)和蛋白酶在 RA 发生发展中发挥关键作用[2-3]。近期研究表明,类风湿关节炎滑膜成纤维细胞不但高度活化,释放炎症因子,并且存在凋亡受阻[4]。解整合素金属蛋白酶 10(adisintegrin and metalloproteinase 10,ADAM10)属于 ADAM 家族成员,是一种跨膜蛋白,参与多种炎性和退行性疾病的发生和发展[5-6]。先前的研究表明 ADAM10 在 RA 滑膜组织中过表达,且在 RA 的滑膜成纤维细胞的增殖及血管生成中起关键作用[7]。据报道,沉默 ADAM10 能够抑制类风湿关节炎滑膜成纤维细胞增殖、扩散、迁移和侵袭[8]。然而,ADAM10 是否介导类风湿关节炎滑膜成纤维细胞凋亡的研究鲜有报道。因此,本研究通过构建 ADAM10 特异性 siRNA,通过脂质体转染人类风湿关节炎滑膜成纤维细胞 MH7A 细胞,观察沉默 ADAM10 基因对 MH7A 细胞凋亡及对炎症因子的影响,为揭示 RA 可能的机制及基因靶向治疗提供可能的作用靶点。
1 材料与方法
1.1 材料
人类风湿关节炎滑膜成纤维细胞 MH7A 细胞株购自日本 RIKEN 生物资源中心;DMEM 培养基购自美国 Gibco 公司;胎牛血清、胰蛋白酶购自美国 Hyclone 公司;ADAM10 特异性siRNA 及ADAM10 非特异性siRNA 购自上海吉玛制药有限公司;Lipofectamine 2000 脂质体转染试剂、Trizol 试剂购自美国 Invitrogen 公司;M-MLV 逆转录试剂盒购自美国 Promega 公司;SYBR Primix Ex Taq 检测试剂盒购自日本 Takara 公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自上海翊圣生物科技有限公司;RIPA 细胞裂解液、BCA 蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;ADAM10 兔抗人单抗购自美国 Cell Signal 公司;辣根过氧化物酶标记的山羊抗兔 IgG 二抗购自北京中杉金桥生物技术有限公司;TNF-α、IL-6、IL-8 ELISA 检测试剂盒购自美国Bio-Techne 公司;引物均由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 细胞培养 MH7A 细胞培养在含 10% 胎牛血清的 DMEM 培养基中,置 37 ℃、体积分数为 5% CO2的细胞培养箱中进行孵育,根据细胞生长状态,每 2 天更换一次培养基,待细胞生长汇合率达 90% 时,使用胰蛋白酶消化传代培养。
1.2.2 细胞转染及分组 转染前 24 h 将处于对数生长期的MH7A 细胞接种于 6 孔板中,放置于 37 ℃培养箱中继续培养,当细胞生长汇合约 50% 时,根据Lipofectamine 2000 转染试剂说明书进行转染操作,使用的 siRNA 终浓度为 40 nmol/L,将转染ADAM10 特异性 siRNA 的 MH7A 细胞记为 ADAM10-siRNA 组,转染 ADAM10 非特异性 siRNA的 MH7A 细胞记为 NC-siRNA 组,未进行转染处理的 MH7A 细胞记为对照组。将转染后的各组细胞置 37 ℃培养箱中继续培养,48 h 后分别收集各组细胞及培养上清液。
1.2.3 qRT-PCR 检测 分别收集转染 48 h 后的各组MH7A 细胞,按照 Trizol 试剂说明书提取细胞中总 RNA,经蛋白核酸微量检测仪测定 RNA 浓度和纯度,选取260/280比值在 1.8 ~ 2.0 间的 RNA 进行逆转录,反应体系配置及反应程序设定均参照 M-MLV 逆转录试剂盒说明书进行,合成 cDNA。以 cDNA 为模板,采用 SYBR Primix Ex Taq 检测试剂盒进行定量检测,采用 20 μl 反应体系。反应采用 GAPDH 为内参,统计每孔 Ct 值,使用 2-ΔΔCt法分析各组细胞中ADAM10 mRNA 相对表达水平。引物:ADAM10 F:5' CTGCCCAGC ATCTGACCCTAA 3',R:5' TTGCCATCAGAACTG GCACAC 3';Bax F:5' GGGAGACACCTGAGCTG ACC 3',R:5' GGACTCCAGCCACAAAGATGG 3';Bcl-2 F:5' GAACTGGGGGAGGATTGTGGCC 3',R:5' TCGACGTTTTGCCTGAAGACTGTTAA 3';GAPDH F:5' ACCACAGTCCATGCCATCAC 3',R:5' CCACCACCCTGTTGCTGTAG 3'。
1.2.4 Western blot 检测 转染 48 h 后收集各组 MH7A 细胞,加入 RIPA 细胞裂解液,于冰上提取细胞中总蛋白。以 BCA 蛋白浓度检测试剂盒测定蛋白浓度,SDS 上样缓冲液与蛋白按比例混合,在沸水浴中加热 15 min 致蛋白变性,取 40 μg 蛋白样品加到上样孔中,行 SDS-PAGE 电泳,分离蛋白后以半干法转移至 PVDF 膜上,用 5% 脱脂奶粉进行封闭 2 h。加入1:1000 稀释的ADAM10 一抗,4 ℃过夜孵育。TBST 洗膜 15 min,洗涤3 次,加入1:3000 稀释的二抗,室温孵育 1 h。TBST 洗膜 15 min,洗涤3 次,加入 ECL 化学发光液显色,转移至暗室,曝光,以GAPDH 为内参,使用 Image J 图像分析软件统计分析,计算各组细胞中ADAM10 蛋白表达水平。
1.2.5 流式细胞仪检测 各组 MH7A 细胞转染48 h 后,以预冷的 PBS 洗涤细胞 2 次,离心收集细胞,加入 100 μl 结合缓冲液,重悬细胞,分别向细胞中加入Annexin V-FITC 和 PI 染液各5 μl,室温避光反应 30 min,再向细胞中加入 400 μl 结合缓冲液,上流式细胞仪检测,统计各组 MH7A 细胞凋亡率。
1.2.6 ELISA 检测 各组 MH7A 细胞转染 48 h 后,分别收集细胞培养上清液,根据 ELISA 检测试剂盒说明书测定上清液中 TNF-α、IL-6 和 IL-8 水平。使用酶标仪测定在 450 nm 波长处吸光度值。
1.3 统计学分析
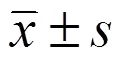
2 结果
2.1 转染 siRNA 对 MH7A 细胞中 ADAM10 表达的影响
qRT-PCR 和Western blot 检测结果见表 1 和图 1,ADAM10-siRNA 组 MH7A 细胞中 ADAM10 mRNA 和蛋白表达水平相比 NC-siRNA 组和对照组均明显下调(< 0.05)。NC-siRNA 组和对照组间 ADAM10 mRNA 和蛋白表达水平差异不显著(> 0.05)。提示在 MH7A 细胞中转染ADAM10-siRNA 能够有效沉默 ADAM10 基因及抑制 ADAM10 蛋白表达。
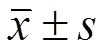
表 1 转染 48 h 后各组 MH7A 细胞中ADAM10 mRNA和蛋白水平比较()
注:与对照组比,*< 0.05;与NC-siRNA 组比,&< 0.05。
Notes: Compared with the control group,*< 0.05; compared with the NC-siRNA group,&< 0.05.
2.2 沉默 ADAM10 基因对 MH7A 细胞凋亡的影响
沉默 ADAM10 基因后采用流式细胞仪检测各组 MH7A 细胞凋亡情况,结果显示,ADAM10-siRNA 组细胞凋亡率相比NC-siRNA 组和对照组明显升高(< 0.05)。NC-siRNA 组和对照组间细胞凋亡率差异不明显(> 0.05),见表 2 和图 2。说明沉默 ADAM10 基因能够诱导 MH7A 细胞凋亡。
2.3 沉默 ADAM10 基因对 MH7A 细胞中 Bcl-2 和 Bax 蛋白表达的影响
采用qRT-PCR 检测各组 MH7A 细胞中凋亡相关基因 Bcl-2 和 Bax 表达水平,结果如表 3 所示,ADAM10-siRNA 组细胞中 Bcl-2 mRNA 表达水平相比 NC-siRNA 组和对照组明显下调(< 0.05),Bax mRNA 表达水平明显上调(< 0.05)。NC-siRNA 组和对照组间 Bcl-2 和 Bax 基因表达水平差异无统计学意义(> 0.05)。提示沉默 ADAM10 基因能够下调 Bcl-2 的表达,上调 Bax 的表达。
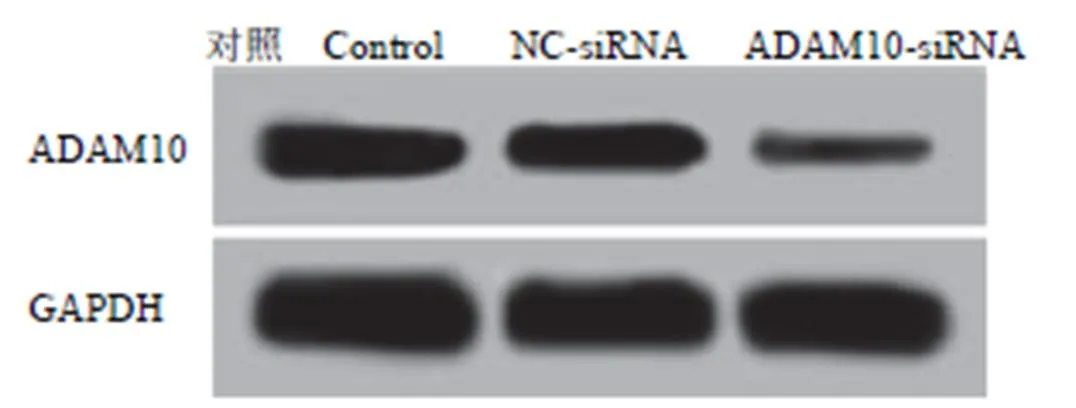
图 1 Western blot 检测各组 MH7A 细胞中 ADAM10 蛋白水平
Figure 1 Western blot analysis of ADAM10 protein levels in MH7A cells of each group
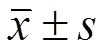
表 2 沉默 ADAM10 基因对 MH7A 细胞凋亡的影响()
注:与对照组比,*< 0.05;与NC-siRNA 组比,&< 0.05。
Notes: Compared with the control group,*< 0.05; compared with the NC-siRNA group,&< 0.05.
2.4 沉默 ADAM10 基因对 MH7A 细胞培养上清液中 TNF-α、IL-6 和 IL-8 含量的影响
采用ELISA 测定各组细胞培养上清液中TNF-α、IL-6 和 IL-8 含量,ADAM10-siRNA 组细胞上清液中 TNF-α、IL-6 和 IL-8 相比 NC-siRNA 组和对照组明显降低(< 0.05)。NC-siRNA 组和对照组间细胞上清液中 TNF-α、IL-6 和 IL-8 含量差异不明显(> 0.05),见表 4。提示沉默 ADAM10 基因能够抑制细胞分泌 TNF-α、IL-6 和 IL-8。
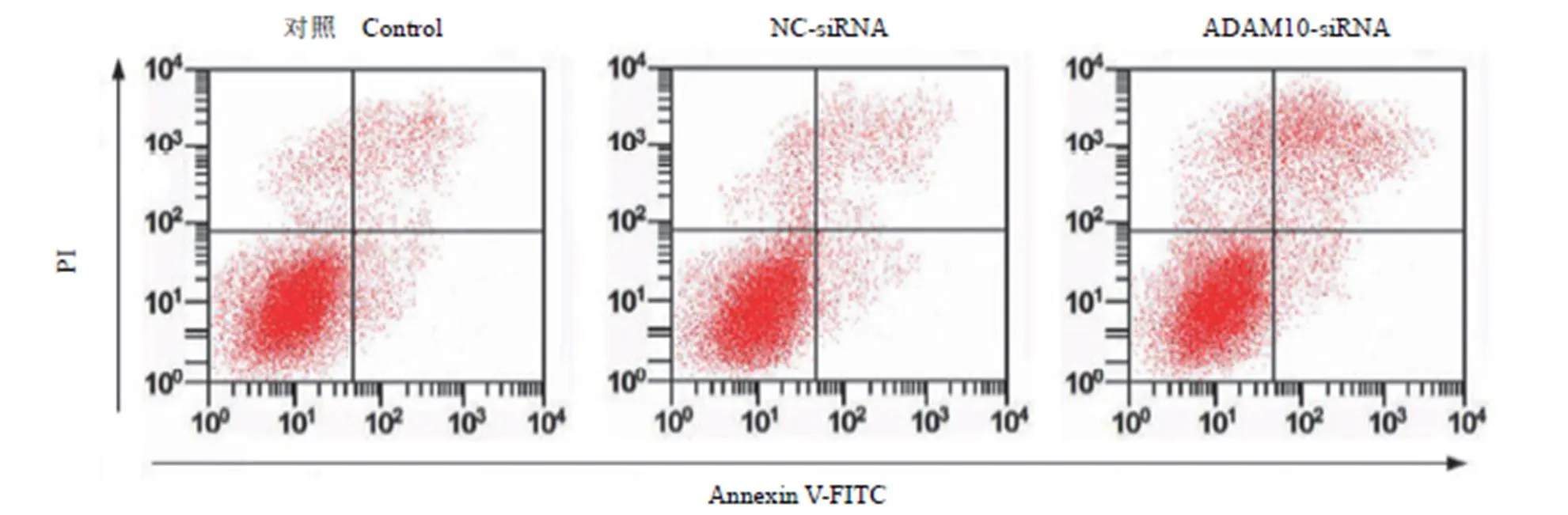
图 2 流式细胞仪检测各组 MH7A 细胞凋亡率
Figure 2 Flow cytometry to detect apoptosis rate of MH7A cells in each group
表 3 沉默 ADAM10 基因对 MH7A 细胞中 Bcl-2和 Bax 基因 mRNA 表达的影响()
注:与对照组比,*< 0.05;与NC-siRNA 组比,&< 0.05。
Notes: Compared with the control group,*< 0.05; compared with the NC-siRNA group,&< 0.05.
3 讨论
目前已有大量研究证实,RA 患者滑膜中的滑膜成纤维细胞不但存在过度增殖,还存在凋亡不足[9-10]。因此,有效诱导滑膜成纤维细胞的凋亡,也可能是治疗 RA 的方法之一。在 Isozaki 等[11]研究中,发现 ADAM10 在人 RA 滑膜成纤维细胞中的表达水平显著升高;后续研究发现 ADAM10 在 RA 患者的滑膜组织及滑液中均呈高表达,沉默 ADAM10 能够抑制类风湿关节炎滑膜成纤维细胞增殖、扩散、迁移和侵袭,然而其是否能够影响滑膜成纤维细胞的凋亡尚未可知。ADAM10 在乳腺癌、结直肠癌、口腔鳞状细胞癌等常见恶性肿瘤中亦呈高表达[12]。Zhang 等[13]研究,通过转染 siRNA 敲除肝癌细胞中 ADAM10 的表达,发现肝癌细胞凋亡增加。Fu 等[14]研究指出,ADAM10 可调节膀胱癌细胞增殖、侵袭、凋亡及化疗耐药。提示 ADAM10 可能参与细胞凋亡过程,因此,本实验通过在人类风湿关节炎滑膜成纤维细胞 MH7A 细胞中转染 ADAM10 特异性 siRNA,有效降低了 MH7A 细胞中 ADAM10 表达的水平。经流式细胞仪检测发现,沉默 ADAM10 基因后,MH7A 细胞凋亡率显著升高。qRT-PCR 检测发现沉默 ADAM10 基因的 MH7A 细胞中 Bcl-2 mRNA 表达明显降低,而 Bax mRNA 表达明显升高。Bax 和Bcl-2 是细胞凋亡中研究最多、最透彻的基因,其中 Bax 是促凋亡基因,而 Bcl-2 是抑制细胞凋亡的基因[15]。本实验结果发现沉默 ADAM10 基因后 Bax 表达升高,Bcl-2 表达降低,提示沉默ADAM10 基因可能通过调节 Bcl-2、Bax 的表达水平进而使滑膜成纤维细胞凋亡增加。这与近期Guo 等[16]研究结果一致—— miR-152 通过靶向 ADAM10 抑制类风湿关节炎滑膜成纤维细胞增殖进而诱导细胞凋亡。
表 4 沉默 ADAM10 基因对 MH7A 细胞上清液中TNF-α、IL-6和IL-8含量的影响()
注:与对照组比,*< 0.05;与NC-siRNA 组比,&< 0.05。
Notes: Compared with the control group,*< 0.05; compared with the NC-siRNA group,&< 0.05.
众多研究发现,RA 患者滑膜成纤维细胞能够分泌包括 TNF-α、IL-6 和 IL-8 在内的多种炎症因子,炎症因子又可进一步促进滑膜成纤维母细胞的增生,两者均参与 RA 的发生与发展,TNF-α 是熟知的参与 RA 发病机制的关键炎症因子,使用 TNF-α 抑制剂治疗 RA 在临床上被证实是安全有效的[17]。此外,研究证实,IL-6 和 IL-8 在 RA 患者的血清和滑液中呈高浓度存在,在 RA 的发生发展中也起着关键作用,参与关节组织的破坏[18]。越来越多的证据表明 ADAM 家族参与炎症反应的调节,该家族的成员可以作为治疗炎性疾病(包括 RA)的新型治疗靶点[19]。因此,本研究设想,是否可以通过沉默 ADAM10 基因影响类风湿关节炎滑膜成纤维细胞炎症因子的分泌。结果显示 ADAM10 可调节人类风湿性关节炎滑膜成纤维细胞分泌 TNF-α、IL-6 和 IL-8 等炎症因子。因此,ADAM10 有可能作为治疗RA 的新型治疗靶标。
综上,本实验证实了 siRNA 沉默 ADAM10 基因能够有效促进类风湿关节炎滑膜成纤维细胞的凋亡,减少炎症因子释放,提示 ADAM10 可能作为 RA 基因治疗中的潜在作用靶点。
[1] Catrina AI, Joshua V, Klareskog L, et al. Mechanisms involved in triggering rheumatoid arthritis. Immunol Rev, 2016, 269(1):162-174.
[2] Hillen J, Geyer C, Heitzmann M, et al. Structural cartilage damage attracts circulating rheumatoid arthritis synovial fibroblasts into affected joints. Arthritis Res Ther, 2017, 19(1):40.
[3] Kashyap S, Kumar U, Pandey AK, et al. Functional characterisation of ADP ribosylation factor-like protein 15 in rheumatoid arthritis synovial fibroblasts. Clin Exp Rheumatol, 2018, 36(4):581-588.
[4] Marotte H, Ahmed S, Ruth JH, et al. Blocking ERK-1/2 reduces tumor necrosis factor alpha-induced interleukin-18 bioactivity in rheumatoid arthritis synovial fibroblasts by induction of interleukin-18 binding protein A. Arthritis Rheum, 2010, 62(3):722-731.
[5] Isozaki T, Ishii S, Nishimi S, et al. A disintegrin and metalloprotease-10 is correlated with disease activity and mediates monocyte migration and adhesion in rheumatoid arthritis. Transl Res, 2015, 166(3):244-253.
[6] Erin N, Türker S, Elpek Ö, et al. ADAM proteases involved in inflammation are differentially altered in patients with gastritis or ulcer. Exp Ther Med, 2018, 15(2):1999-2005.
[7] Isozaki T, Rabquer BJ, Ruth JH, et al. ADAM-10 is overexpressed in rheumatoid arthritis synovial tissue and mediates angiogenesis. Arthritis Rheum, 2013, 65(1):98-108.
[8] Li D, Xiao Z, Wang G, et al. Knockdown of ADAM10 inhibits migration and invasion of fibroblast-like synoviocytes in rheumatoid arthritis. Mol Med Rep, 2015, 12(4):5517-5523.
[9] Seki M, Sakata KM, Oomizu S, et al. Beneficial effect of galectin 9 on rheumatoid arthritis by induction of apoptosis of synovial fibroblasts. Arthritis Rheum, 2014, 56(12):3968-3976.
[10] Qu Y, Wu J, Deng JX, et al. MicroRNA-126 affects rheumatoid arthritis synovial fibroblast proliferation and apoptosis by targeting PIK3R2 and regulating PI3K-AKT signal pathway. Oncotarget, 2016, 7(45):74217-74226.
[11] Isozaki T, Nishimi S, Nishimi A, et al. A disintegrin and metalloproteinase (ADAM)-10 as a predictive factor for tocilizumab effectiveness in rheumatoid arthritis. Mod Rheumatol, 2016, 27(5):782-786.
[12] Atapattu L, Saha N, Chheang C, et al. An activated form of ADAM10 is tumor selective and regulates cancer stem-like cells and tumor growth. J Exp Med, 2016, 213(9):1741-1757.
[13] Zhang W, Liu S, Liu K, et al. Knockout of ADAM10 enhances sorafenib antitumor activity of hepatocellular carcinoma in vitro and in vivo. Oncol Rep, 2014, 32(5):1913-1922.
[14] Fu L, Liu N, Han Y, et al. ADAM10 regulates proliferation, invasion, and chemoresistance of bladder cancer cells. Tumor Biol, 2014, 35(9):9263-9268.
[15] O'Neill KL, Kai H, Zhang J, et al. Inactivation of prosurvival Bcl-2 proteins activates Bax/Bak through the outer mitochondrial membrane. Genes Dev, 2016, 30(8):973-988.
[16] Guo J, Du J, Fei D, et al. miR-152 inhibits rheumatoid arthritis synovial fibroblast proliferation and induces apoptosis by targeting ADAM10. Int J Mol Med, 2018, 42(1):643-650.
[17] Schattner A. ACP Journal Club. Review: In rheumatoid arthritis, TNF-α inhibitors do not differ from placebo or DMARDs for all-cause mortality. Ann Intern Med, 2016, 164(4):JC20.
[18] Gualtierotti R, Ingegnoli F, Griffini S, et al. Prothrombotic biomarkers in patients with rheumatoid arthritis: the beneficial effect of IL-6 receptor blockade. Clin Exp Rheumatol, 2016, 34(3):451-458.
[19] Li YJ, Fan YH, Tang J, et al. Meprin-β regulates production of pro-inflammatory factors via a disintegrin and metalloproteinase-10 (ADAM-10) dependent pathway in macrophages. Int Immunopharmacol, 2014, 18(1):77-84.
Effect of ADAM10 gene silencing on apoptosis of synovial fibroblasts in rheumatoid arthritis
WANG Pei, CHU Tian-shu, YAN Lei, LIU Bing, ZHU Qing, SHAO Feng-min
Department of Immunology and Rheumatology (WANG Pei, CHU Tian-shu), Department of Nephropathy (YAN Lei, LIU Bing, ZHU Qing, SHAO Feng-min), Henan Provincial People's Hospital, Zhengzhou 450003, China
To investigate the effect of ADAM10 gene silencing on apoptosis of synovial fibroblasts in rheumatoid arthritis.
ADAM10-specific siRNA was transfected into human rheumatoid arthritis synovial fibroblast MH7A cells. The experiment was divided into 3 groups: ADAM10-siRNA group, NC-siRNA group and control group, which were transfected with ADAM10-specific siRNA, ADAM10 non-specific siRNA or nothing, respectively. After 48 h of transfection, qRT-PCR and Western blot were used to detect the expression of ADAM10 in each group. Flow cytometry was used to detect apoptosis. The expression levels of apoptosis-related genes Bcl-2 and Bax were detected by qRT-PCR. The levels of TNF-α, IL-6 and IL-8 in the cell culture supernatant were determined by ELISA.
The expression of ADAM10 mRNA and protein in the ADAM10-siRNA group was significantly lower than that in NC-siRNA group and control group (< 0.05). After silencing the ADAM10 gene, the apoptosis rate of the ADAM10-siRNA group was significantly higher than that of the NC-siRNA group and the control group (< 0.05). The expression of Bax gene in ADAM10-siRNA group was significantly higher than that in NC-siRNA group and control group (< 0.05). The expression level of Bcl-2 gene was significantly lower than that in NC-siRNA group and control group (< 0.05). TNF-α, IL-6 and IL-8 secreted by ADAM10-siRNA group were significantly lower than those of NC-siRNA group and control group (< 0.05). Compared with the above indexes in the NC-siRNA group and the control group, the difference was not significant (> 0.05).
ADAM10 gene silencing can significantly promote the apoptosis of rheumatoid arthritis synovial fibroblasts and further reduce inflammatory factors such as TNF-α, IL-6 and IL-8, suggesting that silencing of ADAM10 gene makes it possible to reduce/control rheumatoid arthritis inflammation.
Arthritis, rheumatoid; Rheumatoid arthritis synovial fibroblasts; ADAM10 gene; Apoptosis
SHAO Feng-min, Email: 250478232@qq.com
2017 年河南省医学科技攻关计划项目(201702180)
邵凤民,Email:250478232@qq.com
2018-12-17
10.3969/j.issn.1673-713X.2019.02.006

