比较细胞松弛素A与B在胞质分裂阻断法微核试验中的应用
文海若,任璐,罗飞亚,汪祺
比较细胞松弛素A与B在胞质分裂阻断法微核试验中的应用
文海若,任璐,罗飞亚,汪祺
100176 北京,中国食品药品检定研究院安全评价研究所(文海若、任璐),化妆品检定所(罗飞亚),中药民族药检定所(汪祺);510006 广州,中山大学药学院(任璐)
比较细胞松弛素 A(Cyto A)及细胞松弛素 B (Cyto B)对微核试验常用细胞系——中国仓鼠肺成纤维细胞(CHL)毒性及对体外微核试验结果的影响。
在荧光显微镜下观察由微丝组成的应力纤维结构,并使用 CHL 开展胞质分裂阻断法微核试验,比较两者对多核细胞率及含微核双核细胞率的影响。
不同浓度的 Cyto A 和 Cyto B 与细胞作用 24 h 后,与对照组(26% ± 7%)比较均可诱导多核细胞形成率的显著升高(Cyto A 及 Cyto B 3.0 μg/ml 浓度组分别为58% ± 12% 和 72% ± 9%,< 0.001),且 Cyto A 在 3.0 μg/ml浓度条件下诱导的平均多核细胞率与 1.5 μg/ml 浓度组比较有所降低。Cyto A 处理组在 MMC 浓度分别为 0、0.1 和 0.3 μg/ml 时的微核率分别为 0.25% ± 0.16%、1.98% ± 0.59% 和 3.80% ± 0.90%;而 Cyto B 处理组在相同 MMC 浓度时的微核率分别为 0.32% ± 0.16%、2.50% ± 0.61% 和 5.05% ± 1.09%。
虽然 Cyto B 的多核细胞造模效果略优于 Cyto A,两者均可有效用于胞质分裂阻断法微核研究。研究结果将为相关领域研究者提供可借鉴的实际经验。
细胞松弛素类; 微核试验; 肌动蛋白类; 胞质分裂阻断法
体外哺乳动物细胞微核试验以细胞过程中形成的独立于主核的染色单体或染色体断片为生物标志物,来评估受试物的潜在致染色体损伤能力。染色体损伤是肿瘤形成的分子基础之一,微核形成率可用于对受试物的潜在致癌风险预测。因其试验方法较为简便,体外微核试验已广泛应用于环境诱变剂、保健食品、化妆品、医疗器械和药物的安全性评价[1-3]。使用体外培养细胞开展常规微核法(conventional micronucleus methods)时对给药后所有细胞的微核率进行分析,不对细胞核分裂次数进行区分。该方法无法排除细胞自发微核背景值,且微核率可随细胞分裂次数而升高,故往往结果有所偏差。Fenech 等[4]于 1985 年在微核试验的受试物与细胞处理时加入了抑制细胞质分裂的细胞松弛素,可通过计数细胞核数量对受试物细胞增殖的影响以及计数细胞的分裂次数进行限定。该方法即胞质分裂阻断法微核试验(cytokinesis-block micronuceus cytome assay),仅分析完成一次分裂的双核细胞的微核率,从而提高结果的准确性。可见细胞松弛素的应用在上述试验体系中有重要作用。
细胞松弛素原本是一组真菌代谢产物,包括细胞松弛素 A、B、C、D、E、F、H 和 J[5]。它可与细胞的微丝结合并切断微丝,从而抑制微丝与肌动蛋白的结合。而肌动蛋白可与细胞核的定位、定向移动和胞质分裂时染色体结构的维持有关[6]。当肌动蛋白功能受到干扰时,染色体的集缩与基因转录可受到影响[7]。此外,有研究显示 Cyto B 可诱发细胞脱核,并可用于制备大量无核细胞质体和无胞质的核质体用于细胞融合、细胞核、细胞质成分分析及染色质基因转移技术等多种研究[8]。
微核试验中常用的造模试剂细胞松弛素为 Cyto B 和 Cyto A(结构见图 1),Cyto B 是体外微核试验指导原则规定使用的试剂[9],而获得困难时,有时也在微核试验中使用具有相似功能的 Cyto A。初次试验者在购买试剂时容易将两者混淆。本研究比较了两者对微核试验常用细胞系中国仓鼠肺成纤维细胞(Chinese hamster lung fibroblast,CHL)的细胞毒性及对体外微核试验结果的影响。
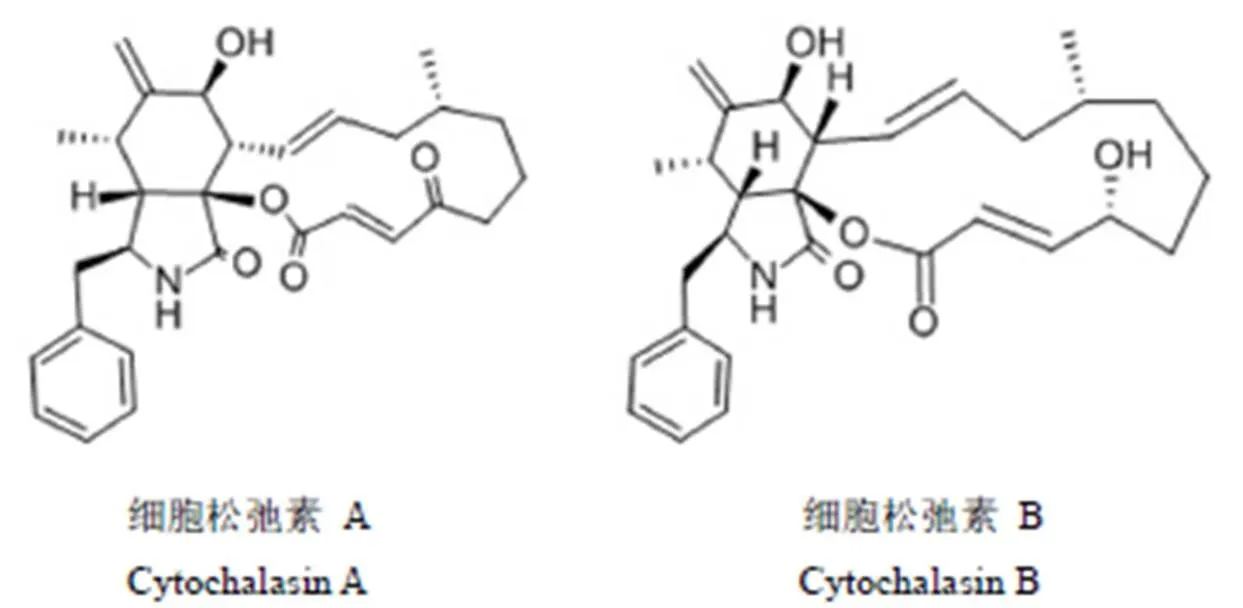
图 1 细胞松弛素 A 与细胞松弛素 B 的化学结构
Figure 1 Chemical structures of cytochalasin A and cytochalasin B
1 仪器与材料
1.1 材料
1.1.1 实验仪器 BX40 型正置光学显微镜购自日本 Olympus 公司;5810R 型离心机购自美国Eppendorf 公司;NTS-1300 恒温振荡水槽购自东京理化器械株式会社;荧光酶标仪购自美国伯腾公司;Operetta 高内涵成像系统购自英国珀金埃尔默公司。
1.1.2 材料与试剂 ddH2O 使用本中心 MilliQ-A10 超纯水机生产的超纯水,121 ℃、15 min 高压灭菌,4 ℃冰箱保存;RPMI 1640 培养基、1% 青链霉素混合液、0.25% 胰蛋白酶-EDTA、胎牛血清均购自美国 Gibco 公司;DMSO 购自美国 Sigma 公司;PBS 购自美国 Hyclone 公司;Cyto A 与 Cyto B购自北京索莱宝科技有限公司,用 DMSO 配成 5 mg/ml 溶液,–20 ℃保存;Perm/Wash buffer(554723)购自美国BD 公司;Alexa FluorTM488 鬼笔环肽(A12379)购自美国ThermoFisher 公司;Hoechst 33342 购自美国Invitrogen 公司。细胞为中国仓鼠肺细胞(Chinese hamster lung cell,CHL)第 4 ~ 6 代,来自中国科学院上海生命科学研究院细胞资源中心,液氮保存。
1.2 方法
1.2.1 细胞松弛素对微丝的影响
1.2.1.1 细胞培养及处理 无菌条件下,CHL 细胞使用含 10% 小牛血清及 1% 青链霉素的 RPMI 1640 在 37 ℃,CO2体积分数为 5% 的恒温培养箱中培养。细胞达到对数生长期后,以 1 ×105个/孔接种于 6 孔细胞培养板,继续培养18 ~ 24 h。
1.2.1.2 染色与固定 观察细胞培养情况,移除含 Cyto A 或 Cyto B 的培养基,使用 0.1 ml PBS 冲洗细胞 2 次,移除液体。每孔加入 0.1 ml 含3.7% 甲醇的 PBS 溶液固定,室温孵育 20 min 后移除液体。每孔加入 0.1 ml PBS 清洗细胞 3 次,每次 10 min,清洗后移除液体。每孔加入 0.1 ml 鬼笔环肽的 1 × 工作液染色,室温孵育 60 min 后移除液体。每孔加入 0.1 ml PBS 清洗细胞 3 次,每次 5 min,清洗后移除液体。每孔加入 100 μl 含 Hoechst 33342(终浓度 5 μg/ml 或 16.23 μmol/L)的 PBS(含 1% 胎牛血清)混合液,37 ℃、5% CO2条件下避光染色 10 min。移除含染料的培养基,使用 PBS 100 μl 清洗 2 次,每次 5 min,最后一次洗后剩余液体不移除。
1.2.1.3 镜下观察 使用 Operetta CLS 高内涵分析系统在 400 × 倍荧光显微镜下对微丝及细胞核形态观察及拍照。
1.2.2 体外胞质分裂阻断法微核试验
1.2.2.1 给药处理 胞质分裂阻断法微核试验简述如下[10]。细胞培养方法同 1.2.1.1。在无代谢活化条件下,细胞分别给予 0.1 和 0.3 μg/ml 的丝裂霉素 C(MMC)与细胞共同作用 6 h 后,更换含浓度为 1.0、1.5 和 3.0 μg/ml 的 Cyto A 和 Cyto B 的培养液与细胞继续作用约 24 h(1.5 个细胞倍增周期)。同时设 0.5% DMSO 为对照组。每个条件3 个复孔。
1.2.2.2 制片与染色 使用胰蛋白酶-EDTA 消化细胞,并将细胞悬液于 1000 r/min 离心 5 min 后收获。细胞经不含钙、镁离子的杜氏磷酸缓冲液(Dulbecco's phosphate buffered saline,DPBS)洗涤 2 次后,加入预温的 0.075 mol/L KCl 溶液于 37 ℃低渗处理不超过 5 min。加入甲醇:冰醋酸(3:1)对样本进行固定,并经 1000 r/min 离心5 min 后弃上清。重复固定 2 次。滴片、待玻片干燥后浸入 5% 姬姆萨溶液,染色约 25 min。标本染色后使用自来水冲洗并在室温下自然干燥。
1.2.2.3 镜检指标 显微镜下观察并计数:①每个剂量组玻片标本中 500 个细胞中多核细胞数,并计算多核细胞百分率;②2000 个双核细胞中微核数,并计算微核形成百分率。
1.3 统计及数据分析

图 2 细胞松弛素 A 与细胞松弛素 B 对微丝形态的影响
Figure 2 Effects of cytochalasin A and cytochalasin B to the morphology of actin filament
2 结果
2.1 比较细胞松弛素 A 与 B 对微丝的影响
使用荧光抗体标定微丝和细胞核后,在荧光显微镜下(400 ×)可见由微丝组成的应力纤维结构 (图2)。细胞在贴壁条件下生长时,应力纤维与细胞长轴平行。Cyto A 及 Cyto B 作用后,应力纤维形成的网状结构有所破坏,细胞形态变得狭长,并可诱导双核细胞的形成。
2.2 比较细胞松弛素 A 与 B 对体外胞质分裂阻断法微核结果的影响
CHL 细胞的倍增周期约为 16 h,不同浓度的 Cyto A 和 Cyto B 与细胞作用 24 h(约 1.5 个细胞倍增周期)后,每浓度组分别计数 500 个细胞中的单核与多核细胞数(图 3)。与对照组(26% ± 7%)比较Cyto A 及 Cyto B 均可诱导多核细胞(双核及以上)形成率显著升高(3.0 μg/ml 浓度组分别为 58% ± 12% 和 72% ± 9%,< 0.001),且 Cyto A 在 3.0 μg/ml 浓度条件下诱导的平均多核细胞率与 1.5 μg/ml 浓度组比较略有降低。1.0 及 3.0 μg/ml Cyto A 与相同浓度 Cyto B 相比,所诱导的多核细胞形成率显著降低(< 0.001),可能与 Cyto A 的胞质分裂阻断能力和细胞毒性有关。上述结果虽然试验选用浓度范围下 Cyto A 与 Cyto B 均可有效诱导大量多核细胞的形成,但 Cyto B 的多核细胞造模效果略优于 Cyto A。

图 3 细胞松弛素 A 与细胞松弛素 B 对多核细胞率的影响(n = 500,*P < 0.001,与 0.5% DMSO 组比较;#P < 0.001,与相同浓度 Cyto A组比较)
Figure 3 Effects of cytochalasin A and cytochalasin B to the ratio of multinucleated cells (n = 500,*< 0.001, comparing to 0.5% DMSO group;#< 0.001, comparing to Cyto A group of the same concentration)
以 1.5 μg/ml 为 Cyto A 和 Cyto B 处理浓度,分别给予不同浓度的体外微核试验阳性剂 MMC 来评价 Cyto A 和 Cyto B 对微核形成率的影响。含微核的双核 CHL 细胞形态如图 4A 所示。Cyto A 处理组在MMC 浓度分别为 0、0.1 和 0.3 μg/ml 时的微核率分别为 0.25% ± 0.16%、1.98% ± 0.59% 和 3.80% ± 0.90%;而 Cyto B 处理组在相同 MMC 浓度时的微核率分别为 0.32% ± 0.16%、2.50% ± 0.61% 和 5.05% ± 1.09%。阴性背景值在文献报道范围之内[10-12]。无论经 Cyto A 或 Cyto B 处理,0.1 和 0.3 μg/ml MMC 均可诱导 CHL 细胞双核细胞微核率显著性升高,且存在剂量相关性(< 0.01),但相同 MMC 浓度条件下 Cyto A 或 Cyto B 处理组之间的微核率无显著性差异。提示 Cyto A 和 Cyto B 均可用于胞质分裂阻断法微核试验。

图 4 细胞松弛素 A 与细胞松弛素 B 对含微核双核细胞率的影响(n = 2000;A:含微核的双核细胞图例;B:含微核双核细胞发生率分析结果;**P < 0.01,与 Cyto A-MMC 0 μg/ml 组比较;##P < 0.01,与 Cyto B-MMC 0 μg/ml 组比较)
Figure 4 Effects of cytochalasin A and cytochalasin B to the ratio of micronucleated cells (n = 2000; A: Representative image of binucleated cells containing micronuclei; B: Data analysis of the incidence on binucleated cells containing micronuclei;**< 0.01, comparing to Cyto A-MMC 0 μg/ml group;##< 0.01, comparing to Cyto B-MMC 0 μg/ml group)
3 讨论
微丝为直径约 7 nm 的肌动蛋白纤维,与微管和中间纤维共同构成细胞骨架,是决定细胞形状和维持细胞内部区域化的重要结构[13]。微丝在细胞运动、跨膜运输和细胞分裂、信号传导等过程中发挥决定性作用。在动物细胞的有丝分裂末期,在子代细胞之间形成由微丝构成的缢缩环,通过微丝束中肌动蛋白和肌球蛋白的收缩而隔断子代细胞的细胞质,形成两个独立的子代细胞[14]。细胞松弛素可抑制微丝的组装并破坏其三维网络[5]。因此,在细胞培养过程中添加细胞松弛素可形成核分离而细胞质不分离的多核细胞。
体外胞质分裂阻断法微核试验是常见的遗传毒性评价方法,在环境诱变剂、化妆品、保健食品及纳米材料毒理学评价及科研工作中得到广泛应用[15]。细胞松弛素的添加有助于对细胞分裂次数进行区分。单核细胞中的微核提示与自身背景有关,与受试物作用无关;而微核率则随着细胞分裂次数增加而显著升高。因此通过限定计数双核细胞中的含微核细胞数,有助于排除非药物因素引起的微核率升高。而通过计数单核和多核细胞比例,也可对受试物细胞增殖的影响进行评价。此外,细胞松弛素的使用还可保留细胞分裂中期凋亡及坏死细胞形态,可对样本中凋亡及坏死细胞进行计数分析[16-17]。而双核细胞的形成,也使研究者可以对除微核外,另外一项生物标志物“核质桥”(nucleoplasmic bridges,NPB)进行观察。NPB 是双核细胞中位于两个主核之间连续的桥状核质,可提示 DNA 错误修复或端粒末端融合效应。有研究提示 NPB 对60Co γ 射线诱导的遗传物质损伤做出灵敏而可靠的判断[18]。OECD 指导原则推荐使用 Cyto B 用于细胞造模,因 Cyto A 具有相似阻断细胞质分离的效应,后者也可用于胞质分裂阻断法微核试验。本研究比较了两者对微核试验结果的影响,提示 Cyto A 的细胞毒性略大于 Cyto B,此外两者对双核细胞微核率的形成效应等同,使用 Cyto A 对微核的形成无明显促进或抑制的作用,均可用于该研究。从作用机制角度分析,细胞松弛素对遗传物质无损伤作用,且对细胞分裂周期无明显影响。本研究中也未见 Cyto A 及 Cyto B 对微核率的形成存在显著性差异。
然而,细胞松弛素在微核试验中的应用也存在一定局限。因细胞松弛素对细胞骨架的形成有所干扰,可影响细胞对纳米材料等难溶受试物的内吞或摄取。故对于纳米材料,建议在给药后期再添加 Cyto B(延迟的共同处理),或使用先给药再添加 Cyto B(后处理)的方式,从而促进受试物与细胞培养系统在无 Cyto B 的情况下充分暴露,提高其与遗传物质的相互作用机会[19-20]。此外,细胞松弛素也可通过抑制细胞动力学干扰多倍体的形成,从而影响对潜在多倍体诱导剂毒性的判断[21]。
综上所述,使用细胞松弛素开展胞质分裂阻断法微核试验在生物监测和化合物毒性评价及研究中有一定用武之地。本研究比较了不同的细胞松弛素亚型,Cyto A 和 Cyto B 对胞质分裂阻断法微核试验结果的影响。两者在体外微核试验中均可能涉及,但有关 Cyto A 的文献报道寥寥,难以确定适宜的给药条件。本研究结果发现 Cyto A 和 Cyto B 均可有效用于胞质分裂阻断法微核研究,但后者的多核细胞造模效果略优于前者且细胞毒性较低。研究结果将为相关领域研究者的实际工作提供参考与借鉴。
志谢 感谢珀金埃尔默公司(Perkin Elmer,北京)王瑜博士对荧光染色及分析技术的支持。
[1] El-Zein R, Vral A, Etzel CJ. Cytokinesis-blocked micronucleus assay and cancer risk assessment. Mutagenesis, 2011, 26(1):101-106.
[2] Katic J, Cemeli E, Baumgartner A, et al. Evaluation of the genotoxicity of 10 selected dietary/environmental compounds with the in vitro micronucleus cytokinesis-block assay in an interlaboratory comparison. Food Chem Toxicol, 2010, 48(10):2612-2623.
[3] Fenech M. The cytokinesis-block micronucleus technique: a detailed description of the method and its application to genotoxicity studies in human populations. Mutat Res, 1993, 101(285):35-44.
[4] Fenech M, Morley A. Solutions to the kinetic problem in the micronucleus assay. Cytobios, 1985, 43(172-173):233-246.
[5] Cooper JA. Effects of cytochalasin and phalloidin on actin. J Cell Biol, 1987, 105(4):1473-1478.
[6] Armbruster BL, Wunderli H, Turner BM, et al. Immunocytochemical localization of cytoskeletal proteins and histone 2B in isolated membrane-depleted nuclei, metaphase chromatin, and whole Chinese hamster ovary cells. J Histochem Cytochem, 1983, 31(12):1385-1393.
[7] Díaz-Ricart M, Arderiu G, Estebanell E, et al. Inhibition of cytoskeletal assembly by cytochalasin B prevents signaling through tyrosine phosphorylation and secretion triggered by collagen but not by thrombin. Am J Pathol, 2002, 160(1):329-337.
[8] Poste G. Enucleation of mammalian cells by cytochalasin B. I. Characterization of anucleate cells. Exp Cell Res, 1972, 73(2):273- 286.
[9] The Organisation for Economic Co-operation and Development. Test no. 487: in vitro mammalian cell micronucleus test//OCOD guidelines for the testing of chemicals -- section 4: health effects. (2014-09-26) [2018-12-12]. https://www.oecd-ilibrary.org/environment/test-no-487- in-vitro-mammalian-cell-micronucleus-test_9789264224438-en.
[10] Wen HR, Dan M, Qi NS, et al. Cytokinesis-block micronucleus cytomic test establishment in multiple mammalian cell lines. Carcinogenesis Teratogenesis Mutagenesis, 2015, 27(4):304-308. (in Chinese)
文海若, 淡墨, 齐乃松, 等. 多细胞系胞质分裂阻滞微核细胞组学试验法的建立与应用. 癌变·畸变·突变, 2015, 27(4):304-308.
[11] Lü LL, Liu TT, Shen CL, et al. In vitro characteristics of micronucleus cytomic effect of the two CdSeS/ZnS-COOH alloyed quantum dots. Carcinogenesis Teratogenesis Mutagenesis, 2015, 27(3):187-190, 196. (in Chinese)
吕路路, 刘甜甜, 沈春琳, 等. 两种荧光波长CdSeS/ZnS-COOH合金量子点微核组学效应特征的比较研究. 癌变·畸变·突变, 2015, 27(3):187-190, 196.
[12] Cao YY, Xi J, Tang WF, et al. Genotoxicity evaluation of triclosan in vitro. Carcinogenesis Teratogenesis Mutagenesis, 2018, 30(1):71-75. (in Chinese)
曹易懿, 奚晶, 唐伟锋, 等. 三氯生的体外遗传毒性评价. 癌变·畸变·突变, 2018, 30(1):71-75.
[13] Marzook NB, Newsome TP. Viruses that exploit actin-based motility for their replication and spread. Handb Exp Pharmacol, 2017, 235: 237-261.
[14] Etienne-Manneville S. Cytoplasmic intermediate filaments in cell biology. Annu Rev Cell Dev Biol, 2018, 34:1-28.
[15] Luzhna L, Kathiria P, Kovalchuk O. Micronuclei in genotoxicity assessment: from genetics to epigenetics and beyond. Front Genet, 2013, 4:131.
[16] Surrallés J, Natarajan AT. Human lymphocytes micronucleus assay in Europe. An international survey. Mutat Res, 1997, 392(1-2):165-174.
[17] von der Hude W, Kalweit S, Engelhardt G, et al. In vitro micronucleus assay with Chinese hamster V79 cells - results of a collaborative study with in situ exposure to 26 chemical substances. Mutat Res, 2000, 468(2):137-163.
[18] Zhao H. Preliminary study on nuclear bridge as a biomarker of radiation. Beijing: Chinese Center for Disease Control and Prevention, 2014. (in Chinese)
赵骅. 核质桥作为辐射生物标志物的初步研究. 北京: 中国疾病预防控制中心, 2014.
[19] The Organisation for Economic Co-operation and Development. OECD environment, health and safety publications series on the safety of manufactured nanomaterials No. 43 -- Genotoxicity of manufactured nanomaterials: report of the OECD expert meeting. (2014-12-03) [2018-12-12]. http://www.oecd.org/officialdocuments/ publicdisplaydocumentpdf/?cote=env/jm/mono(2014)34&doclanguage=en.
[20] Wen HR, Shao AL, Chen L, et al. Selection of appropriate genotoxicity testing methods for nanomaterialsl. Carcinogenesis Teratogenesis Mutagenesis, 2018, 30(4):326-331. (in Chinese)
文海若, 邵安良, 陈亮, 等. 适合纳米材料遗传毒性评价方法的选择. 癌变·畸变·突变, 2018, 30(4):326-331.
[21] Kalweit S, Utesch D, von der Hude W, et al. Chemically induced micronucleus formation in V79 cells--comparison of three different test approaches. Mutat Res, 1999, 439(2):183-190.
Comparison of cytochalasin A and B in the cytokinesis-blocking micronucleus assay
WEN Hai-ruo, REN Lu, LUO Fei-ya, WANG Qi
Institute for Safety Evaluation (WEN Hai-ruo, REN Lu), Institute for Cosmetics Control (LUO Fei-ya), Institute for Control of Chinese Traditional Medicine and Ethnic Medicine (WANG Qi), National Institutes for Food and Drug Control, Beijing 100050, China; School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China (REN Lu)
To compare the cytotoxicity and the effects of cytochalasin A (Cyto A) and cytochalasin B (Cyto B) on the results ofmicronucleus test on Chinese hamster lung (CHL) cells frequently used in micronucleus test.
The stress fiber structures formed by actin microfilaments were observed under fluorescence microscope, and the cytokinesis-blocking micronucleus test was performed to compare the multinuclear cell rate and micronucleus rate induced by Cyto A and Cyto B.
The cells were treated with different concentrations of Cyto A and Cyto B for 24 hours, and both treatment could significantly increase the multinuclear cell rate. For Cyto A and Cyto B treatment at 3.0 μg/ml, the multinuclear cell rate was 58% ± 12% and 72% ± 9%, respectively, compared with the control of 26% ± 7% (< 0.001). The multinuclear cell rate induced by Cyto A at 3.0 μg/ml was lower than that at 1.5 μg/ml. The micronucleus ratio of cells in Cyto A treatment group along with different concentration of MMC (0, 0.1 and 0.3 μg/ml) were 0.25% ± 0.16%, 1.98% ± 0.59% and 3.80% ± 0.90%, respectively; while the micronucleus ratio under similar conditions after Cyto B treatment was 0.32% ± 0.16%, 2.50% ± 0.61% and 5.05% ± 1.09%, respectively.
Although Cyto B showed slight better effects on establishing the multinucleated cell model, both Cyto A and Cyto B could be effectively used in the cytokinesis-blocking micronucleus test.
Cytochalasins; Micronucles test; Actins; Cytokinesis-block
WANG Qi, Email: sansan8251@sina.com; LUO Fei-ya, Email: feiya.luo@nifdc.org.cn
国家自然科学基金(81503347);国家十三五“重大新药创制”专项课题(2018ZX09201017)
汪祺,Email:sansan8251@sina.com;罗飞亚,Email:feiya.luo@nifdc.org.cn
2019-01-16
10.3969/j.issn.1673-713X.2019.02.003

