以高热稳定性的腺苷酸基琥珀酸合成酶为催化剂大量合成腺苷酸基琥珀酸(盐)
王楠,姜允嘉,王洋,赵晓宏,郭鹏,蔡大勇,谢勇
以高热稳定性的腺苷酸基琥珀酸合成酶为催化剂大量合成腺苷酸基琥珀酸(盐)
王楠,姜允嘉,王洋,赵晓宏,郭鹏,蔡大勇,谢勇
100193 北京,中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室
实现腺苷酸基琥珀酸(盐)(S-AMP)的大规模合成,为开展药物学等研究提供原料。
以 pET-28-a 为表达载体,利用大肠杆菌表达古细菌OT3 来源的腺苷酸基琥珀酸合成酶(PhAdSS),利用 Ni-NTA 层析柱纯化后作为催化剂在实验室内开展这种微生物体内合成 S-AMP 的反应。用 Bradford 法测定纯化后 PhAdSS 的浓度。利用硅胶薄层层析检测反应进度。用硅胶柱层析法和重结晶法纯化S-AMP,利用质谱法测定合成品中 S-AMP 的分子量,利用紫外分光光度法测定合成品内 S-AMP 的含量及回收率。
经纯化后从 1 L 的自动诱导培养基中至少获得 20 mg的His-tagged-PhAdSS。将含有 10 mmol/L 肌苷酸、11 mmol/L L-天冬氨酸、20 mmol/L 鸟苷三磷酸、4 mmol/L MgCl2、2.9 μmol/L 的 His-tagged-PhAdSS 溶液于常压环境中,70 ℃恒温6 h 以上可以实现 IMP 完全转化为 S-AMP。纯化后可得到 S-AMP 的单晶体,利用紫外分光光度法测定的纯度为 94%,收率为 17%。
实现了 PhAdSS 为催化剂的 S-AMP 的大量合成。
腺苷酸基琥珀酸(盐); 腺苷酸基琥珀酸合酶; 古细菌OT3
腺苷酸基琥珀酸(盐)[adenylosuccinic acid(adenylosuccinate),S-AMP]存在于所有生物体内,由腺苷酸基琥珀酸合成酶(adenylosuccinate synthetase,AdSS)利用肌苷酸(IMP)、L-天冬氨酸和鸟苷三磷酸(GTP)为原料合成[1]。S-AMP 是合成 AMP 的前体化合物,具有刺激胰岛素分泌,促进II型糖尿病患者胰岛 β 细胞恢复正常的功能[2]。我们发现在 HepG2 细胞内 S-AMP 能激活腺苷酸激活蛋白激酶(AMPK),提升细胞的糖脂质代谢效率[3-4]。因此,S-AMP 可作为改善糖脂代谢紊乱疾病新药的先导化合物开展成药性研究。仅有 Sigma公司曾经销售过纯度 96% 的 S-AMP,现已停产。为了保障 S-AMP 成药性研究的原料所需,首先要实现 S-AMP 的大量制备。
AdSS 反应底物都是价格低廉的生物化工产品,获得一定量的 AdSS 即可开展基于酶促反应的 S-AMP 的大规模合成。OT3 是分布于海底热泉喷口附近高温高压环境中的一种古细菌,最佳生长温度为 98 ℃[5]。这种微生物体内的AdSS(PhAdSS)比常温环境中生存的生物如细菌、高等动植物来源 AdSS 具有更高的热稳定性[5-6],更有利于大量制备。用 PhAdSS 可以在实验室或工厂内进行生物体内的S-AMP 合成反应,实现S-AMP 的大规模、低成本制备。本文报道大量制备 PhAdSS 并以其为催化剂实现 S-AMP 的合成及纯化。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 大肠杆菌的 DH5α 感受态细胞和 BL21(DE3) 感受态细胞购自北京全式金生物技术公司;pET-28-a 购自美国 Novagen公司;pET-19-b-PhAdSS 质粒由本实验室保存。
1.1.2 主要试剂 胰蛋白胨、酵母提取物购自英国 Oxoid 公司;α-乳糖、葡萄糖购自上海国药集团;限制性 DNA 内切酶I 和H I、T4 DNA 连接酶购自美国 Transgen公司;质粒小提试剂盒、胶回收试剂盒购自美国 Genstar 公司;十水合磷酸氢二钠、磷酸二氢钾、氯化铵、硫酸镁、硫酸钠等试剂由北京化工厂生产;硫酸卡那霉素、IPTG、Tris、SDS 和 EDTA 等由美国 Amresco公司提供;腺苷酸基琥珀酸(含量 96%)、丙烯酰胺、甲叉双丙烯酰胺由美国 Sigma公司提供;Ni-NTA 蛋白质层析填料购自中国科学院过程工程研究所。合成S-AMP 的原料 IMP、GTP 和 L-天冬氨酸为希杰(聊城)生物技术公司生产,纯度大于 90%;HSGF254 型硅胶层析板由烟台市化学工业研究所制造。
1.1.3 主要仪器 LQ-A30002 型电子天平、恒压恒流电泳仪电泳槽购自美国 Bio-Rad 公司;HZQ 系列振荡培养箱和TD5A 型离心机购自金坛市科析仪器有限公司;DHP-9082 型电热恒温培养箱购自上海一恒科技有限公司;TGL-16 型高速台式冷冻离心机购自湖南湘仪离心机仪器有限公司;Envision 2104-0010 型酶标仪购自美国 Perkin Elmer 公司;Nano drop 2000C 紫外分光光度计购自美国 Thermo 公司。
1.2 方法
1.2.1 PhAdSS 的制备 利用 pET-19-b 原核表达载体成功实现了PhAdSS 的表达、纯化、结晶化[6]和晶体结构测定(PDB ID:2D7U,5K7X)。本项研究以 His-tagged-PhAdSS 为催化剂合成 S-AMP,为了减少 His-tag 融合蛋白的N 末端的序列,改用 pET-28-a 载体表达N 末端带有 MGSSHHHH HHSSGLVPRGSH 序列的 His-tagged-PhAdSS。在 20 μl 的pET-28-a(1 μg/ml)和 pET-19-b-PhAdSS(1 μg/ml)溶液中分别加入限制性内切酶I 和H I 各 1 μl,37 ℃下反应 2 h 后用 1% 的琼脂糖凝胶电泳进行产物分离。100 V 电压下电泳40 min,从琼脂糖凝胶中回收 pET-28-a 和 PhAdSS,操作依据 DNA 胶回收试剂盒的条件开展;取 1 μl 的 pET-28-a 与 3 μl 的 PhAdSS 的 cDNA 混合,加入 0.5 μl 的 T4 DNA 连接酶和 0.5 μl 的 T4 DNA 连接酶反应溶液,16 ℃下反应 16 h。将反应生成的 pET-28-a-PhAdSS 质粒转化到大肠杆菌 DH5α 感受态细胞内,37 ℃恒温箱中在含有 50 μg/ml 硫酸卡那霉素的 LB 固体平板培养基上过夜培养,得到的转化子用含有 50 μg/ml 硫酸卡那霉素的 LB 液体培养基 37 ℃下培养 12 h,用质粒小提试剂盒提取 pET-28-a-PhAdSS 质粒。而后将质粒 pET-28-a-PhAdSS 转化到大肠杆菌 BL21(DE3) 感受态细胞内,利用自动诱导大肠杆菌表达法[7]表达 PhAdSS,转化子接种于自动诱导培养基(1 L自动诱导培养基内含有胰蛋白胨10 g、酵母提取物 5 g、磷酸氢二钠 8.95 g、磷酸二氢钾 3.4 g、氯化铵 2.67 g、硫酸钠 0.71 g、硫酸镁 0.5 g、甘油 15 ml、葡萄糖 0.5 g、α-乳糖 2 g、氯化铁0.03 g)内,37 ℃培养 24 h 后室温下离心沉降大肠杆菌细胞。每升培养基内回收的大肠杆菌细胞用 15 ml 的上样缓冲液[20 mmol/L Tris-HCl(pH 8.0)、500 mmol/L NaCl、20 mmol/L咪唑]悬浮,70 ℃恒温 20 min 后让样品的温度缓慢降至室温。4℃,12 000 ×离心 20 min 去除产生的变性蛋白质等沉淀;上清液流经柱体积 10 ml 的 Ni-NTA 蛋白质层析柱后,用 60 ml 的上样缓冲液流过 Ni-NTA 蛋白质层析柱洗去杂质,然后用 30 ml 的洗脱液[20 mmol/L Tris-HCl(pH 8.0)、500 mmol/L NaCl、200 mmol/L 咪唑]将His-tagged-PhAdSS 从层析柱上洗脱出来,回收样品用 SDS-PAGE 检测纯度,用 Bradford 法测定纯化后的蛋白质浓度。蛋白质层析分离在室温下进行。柱层析法纯化 His-tagged-PhAdSS 的流速约为 5 ml/min。
1.2.2 PhAdSS 的活性研究 测定反应开始后特定时间下反应体系的290可以计算 S-AMP 的浓度,据此可以判断酶活性的大小[8-9]。酶标仪测定反应开始后体系的290,确定 PhAdSS 的最佳活性条件。
1.2.2.1 酸度对 PhAdSS 活性的影响 反应体系中含有500 μmol/L IMP、250 μmol/L GTP、10 mmol/L 天冬氨酸和 0.12 μmol/L(0.9 μg)PhAdSS。用醋酸盐缓冲溶液、MES 缓冲盐溶液以及 Tris-HCl 缓冲溶液控制 pH 值分别在4.0 ~ 5.0、5.5 ~ 6.5 和7.0 ~ 8.0 范围。缓冲溶液的浓度为 30 mmol/L。50℃环境中测定反应体系 pH 值分别为 4.5、5.0、5.5、6.0、6.5、7.0、7.5 和 8.0 的反应初始速率,以此作为判断酶活性大小的依据。
1.2.2.2 温度对 PhAdSS 活性的影响 依据 PhAdSS 的活性对酸度的依存性实验结果,选定在 pH 7.5 条件下,检测温度对 PhAdSS 催化活性的影响。在酶反应体系含有 30 mmol/L Tris-HCl(pH 7.5)、15 mmol/L 醋酸镁、500 μmol/L IMP、250 μmol/L GTP、10 mmol/L 天冬氨酸和0.12 μmol/L(0.9 μg)的 PhAdSS。测定 30、37、40、50℃温度环境中的反应初始速率作为衡量酶活性的标准。
1.2.3 S-AMP 的实验室小试合成
1.2.3.1 S-AMP 合成反应装置和条件 为了保证 IMP 能完全转化为 S-AMP,兼顾 S-AMP 合成效率,设定反应体积 0.5 L;反应体系配方为10 mmol/L IMP、20 mmol/L GTP、11 mmol/L L-天冬氨酸、4 mmol/L MgCl2,His-tagged-PhAdSS 浓度分别为 80、100、200 mg/L,根据 PhAdSS 活性分析结果,用 10 mol/L 的 NaOH 调节反应体系 pH 为7.5,由于 S-AMP 具有良好的热稳定性,温度增加有利于提高反应速度。因此,反应体系设定在 70 ℃水浴锅内缓慢搅拌 20 h。用硅胶薄层层析法检测反应进行时间段的 IMP 转化率。
1.2.3.2 合成反应体系成分鉴定 合成反应结束后,利用硅胶薄层层析法分析产物中的成分。展开剂中异丙醇和 6.25% 氨水的体积百分比分别为 65% 和 35%(展开剂配方为本项研究中确定,对 IMP 和 S-AMP 有良好的分离)。
1.2.4 S-AMP 纯化
1.2.4.1 硅胶柱层析 根据分离样品的极性差异,用硅胶薄层层析法检测能让S-AMP 和 GDP 在硅胶层上迁移速率相差最大的展开剂配方,流动相中无水乙醇和 6.25% 氨水的体积比为 6:4 可实现 S-AMP 和 GDP 的最大分离。称取分离样品总质量 50 倍的 H 硅胶(200 ~ 300 目),用无水乙醇调成糊状,填充至层析柱内,层析柱直径为18 cm,硅胶填充高度 20 cm。打开层析柱下部活塞,让无水乙醇尽量流出,硅胶层中不得残留气泡。
合成反应完成后调节反应溶液 pH 值为 2.9,室温下放置 10 h,让过量的 L-天冬氨酸析出。过滤去除固体后,上清液转移至蒸发皿内,用蒸气浴法浓缩至原来体积的 20%,溶液中的不溶物过滤去除。用分离硅胶质量十分之一的上样硅胶(60 ~100 目)吸附待分离样品,加入到分离硅胶层上,高度不超过 0.5 cm。胶层顶部放上一张圆形滤纸,防止加入流动相时液体扰乱硅胶层。加入体积相当于硅胶柱体积 1.5 倍的流动相溶液。室温下按每瓶 50 ml 回收流出液。溶液内成分用硅胶薄层层析检测。展开剂中乙醇和 6.25% 氨水体积百分比分别为 65% 和 35%。
1.2.4.2 S-AMP 重结晶 合并 S-AMP 为单一成分的流出液,用 10 mol/L NaOH 水溶液调节pH 值至 10,用旋转蒸发法去除有机溶剂和氨后,将剩余水溶液 pH 值调节为 3,在空气浴上蒸干。37℃恒温箱内用 60% 乙醇水溶液溶解固体至饱和。过滤去除不溶物后将溶液温度降低到室温,然后于–20℃冰箱内放置 10 h 以上,让 S-AMP 重结晶,而后在室温下迅速抽滤去除液体。
1.3.4.3 产物内 S-AMP 的定性和定量分析 配制浓度为 0.2 mmol/L 的S-AMP 标准品和合成品溶液,测定紫外吸收光谱;而后配制 S-AMP 标准溶液,用工作曲线法测定重结晶样品中 S-AMP 的含量。质谱法测定分子量:取 1 mg 合成品溶解于 5 ml 甲醇中,用 DFS 质谱分析仪测定样品中各成分的分子量。
2 结果
2.1 PhAdSS 的制备
纯化 His-tagged-PhAdSS 各阶段的蛋白质样品 SDS-PAGE经过 Ni-NTA 柱层析后,无杂质蛋白被检出(图 1)。用 Bradford 法测定蛋白质浓度计算蛋白总量,多次试验结果证明,从1 L 自动诱导培养基可得到不少于 20 mg 的 His-tagged-PhAdSS。

M:标准分子量蛋白质;1:大肠杆菌破碎后的可溶性蛋白;2:70 ℃恒温去除变性蛋白的样品;3:70 ℃恒温产生的变性蛋白;4:Ni-NTA 柱层析纯化后的蛋白样品
M: Marker; 1: Soluble proteins fromcells; 2: Sample after removed denatured protein incubated at 70 ℃; 3: Denatured proteins generated at 70 ℃; 4: Protein sample purified by Ni-NTA column chromatography
图 1 纯化 PhAdSS 各阶段的蛋白质样品的 SDS-PAGE
Figure 1 SDS-PAGE of purification stages of PhAdSS
2.2 PhAdSS 的活性
在50℃,溶液的 pH 6.0 以下时 PhAdSS 的活性低,pH 值从 6.0增加到 6.5 时,PhAdSS 的活性有显著性增加,pH 6.5 ~ 8.0 环境中 PhAdSS 的活性是测试条件中最好的(图 2A)。在 pH 7.5 的条件下检测温度对 PhAdSS 活性的影响,结果如图 2B 所示,40℃以下环境中 PhAdSS 无明显的活性,当温度达 50 ℃时,PhAdSS 的活性显示突跃式增加。酶标仪能控制最大温度为 55 ℃。在55℃环境中测定的结果由于 96 孔微孔板中样品很快蒸发,结果准确度欠佳。根据 PhAdSS 在温度高于 70 ℃环境中不变性[6]的特点,可以认为在50℃以上温度环境中,PhAdSS 的活性应该增大。为了提高反应速度,在小试合成研究中选用 pH 7.5 和 70 ℃条件下以 PhAdSS 为催化剂开展 S-AMP 的小试合成。
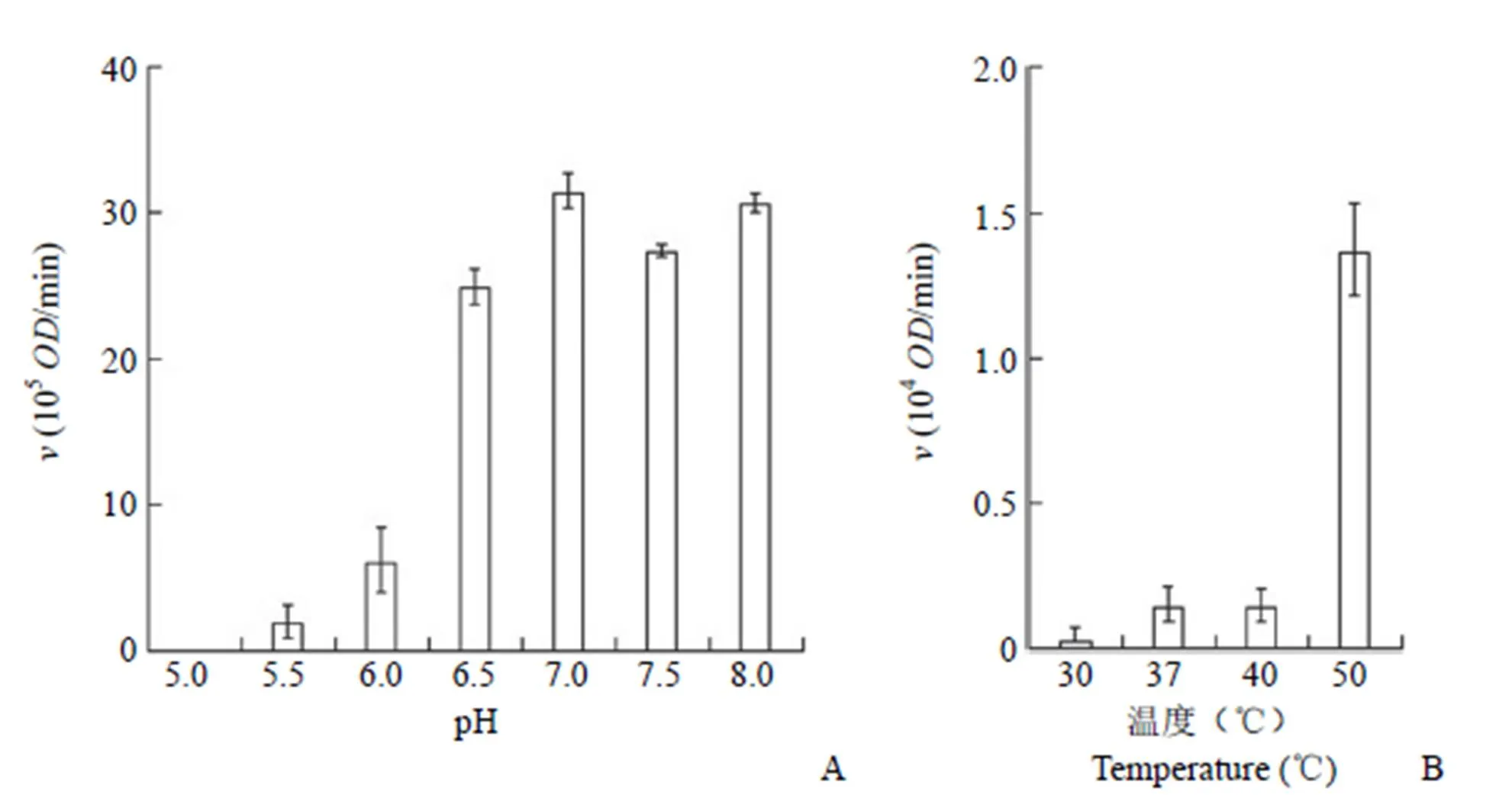
图 2 反应体系的 pH(A)和温度(B)对 PhAdSS 活性的影响
Figure 2 pH (A) and temperature (B) of the reaction system effect on the PhAdSS activity

图 3 硅胶薄层层析鉴定的不同浓度 PhAdSS 作为催化剂反应开始后一定时间的反应体系成分的结果
Figure 3 Compositions of the reaction system were identified using the silica gel thin-layer chromatography with various concentrations PhAdSS as a catalyst and at a certain time after the reaction started
2.3 S-AMP 合成反应条件
合成后 S-AMP 用硅胶薄层层析检测,结果见图 3,酶浓度为 2.3 μmol/L(80 μg/ml)的反应体系中,尽管反应时间超过10 h,IMP 仍不能完全转化为 S-AMP;酶浓度为2.9 μmol/L 的反应体系中,反应时间超过 6 h,反应体系中已无 IMP 检出,可以认为 IMP 完全转化为 S-AMP;酶浓度为 5.8 μmol/L 的反应体系中,反应时间超过2 h,IMP 可完全地转化为 S-AMP。因此可认为 His-tagged-PhAdSS 能使 IMP 完全转化为 S-AMP 的最低浓度是2.9 μmol/L,至少反应 6 h。反应体系放大为 2 L 也能达到同样的转化效果。
2.4 产物中 S-AMP 的定性分析结果
迄今为止无 S-AMP 的紫外吸收光谱被报道,0.2 mmol/L 的 Sigma 产S-AMP 的紫外吸收光谱(图 4A)和本研究合成的 S-AMP 的紫外吸收光谱(图 4B)都显示 S-AMP 的最大吸收波长是266 nm,根据 Sigma 产S-AMP 的266 nm计算 S-AMP 的266 nm为 1.94 × 105L/(mol·cm)。依据该波长下测定的 S-AMP 的266 nm浓度工作曲线(图 4C)计算的合成品中 S-AMP 的含量为 94%,获得的 S-AMP 质量为 0.394 g,理论产量为 2.31 g,收率为 17%。

图 4 0.2 mmol/L 的 Sigma 公司产 S-AMP 的紫外吸收光谱(A)和同样浓度下 S-AMP 合成品的紫外吸收光谱(B)、浓度标准曲线(C)、质谱图(D)
Figure 4 UV spectrum of 0.2 mmol/L S-AMP from Sigma (A) and synthesized in this study (B), concentration standard curve (C), mass spectrometry (D) of S-AMP synthesized in this study
利用 TQD 质谱仪的高分辨率阴离子法测定的合成品中 S-AMP 的分子量为 462.0655(图 4D),化合物数据库收录的阴离子质谱法测定的 S-AMP 分子量为 462.066,两者相同,与 Sigma 公司提供的S-AMP 的分子量也相同。质谱图中无 IMP、GDP 等峰出现,证明样品中的杂质可能来源于反应原料并且对紫外光没有吸收的功能,需要利用 HPLC-MS 等方法进一步开展研究。
3 讨论
先导化合物的成药性研究需要大量样品作为支撑,实现药物先导化合物的低成本合成是保障药物研究经济性的前提。对 S-AMP 的合成研究而言,已有研究阐明了 S-AMP 在解偶联嘌呤核苷酸代谢通路中的位置,即由 AdSS 利用 IMP、L-天冬氨酸和 GDP 合成。对 AdSS 的反应机制已开展了 50 多年的研究,已有大肠杆菌、疟原虫、兔等来源的酶促反应动力学研究论文发表[8-11],但未见 S-AMP 的大规模化学合成或生物合成的研究成果发表。
AdSS 存在于所有生物体内,美国 National Center for Biotechnology Information(NCBI)数据库内已经登录了约三万种不同生物来源的 AdSS 的基因序列和氨基酸序列。已知几乎所有生物体内的 AdSS 含有 430 ~ 470 个氨基酸,分子量为45 ~ 50 kD。另外,有极少数 AdSS 含有 330 ~350 个氨基酸,分子量为 36 ~ 39 kD。这些小分子量的AdSS 可以归纳为 AdSS 中的特殊一类,小分子量 AdSS 主要存在于古细菌体内。迄今为止,对大肠杆菌[12-15]、拟南芥和小麦[16]、疟原虫[17]、小鼠[18-19]等常温生物体内的大分子量 AdSS 的晶体结构(一部分物种来源的 AdSS 晶体结构中结合了底物或底物的结构类似物)和 PhAdSS 的晶体结构(PDB ID:2D7U,5K7X)证明,AdSS 具有活性中心结构的高度相似性。大分子量 AdSS 的稳定性较差,纯化困难,未见利用生物催化剂实现 S-AMP 大量制备的报道。古细菌来源的小分子量 AdSS 具有良好的热稳定性,本项研究基于 PhAdSS 的高热稳定性,利用蛋白质热变性沉淀原理简便地实现了 His-tagged-PhAdSS 的大量纯化,以其为催化剂实现了 S-AMP 的实验室小试制备。从合成产物中纯化 S-AMP 的方法简单,纯化步骤短,实现了实验室内大规模、低成本合成 S-AMP,有望发展为工业化生产 S-AMP 的新工艺,为开展 S-AMP 的成药性研究等保障原料供应。
志谢 中国医学科学院北京协和医学院医药生物技术研究所司书毅教授帮助实施 PhAdSS 活性研究,在此表达诚挚谢意。
[1] Bubić A, Mrnjavac N, Stuparević I, et al. In the quest for new targets for pathogen eradication: the adenylosuccinate synthetase from the bacterium Helicobacter pylori. J Enzyme Inhib Med Chem, 2018, 33(1):1405-1414.
[2] Gooding JR, Jensen MV, Dai X, et al. Adenylosuccinate is an insulin secretagogue derived from glucose-induced purine metabolism. Cell Reports, 2015, 13(1):157-167.
[3] Qian HL. Pharmacological study on the structure and function of small molecular weight Adenylosuccinate synthase and its products. Beijing: Peking Union Medical College, 2014.(in Chinese)
钱火连. 小分子量腺苷酸基琥珀酸合成酶的结构与功能及其产物的药理学研究. 北京: 北京协和医学院, 2014.
[4] Thomson DM, Winder WW. AMP-activated protein kinase control of fat metabolism in skeletal muscle. Acta Physiol (Oxf), 2010, 196(1): 147-154.
[5] Kawarabayasi Y, Sawada M, Horikawa H, et al. Complete sequence and gene organization of the genome of a hyper-thermophilic archaebacterium, pyrococcus horikoshii OT3. DNA Res, 1998, 5(2): 55-76.
[6] Wang X, Akasaka R, Takemoto C, et al. Overexpression, purification, crystallization and preliminary crystallographic studies of a hyperthermophilic adenylosuccinate synthetase from Pyrococcus horikoshii OT3. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2011, 67(Pt 12):1551-1555.
[7] Di Gennaro P, Ferrara S, Bestetti G, et al. Novel auto-inducing expression systems for the development of whole-cell biocatalysts. Appl Microbiol Biotechnol, 2008, 79(4):617-625.
[8] Raman J, Mehrotra S, Anand RP, et al. Unique kinetic mechanism of Plasmodium falciparum adenylosuccinate synthetase. Mol Biochem Parasitol, 2004, 138(1):1-8.
[9] Wang W, Gorrell A, Honzatko RB, et al. A study of Escherichia coli adenylosuccinate synthetase association states and the interface residues of the homodimer. J Biol Chem, 1997, 272(11):7078-7084.
[10] Borza T, Iancu CV, Pike E, et al. Variations in the response of mouse isozymes of adenylosuccinate synthetase to inhibitors of physiological relevance. J Biol Chem, 2003, 278(9):6673-6679.
[11] Muirhead KM, Bishop SH. Purification of adenylosuccinate synthetase from rabbit skeletal muscle. J Biol Chem, 1974, 249(2): 459-464.
[12] Silva MM, Poland BW, Hoffman CR, et al. Refined crystal structures of unligated adenylosuccinate synthetase fromescherichia coli. J Mol Biol, 1995, 254(3):431-446.
[13] Fonné-Pfister R, Chemla P, Ward E, et al. The mode of action and the structure of a herbicide in complex with its target: binding of activated hydantocidin to the feedback regulation site of adenylosuccinate synthetase. Proc Natl Acad Sci U S A, 1996, 93(18):9431-9436.
[14] Choe JY, Poland BW, Fromm HJ, et al. Mechanistic implications from crystalline complexes of wild-type and mutant adenylosuccinate synthetases from Escherichia coli. Biochemistry, 1999, 38(21):6953- 6961.
[15] Hou Z, Wang W, Fromm HJ, et al. IMP alone organizes the active site of adenylosuccinate synthetase from escherichia coli. J Biol Chem, 2002, 277(8):5970-5976.
[16] Prade L, Cowan-Jacob SW, ChemLa P, et al. Structures of adenylosuccinate synthetase from Triticum aestivum and Arabidopsis thaliana. J Mol Biol, 2000, 296(2):569-577.
[17] Eaazhisai K, Jayalakshmi R, Gayathri P, et al. Crystal structure of fully ligated adenylosuccinate synthetase from plasmodium falciparum. J Mol Biol, 2004, 335(5):1251-1264.
[18] Iancu CV, Borza T, Choe JY, et al. Recombinant mouse muscle adenylosuccinate synthetase: overexpression, kinetics, and crystal structure. J Biol Chem, 2001, 276(45):42146-42152.
[19] Iancu CV, Borza T, Fromm HJ, et al. IMP, GTP, and 6-phosphoryl-IMP complexes of recombinant mouse muscle adenylosuccinate synthetase. J Biol Chem, 2002, 277(30):26779- 26787.
Large-scale synthesis of adenylosuccinate using a high thermal stability adenylosuccinate synthetase as a bio-catalyst
WANG Nan, JIANG Yun-jia, WANG Yang, ZHAO Xiao-hong, GUO Peng, CAI Da-yong, XIE Yong
Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Beijing 100193, China
To set up a large-scale synthesis system of adenylosuccinate (S-AMP) for providing mass chemical resources in pharmaceutical studies.
Adenylosuccinate synthetase (AdSS) from archaeaOT3 (PhAdSS) was expressed incells using the pET-28a vector as a His-tagged fusion protein. The His-tagged-PhAdSS was purified by a Ni-NTA column. Concentration of the His-tagged-PhAdSS was determined using the Bradford method. The His-tagged-PhAdSS was used as a catalyst to perform large-scale synthesis of S-AMP. Analysis of the reaction progress was carried out using the silica gel thin-layer chromatography. S-AMP was purified using the silica gel column chromatography and re-crystallization. The molecular weight of synthesized S-AMP was measured using mass spectrometry. The concentration of S-AMP in the synthesized sample and yield of the large-scale synthesis system were determined using the UV spectrophotometry.
More than 20 mg His-tagged-PhAdSS could be obtained from per liter of auto-induce medium. Under a normal pressure environment, IMP can completely be converted to S-AMP in a solution containing 10 mmol/L inosine mono-phosphate (IMP), 11 mmol/L L-aspartate, 20 mmol/L guanosine tri-phosphate (GTP), 4 mmol/L MgCl2and 2.9 μmol/L His-tagged-PhAdSS, with gently stirring at 70 ℃ for more than 6 hours. After purification, single crystal of S-AMP was obtained. Yield and recovery rate of the large-scale synthesis system of S-AMP set up in this study were 94% and 17%, respectively.
A large-scale synthesis system of S-AMP is set up using PhAdSS as a bio-catalyst.
Adenylosuccinic acid (Adenylosuccinate); Adenylosuccinate synthase;OT3
XIE Yong, Email: xyosaka@163.com, yxie@implad.ac.cn
国家自然科学基金(81473114)
谢勇,Email:xyosaka@163.com、yxie@implad.ac.cn
10.3969/j.issn.1673-713X.2019.02.002
2018-12-20

