不同刺激剂对淋巴细胞中PD-1与TIM3蛋白表达的影响
李凌,来芳芳,杜婷婷,张森,刘盈,陈晓光
不同刺激剂对淋巴细胞中PD-1与TIM3蛋白表达的影响
李凌,来芳芳,杜婷婷,张森,刘盈,陈晓光
100050 北京,中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室/创新药物非临床药物代谢及PK/PD研究北京市重点实验室
研究不同刺激剂对人外周血淋巴细胞中 PD-1 与 TIM3 蛋白表达的影响。
采用密度离心法分离人外周血淋巴细胞,并通过 Western blot 检测在抗CD3/CD28 抗体、PHA、SEB、ConA 4 种不同刺激剂下人外周血淋巴细胞 PD-1 与 TIM3 总蛋白的变化情况,并通过流式细胞技术检测 4 种刺激条件下 T 淋巴细胞及其 CD3+CD4+、CD3+CD8+亚群膜表面的 PD-1 与 TIM3 的改变。
Western blot 结果显示,4 种刺激剂均能刺激总的 PD-1 蛋白的表达,减少总 TIM3 蛋白的表达。流式细胞分析仪结果显示,在 4 种刺激剂作用下,人外周血 T 淋巴细胞表面及其 CD3+CD4+、CD3+CD8+T 细胞亚群膜表面的 PD-1 与 TIM3 蛋白表达均呈现升高趋势。
4 种常见刺激剂均可诱导总 PD-1 蛋白和细胞膜上 PD-1 蛋白的表达,降低 TIM3 总蛋白的表达以及诱导淋巴细胞表面 TIM3 蛋白的表达。其中 PHA 较其他 3 种刺激剂展现出较好的剂量关系。
程序性细胞死亡受体 1; T 细胞免疫球蛋白黏液素 3; 淋巴细胞增殖; 流式细胞术
肿瘤免疫疗法是继传统的肿瘤治疗,即化疗、放疗和手术切除之后的第四种肿瘤治疗方法[1],其通过重新启动并维持肿瘤-免疫循环,恢复机体正常的抗肿瘤免疫反应。近年来,针对以程序性细胞死亡受体 1(programmed cell death protein 1,PD-1)为代表的免疫检查点的治疗,已成为一种重要而有效的免疫疗法[2]。
PD-1 是一种在激活的淋巴细胞上表达的抑制性受体,通过与肿瘤细胞表面表达的程序性细胞死亡配体 1(programmed cell death ligand 1,PD-L1)结合,调节 T 细胞激活,介导肿瘤细胞的免疫逃逸[3-4]。T 细胞免疫球蛋白黏液素 3(T cell immunoglobulin and mucin 3,TIM3)是细胞表面膜蛋白[5-6],通过与其配体半乳糖凝集素 9(galectin 9,Gal-9)的结合,诱导 T 淋巴细胞耗竭或凋亡[7]。
在肿瘤免疫治疗药物的研发过程中,通过某种特定的刺激剂激活 T 淋巴细胞的增殖与活化是一种常用的实验方法[8]。因此,本文选用 4 种刺激剂,即抗 CD3/CD28 抗体(anti-CD3/CD28 antibody)、植物血凝素(phytohaemagglutinin,PHA)、金黄色葡萄球菌 B 型肠毒素(Enterotoxin B,SEB)、刀豆蛋白 A(concanavalin A,ConA)刺激人外周 T 淋巴细胞的增殖,以免疫检查点 PD-1 和 TIM3 作为研究对象,研究在 T 淋巴细胞增殖状态下 PD-1 与 TIM3 两种蛋白的变化情况,为探究 PD-1 与 TIM3 的关系提供实验基础。
1 材料与方法
1.1 材料
1.1.1 研究样本 健康志愿者的抗凝全血由中国食品药品检定研究院赠予。
1.1.2 试剂 人外周血淋巴细胞分离液购自北京达科为生物技术有限公司;PHA、SEB 和 ConA 购自美国 Sigma 公司;人源抗 CD3、CD28 抗体购自美国 Miltenyi Biotec 公司;RPMI 1640 培养基和胎牛血清购自美国 Gibco 公司;FITC 抗人 CD3抗体、PE 抗人CD4 抗体、APC 抗人CD8 抗体、PE/Cy7 抗人PD-1 抗体和 APC/Cy7 抗人TIM3 抗体购自美国Biolegend 公司;BCA 蛋白浓度测定试剂盒购自北京碧云天生物技术有限公司。
1.1.3 仪器 FACSVerse 流式细胞仪为美国 BD 公司产品;CO2培养箱为日本三洋公司产品;冷冻离心机为美国 Sigma 公司产品。
1.2 方法
1.2.1 淋巴细胞的制备 将健康志愿者的新鲜抗凝血与等体积的磷酸缓冲盐溶液(PBS)混合稀释,再缓慢加至一定体积的淋巴细胞分离液上方,保持两液面界面清晰(分离液、抗凝未经稀释的全血、PBS 体积比为 1:1:1)。于室温,以 800 ×离心 30 min。离心结束后,小心吸取中间的一层薄而致密的白膜(淋巴细胞层)至另一层离心管中,用PBS 重悬洗涤 2 次,计数,调整细胞浓度为 1 × 108个/ml。
1.2.2 不同刺激剂刺激淋巴细胞 将上述细胞接种至 12 孔细胞培养板中,于5% CO2细胞培养箱中培养 6 h,分别在每孔加入不同剂量的刺激剂,抗 CD3/CD28 抗体(终浓度:0.001、0.01、0.1 μg/ml)、PHA(终浓度:0.2、1、5 μg/ml)、SEB(终浓度:10、50、250 ng/ml)、ConA(终浓度:0.125、0.5、2 μg/ml),每组实验做 3 个平行孔,置于 37 ℃、5% CO2细胞培养箱中继续孵育 48 和 72 h。
1.2.3 Western blot 检测蛋白表达变化
1.2.3.1 总蛋白提取 将处理过的细胞收集到空 EP 管中,450 ×离心 5 min,收集细胞,以预冷的 PBS 漂洗 2 次,加入适量 RIPA 裂解液(10 mmol/L Tris-HCl pH 7.4、5 mmol/L EDTA、1% Triton X-100、150 mmol/L NaCl、0.1 mmol/L PMSF)后冰上裂解 1 h 后,于 4 ℃、12 000 r/min 离心25 min,收集上清液,进行蛋白定量。
1.2.3.2 蛋白含量的测定 按试剂盒说明,梯度稀释 BSA 标准品,96 孔板中每孔加入 10 μl 标品液及待测样品液,再加入 100 μl 的 A、B 混合液(A:B = 50:1),轻轻振荡混匀后放置于 37 ℃孵箱孵育 30 min,于 595 nm 波长测定标品和样品的光密度值。绘制标准曲线,拟合得出标准曲线方程,将测得各样品的光密度值代入标准曲线求得样品的蛋白浓度。
1.2.3.3 SDS-PAGE 电泳与转膜 配制 5% 的浓缩胶和 10% 的分离胶。将上述已测定完成蛋白含量的样品稀释至同一浓度,与 5 × SDS 上样缓冲液混合,煮沸冷却后上样,每孔蛋白上样量为30 μg,采用恒压 80 V 电泳。电泳结束后,进行转膜,恒定电压 100 V 于冰水浴中转移 100 min。
1.2.3.4 免疫杂交和显影 将电转后的 PVDF 膜用加入 5% 脱脂奶粉的含有 0.05% Tween-20 的 Tris盐缓冲液(TBS-T)室温封闭非特异性结合位点 30 min。加入合适稀释比例(1:500 ~ 1:1000)的一抗,4 ℃孵育过夜。第二天,TBS-T 缓冲液洗膜 3 次,每次 5 min。加入 1:2000 稀释的 HRP 标记的二抗,室温孵育 2 h。用 TBS-T 缓冲液清洗膜 3 次,每次 10 min。加入 ECL 化学发光底物反应液,于凝胶成像系统内显影并保存图像,用 Image J 对目的条带的灰度值进行分析,并以 β-actin 为内参,对目的条带的表达量进行定量分析并统计。
1.2.4 流式细胞术检测蛋白表达变化
1.2.4.1 流式抗体标记淋巴细胞 收集 1.2.2 中培养 72 h 的淋巴细胞,取 106个细胞于 EP 管中,450 ×离心 5 min,以预冷的 PBS 洗 2 次,弃上清后 PBS 重悬细胞,每管按抗体说明书加入相应量的 CD3、CD4、CD8、PD-1、TIM3 流式抗体,避光冰上染色 1 h,然后加入 1 ml PBS 终止染色。
1.2.4.2 流式细胞术检测淋巴细胞表面 PD-1 与 TIM3 蛋白改变 将染色后细胞用预冷的 PBS 洗涤 2 次,并用 200 μl PBS 重悬,采用流式细胞检测仪检测淋巴细胞表面 PD-1 与 TIM3 表面蛋白的表达情况。
1.3 统计学处理
2 结果
2.1 4 种刺激剂不同浓度下对 PD-1 与 TIM3 总蛋白的影响
用 Image J 对目的条带的灰度值进行分析,并以 β-actin 为内参,对目的条带的表达量进行定量分析并统计,结果如图 1。在抗 CD3/CD28 抗体、PHA、SEB 以及 ConA 的刺激下,人外周血淋巴细胞的 PD-1 表达均有上调,TIM3 表达均有下调。其中在 PHA 刺激下,条带展现出剂量依赖性地促进 PD-1 的表达,在 PHA 5 μg/ml 浓度的刺激下,PD-1 上调最为明显。SEB 相比于其他 3 种刺激剂可更为明显地抑制 TIM3 的表达。为观察刺激时间长短对 PD-1 与 TIM3 总蛋白的影响,分别于 48 和 72 h 时对目的蛋白收样检测。结果显示,在 PHA 及 ConA 刺激下,相比于 48 h,72 h 表现出更好的剂量依赖性上调PD-1 和抑制 TIM3 表达作用。

图 1 4 种刺激剂在不同浓度刺激下PD-1 与TIM3 总蛋白的表达情况(与对照组相比,*P ≤0.05,**P ≤0.01,***P ≤0.001)
Figure 1 Total PD-1 and TIM3 expression in human peripheral blood lymphocytes under four different stimulators (compared with control group,*≤0.05,P≤0.01,P≤0.001)
2.2 流式细胞分析仪检测 T 淋巴细胞表面 PD-1 的改变
以 CD3+FITC 流式抗体标识 T 淋巴细胞,对人外周血淋巴细胞进行流式细胞分析仪检测。采用 Flowjo7.6 软件对 T 淋巴细胞表面 PD-1蛋白的改变进行分析。如图 2A 和 2C 所示,随着抗 CD3/CD28 抗体浓度由 0.001 μg/ml 增加至0.1 μg/ml,PE-CY7 荧光强度增强,平均荧光强度由未加刺激的 199 ± 3增加至 1146 ± 156,PD-1表达上调。随着 PHA 浓度由 0.2 μg/ml 增加至5 μg/ml,PE-CY7 荧光强度(240 ± 17、1161 ± 127、2257.5 ± 209.5)逐渐增强,PD-1 蛋白表达逐渐增多,并表现出剂量依赖性。随着 SEB 浓度由10 ng/ml 增加至250 ng/ml,PE-CY7 荧光强度(1408.5 ± 176.5、1962 ± 85、2260 ± 130)逐渐增强,提示较少的剂量即可显著上调 PD-1 的表达,其最高剂量与 PHA 5 μg/ml 刺激后效果相当。随着 ConA 浓度由 0.125 μg/ml 增加至 2 μg/ml,PE-CY7 荧光强度分别为 740 ± 142、1597.5 ± 104.5、2048.5 ± 105.5,PD-1 表达依次上调。综上,在 PHA 与 ConA 的刺激下,PD-1 表达上调有明显剂量依赖性,PHA、SEB、ConA 此 3 种刺激剂上调 PD-1 表达最为显著。

图 2 T 淋巴细胞表面PD-1 与TIM3 的蛋白表达(A:4 种刺激剂下PD-1 荧光变化流式图;B:4 种刺激剂下TIM3 荧光变化流式图;C:PD-1 平均荧光强度统计图;D:TIM3 平均荧光强度统计图;与对照组相比,*P ≤0.05,**P≤ 0.01,***P≤ 0.001)
Figure 2 Expression of PD-1 and TIM3 on T lymphocytes membrane (A: PD-1 expression was evaluated by flow cytometry under four stimulators; B: TIM3 expression was evaluated by flow cytometry under four stimulators; C: Statistical graph of mean fluorescence intensity of PD-1; D: Statistical graph of mean fluorescence intensity of TIM3; compared with control group,P ≤0.05,P≤0.01,P≤0.001)
2.3 流式细胞分析仪检测 T 淋巴细胞表面的 TIM3 的改变
以 CD3+FITC 流式抗体标识 T 淋巴细胞,对人外周血淋巴细胞进行流式细胞分析仪检测。采用Flowjo7.6 软件对 T 淋巴细胞表面 TIM3 蛋白的改变进行分析。如图 2B 和 2D 所示,随着抗CD3/CD28 抗体浓度由 0.001 μg/ml 增加至0.1 μg/ml,APC-Cy7 荧光强度由未刺激的 167 ± 12 增加至 308 ± 25,提示 TIM3 蛋白表达的上调。随着 PHA 浓度由 0.2 μg/ml 增加至 5 μg/ml,APC-Cy7 荧光强度(207 ± 12、515 ± 63、889.5 ± 59.5)依次增强,TIM3 蛋白显现出较好的剂量依赖性增强。随着 SEB 浓度由 10 ng/ml 增加至250 ng/ml,APC-Cy7 荧光强度(601 ± 40、734.5 ± 66.5、1092.5 ± 96.5)逐渐增强,TIM3 表达显著上调。随着 ConA 浓度由 0.125 μg/ml 增加至2 μg/ml,APC-Cy7 荧光强度呈现增强,分别为 214.5 ± 21.5、439 ± 40、721 ± 72,表明 TIM3 蛋白随刺激浓度增加表达上调。其中 SEB 250 ng/ml 时荧光强度增强最为显著,对 TIM3 诱导上调作用最强。
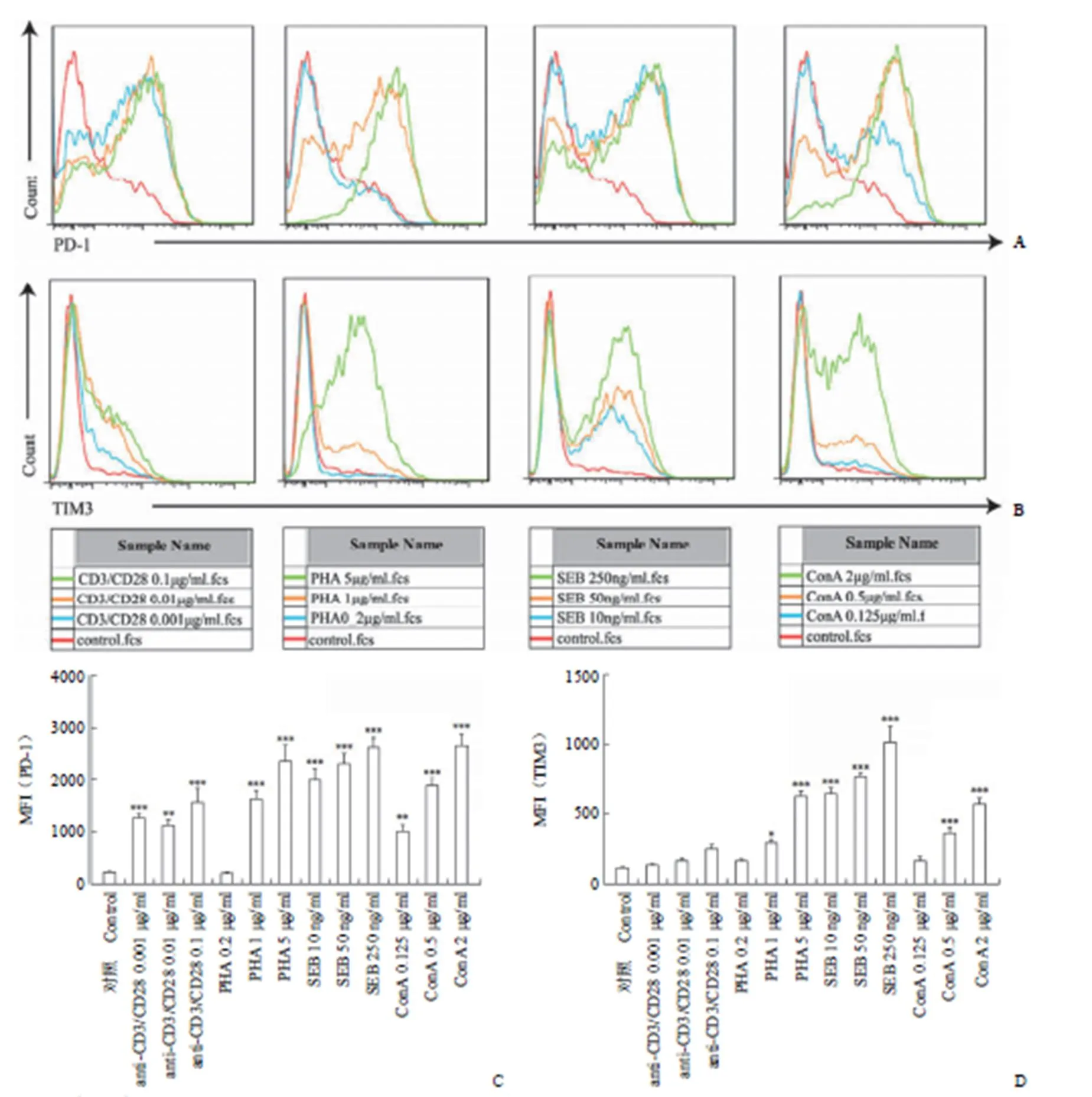
图 3 CD3+CD4+T 细胞表面PD-1 与TIM3 的蛋白表达(A:4 种刺激剂下PD-1 荧光变化流式图;B:4 种刺激剂下TIM3 荧光变化流式图;C:PD-1 平均荧光强度统计图;D:TIM3 平均荧光强度统计图;与对照组相比,*P≤ 0.05,**P≤ 0.01,***P ≤ 0.001)
Figure 3 Expression of PD-1 and TIM3 on T cell subpopulation CD3+CD4+membrane (A: PD-1 expression was evaluated by flow cytometry under four stimulators; B: TIM3 expression was evaluated by flow cytometry under four stimulators; C: Statistical graph of mean fluorescence intensity of PD-1; D: Statistical graph of mean fluorescence intensity of TIM3; compared with control group,P≤ 0.05,**≤ 0.01,***≤ 0.001)
2.4 流式细胞分析仪检测 CD3+CD4+T 细胞表面 PD-1 与 TIM3 的改变
辅助 T 细胞(helper T cell,Th细胞)在免疫反应中扮演中间过程的角色,它可以增生扩散来激活其他类型的产生直接免疫反应的免疫细胞,通过调控或辅助其他淋巴细胞发挥功能,是已知的 HIV 的目标细胞,在艾滋病发病时会急剧减少。其主要表面标志是 CD4。因而在流式细胞分析仪检测时以 CD3+FITCCD4+PE 来标识人外周血淋巴细胞中的辅助 T 细胞。采用 Flowjo7.6 软件对 CD3+CD8+T 淋巴细胞表面 TIM3 蛋白的改变进行分析。如图 3所示,4 种刺激剂对 CD3+CD4+表面的 PD-1 与 TIM3 蛋白表达都有上调作用,其中,抗 CD3/CD28 抗体在 0.001 μg/ml 即可表现出显著的诱导 PD-1 上调作用,但对 TIM3 的改变并不明显。PHA 浓度在 0.2 μg/ml 时上调 PD-1、TIM3 的作用均不显著,但浓度升高为 5 μg/ml 时,PD1、TIM3 荧光强度均增强,表达增多。SEB 于较低剂量即可展现出对 PD-1 蛋白与 TIM3 蛋白表达的强诱导作用,且有剂量依赖性的升高。ConA 的诱导作用较 PHA 更好。
2.5 流式细胞分析仪检测 CD3+CD8+T 细胞表面 PD-1 与 TIM3 的改变
细胞毒 T 细胞(cytotoxic T cell,CTL),也被称为杀伤性 T 细胞。在免疫反应中扮演重要作用,尤其是在消灭受感染细胞的过程中,可对其产生特殊抗原反应的目标细胞进行杀灭。细胞毒 T 细胞的主要表面标志是 CD8+,因而在流式细胞分析仪检测时以 CD3+FITC 和 CD8+APC 来标识人外周血淋巴细胞中的细胞毒 T 细胞。采用 Flowjo7.6 软件对 CD3+CD8+T 淋巴细胞表面 PD-1 与 TIM3 蛋白的改变进行分析。如图 4 所示,4 种刺激剂对 CD3+CD8+表面的 PD-1 与 TIM3 蛋白表达都有上调作用。其中 PHA 在 1 μg/ml 与5 μg/ml、SEB 在 50 ng/ml 和 250 ng/ml、ConA 在 2 μg/ml 时可显著诱导 CD3+CD8+T 淋巴细胞表面 PD-1 的表达。4 种刺激剂对 CD3+CD8+T 淋巴细胞表面的 TIM3 蛋白的改变强于对 CD3+CD4+T 淋巴细胞的改变,其诱导作用随浓度增加而增强。
3 讨论
近年来,针对 PD-1 与 PD-L1 免疫检查点的阻断剂已被证明在多种癌症类型治疗过程中显著改善了肿瘤患者的临床进展和不良预后。现已有多种 PD-1/PD-L1 药物已被美国 FDA 批准上市,如 Keytruda、Opdivo、Tecentriq 等[9]。尽管针对 PD-1/PD-L1 的免疫检查点抗体具有令人惊叹的抗肿瘤活性,但对其治疗后产生的抗性也逐渐引起人们重视,有研究指出其适应性耐药的机制源于 T 细胞表面替代性免疫检查点的上调,尤其是 TIM3。许多数据已表明 TIM3 等免疫检查点的上调可能是与对 PD-1 阻断治疗后产生适应性抗性相关的靶向的生物标志物[10]。并有研究指出,TIM3 与 PD-1 阻断剂的联合应用可以在抗肿瘤治疗中取得更好的疗效[11]。然而,目前尚未有文献报道在淋巴细胞激活状态下免疫检查点蛋白 PD-1 与 TIM3 蛋白表达的变化。因此,探索两者的关系对于进一步认识T 细胞的激活机制和肿瘤免疫治疗联合用药尤为重要。
本实验采用人外周血提取获得淋巴细胞,在现有常规 T 细胞增殖试验常用的 4 种刺激剂在刺激 T 细胞增殖后其细胞 PD-1 与 TIM3 蛋白的变化情况进行了观察,并采用流式细胞仪对增殖后的 T 淋巴细胞进行分群分析,较为细致地研究了 CD3+CD4+T 细胞与 CD3+CD8+T 细胞表面 PD-1 与 TIM3 蛋白水平的改变。
实验中发现,无论何种刺激剂都可以引起淋巴细胞 PD-1 总蛋白的上调和TIM3 总蛋白的下调。其中 SEB 表现出显著抑制 TIM3 总蛋白表达的能力,PHA 在上调 PD-1 蛋白与抑制 TIM3 蛋白中展现出其较好的剂量依赖性,在 5 μg/ml 时其作用效果最强。抗 CD3/CD28 抗体通过体外模拟特异性 T 淋巴细胞活化的第一信号和第二信号,可激活淋巴细胞,但其对淋巴细胞 PD-1 的诱导作用并不强。ConA 为促细胞有丝分裂素,主要对 T 淋巴细胞有激发作用,在实验中常用于鼠类 T 细胞的激活,在本实验中也展现出较好的刺激活性与剂量依赖性。已有报道指出,PD-1 作为负性协同刺激分子受体,可在活化的 T、B 和 NK 等细胞上呈诱导性表达[12],这与本实验中蛋白免疫印迹法得到的结果一致。
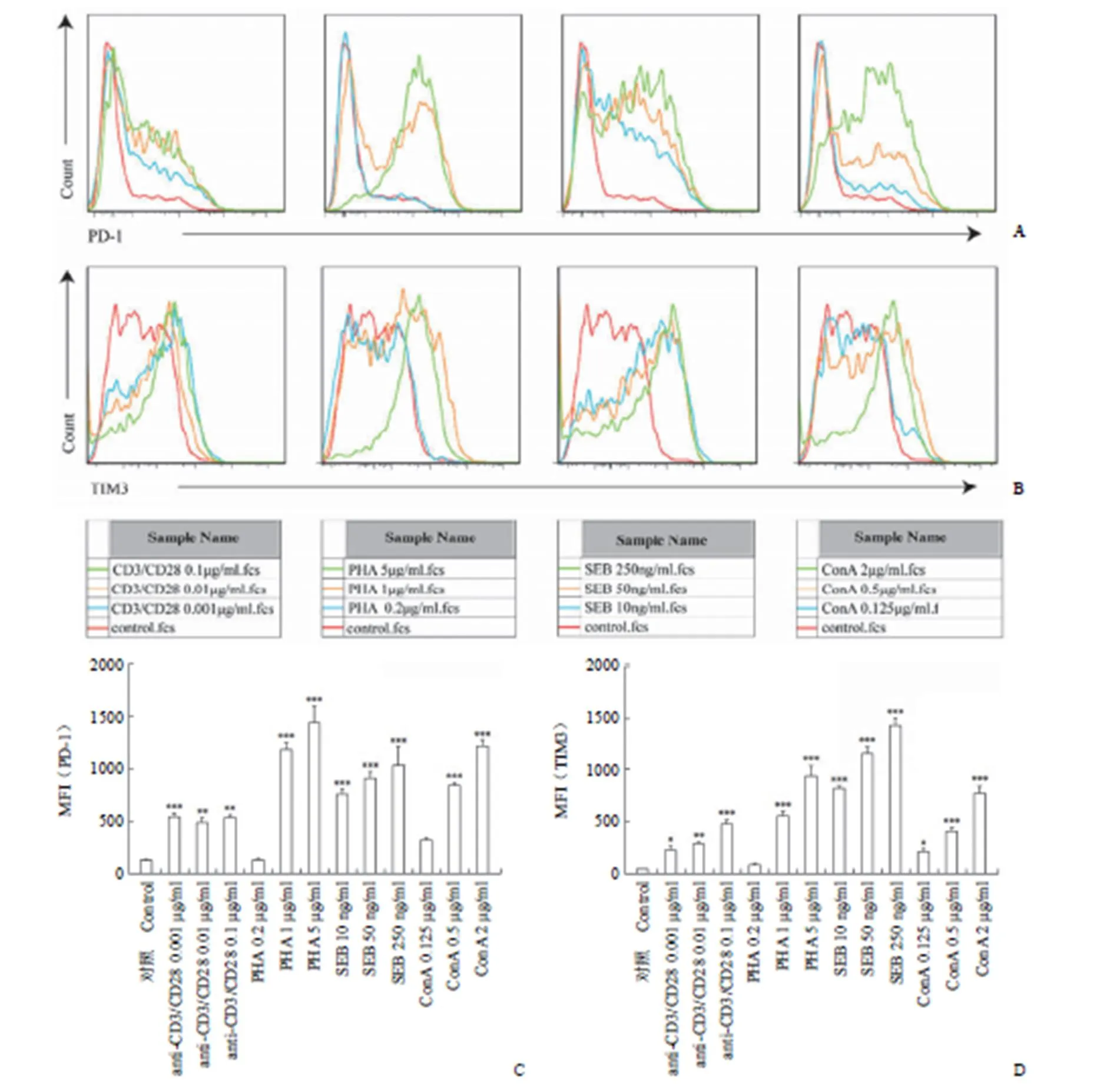
图 4 CD3+CD8+T 细胞表面PD-1 与TIM3 的蛋白表达(A:4 种刺激剂下PD-1 荧光变化流式图;B:4 种刺激剂下TIM3 荧光变化流式图;C:PD-1 平均荧光强度统计图;D:TIM3 平均荧光强度统计图;与对照组相比,*P≤ 0.05,**P≤ 0.01,***P ≤ 0.001)
Figure 4 Expression of PD-1 and TIM3 on T cell subpopulation CD3+CD8+membrane (A: PD-1 expression was evaluated by flow cytometry under four stimulators; B: TIM3 expression was evaluated by flow cytometry under four stimulators; C: Statistical graph of mean fluorescence intensity of PD-1; D: Statistical graph of mean fluorescence intensity of TIM3; compared with control group,P≤ 0.05,**≤ 0.01,***≤ 0.001)
在流式细胞技术的分析中可以观察到,在人外周血淋巴细胞中,PD-1 表面蛋白显著上调。为进一步细化该蛋白表达在不同类型 T 细胞中的变化趋势,我们选用 CD4 与 CD8 流式抗体进一步对所提取的 T 淋巴细胞进行分群,即辅助性 T 细胞群和杀伤性 T 细胞群。在对不同亚群的流式分析中我们可以看到,CD3+CD4+T 细胞与 CD3+CD8+T 细胞在 4 种刺激剂的诱导作用下,表面的 PD-1 蛋白荧光强度均有显著增强,其中 PHA 与ConA 的量效关系最为明显。值得注意的是,T 淋巴细胞表面的 TIM3 蛋白在 4 种刺激剂的作用下均显示荧光增强,即蛋白水平上调。再进一步对 T 淋巴细胞分群后的检测结果显示,TIM3 蛋白在CD3+CD4+与 CD3+CD8+T 细胞上也有上调。
目前,已有许多研究表明,肿瘤患者体内 CD8+T 细胞的 PD-1 显示出上调,与此同时,TIM3 蛋白也展示出同样的上调表达,PD-1 与 TIM3 共表达于肿瘤微环境中浸润的 CD8+细胞上,使杀伤性 T 细胞减少 IFN-γ、TNF 和 IL-12 的产生,介导 T 细胞功能的耗竭与免疫耐受[11, 13-14],本实验中流式细胞术的结果与文献报道一致,膜表面 PD-1 的上调伴随有 TIM3 的上调表达。这提示我们临床上使用 PD-1/PD-L1 阻断剂的同时应用 TIM3/Gal-9的阻断剂是有意义的。双重阻断 PD-1 与 TIM3 信号可有效帮助衰竭 T 细胞,促进抗肿瘤免疫应答。
在本实验中,TIM3 表面蛋白的上调与通过蛋白免疫印迹法检测的总 TIM3 的下调结果相反,推测 T 淋巴细胞在刺激剂的刺激作用下 TIM3 可能发生了细胞水平的定位改变。有文献指出,细胞的信号转导和转录调控,都依赖于蛋白质空间位置的变化和运动,成熟的蛋白质必须在特定的细胞部位才能发挥其生物学功能[15]。而本实验中,TIM3 总蛋白减少与细胞膜表面蛋白增加的改变,可能与 TIM3 的功能活性相关,但究竟细胞胞质内的 TIM3 在肿瘤免疫调节中发挥怎样的作用还需要进一步实验证实。
[1] Galluzzi L, Vacchelli E, Bravo-San Pedro JM, et al. Classification of current anticancer immunotherapies. Oncotarget, 2014, 5(24):12472- 12508.
[2] Marin-Acevedo JA, Soyano AE, Dholaria B, et al. Cancer immunotherapy beyond immune checkpoint inhibitors. J Hematol Oncol, 2018, 11(1):8.
[3] Keir ME, Liang SC, Guleria I, et al. Tissue expression of PD-L1 mediates peripheral T cell tolerance. J Exp Med, 2006, 203(4):883- 895.
[4] Okazaki T, Honjo T. The PD-1-PD-L pathway in immunological tolerance. Trends Immunol, 2006, 27(4):195-201.
[5] Monney L, Sabatos CA, Gaglia JL, et al. Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease. Nature, 2002, 415(6871):536-541.
[6] Hastings WD, Anderson DE, Kassam N, et al. TIM-3 is expressed on activated human CD4+ T cells and regulates Th1 and Th17 cytokines. Cent Eur J Immunol, 2009, 39(9):2492-2501.
[7] Zhu C, Anderson AC, Schubart A, et al. The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity. Nat Immunol, 2005, 6(12):1245-1252.
[8] Xue NN, Dong K, Lai FF, et al. CFSE-labeled proliferative assays for assessment of T cell function induced by different stimulants. J Harbin Univ Commerce (Nat Sci Ed), 2017, 33(2):129-134. (in Chinese)
薛妮娜, 董凯, 来芳芳, 等. CFSE法检测刺激剂对淋巴细胞增殖与活化. 哈尔滨商业大学学报(自然科学版), 2017, 33(2):129-134.
[9] Page DB, Postow MA, Callahan MK, et al. Immune modulation in cancer with antibodies. Annu Rev Med, 2014, 65(65):185-202.
[10] Koyama S, Akbay EA, Li YY, et al. Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints. Nat Commun, 2016, 7:10501.
[11] Sakuishi K, Apetoh L, Sullivan JM, et al. Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion and restore anti-tumor immunity. J Exp Med, 2010, 207(10):2187-2194.
[12] Akbay EA, Koyama S, Carretero J, et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors. Cancer Discov, 2013, 3(12):1355-1363.
[13] Zhou Q, Munger ME, Veenstra RG, et al. Coexpression of Tim-3 and PD-1 identifies a CD8+ T-cell exhaustion phenotype in mice with disseminated acute myelogenous leukemia. Blood, 2011, 117(17): 4501-4510.
[14] Jin HT, Anderson AC, Tan WG, et al. Cooperation of Tim-3 and PD-1 in CD8 T-cell exhaustion during chronic viral infection. Proc Natl Acad Sci U S A, 2010, 107(33):14733-14738.
[15] Zhang S, Huang B, Xia XF, et al. Bioinformatics research insubcellular localization of protein. Prog Biochem Biophys, 2007, 34(6):573-579. (in Chinese)
张松, 黄波, 夏学峰, 等. 蛋白质亚细胞定位的生物信息学研究. 生物化学与生物物理进展, 2007, 34(6):573-579.
Effects of different stimulators on PD-1 and TIM3 expression in lymphocytes
LI Ling, LAI Fang-fang, DU Ting-ting, ZHANG Sen, LIU Ying, CHEN Xiao-guang
State Key Laboratory of Bioactive Substances and Functions of Natural Medicines/Beijing Key Laboratory of Non-Clinical Drug Metabolism and PK/PD Study, Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
To study the effects of different stimulators on PD-1 and TIM3 expression in human peripheral blood lymphocytes.
Human peripheral blood lymphocytes were isolated by density centrifugation. Four different stimulators used are anti-CD3/CD28 antibody, PHA, SEB and ConA, respectively. Total PD-1 and TIM3 expression in human peripheral blood lymphocytes under four different conditions were evaluated by Western blot, while PD-1 and TIM3 expression on the membrane were detected by flow cytometry.
Western blot results indicated that total PD-1 expression was increased, while total TIM3 expression was decreased upon treatment with all the four stimulators in T lymphocytes. However, Flow cytometry results indicated that PD-1 and TIM3 expression on the T lymphocytes membrane were increased under these four conditions. We also noticed that PD-1 and TIM3 expression were up-regulated in T cell subpopulation CD3+CD4+, CD3+CD8+cells.
All the four common stimulators could induce PD-1 and TIM3 expression on the membrane, while total expression of the proteins shows different expression pattern. Compared with other stimulators, PHA induces better dose-dependent response in human peripheral blood lymphocytes.
Programmed cell death 1 receptor; T cell immunoglobulin and mucin 3; Lymphocyte proliferation; Flow cytometry
CHEN Xiao-guang, Email: chxg@imm.ac.cn
中国医学科学院医学与健康科技创新工程(2017-I2M-1-010)
陈晓光,Email:chxg@imm.ac.cn
10.3969/j.issn.1673-713X.2019.02.005
2018-12-13

