脱细胞真皮基质/生物矿化胶原一体化骨软骨支架的制备及其生物相容性的研究
郑蕊,杰永生,陈磊,靳少锋,綦惠,孙磊,舒雄
脱细胞真皮基质/生物矿化胶原一体化骨软骨支架的制备及其生物相容性的研究
郑蕊,杰永生,陈磊,靳少锋,綦惠,孙磊,舒雄
100035,北京积水潭医院/北京市创伤骨科研究所骨库
成功制备脱细胞真皮基质/生物矿化胶原一体化骨软骨支架,并进行理化性质、生物力学与生物相容性评估,为骨软骨缺损修复提供理论依据。
以物理和化学方法制备牛源脱细胞真皮基质,利用磷酸三钙和胶原,按照不同比例混合,利用自组装和冻干技术,制备以脱细胞真皮基质支架为软骨层,生物矿化胶原为骨层的骨软骨一体化双相支架。通过大体观察、扫描电镜观察、生物力学等检测,对骨软骨一体化支架进行理化性质和力学性能评价。原代培养小鼠软骨细胞和成骨细胞,并分别种植在脱细胞真皮基质和生物矿化胶原双相支架上,利用细胞毒、死/活细胞染色和增殖实验等观察细胞生长情况,测定骨软骨一体化支架的生物相容性。
大体观察表明支架各层间结合紧密,未出现明显不连续和相互分离。扫描电镜各层内的孔隙结构相互连通且均具有立体多维性,其中脱细胞真皮基质、生物矿化胶原和双相支架的孔径分别为(121.6 ± 8.65)、(98.40 ± 5.56)和(103.2 ± 3.94)μm。同时三组支架的压缩模量分别为(41.05 ± 11.69)、(108.0 ± 12.71)和(84.98 ± 8.51)kPa,弹性模量分别为(17.24 ± 3.93)、(28.98 ± 3.31)和(21.74 ±2.92)kPa。MTT 法表明骨软骨一体化支架无细胞毒性。荧光显微镜观察显示,纵切的支架薄片上细胞生长分布均匀,表明支架生物相容性较好,CCK8 实验表明支架可以维持良好的细胞活性。
脱细胞真皮基质/生物矿化胶原骨双相支架中上下层间的理化性能展示了骨软骨组织结构和力学方面的双重仿生,为动物体内实验奠定了基础,有望成为治疗骨软骨缺损修复的一种新手段。
脱细胞真皮基质; 生物矿化胶原; 双相支架; 骨软骨
关节软骨病变是一种常见临床疾病,主要是由创伤炎症、创伤及关节活动压力造成软骨的退化和病变,最终导致骨关节炎的发生[1-2]。由于关节软骨缺少血管、神经及未分化细胞,因而自身修复能力有限。目前临床上采用的技术主要有:微骨折术、自体/异体软骨移植、自体/异体软骨细胞移植等[3-6]。但目前这些治疗方法具有相应的缺点,如形成纤维软骨,承重区修复效果不明显且易于复发等。同时供区有限,大块软骨缺损难以应用,易造成疾病传播和免疫排斥反应等一系列问题,制约传统治疗方法对骨软骨缺损修复的进展。
近年来,组织工程为临床治疗软骨损伤提供了新的思路[7-8],其中组织工程支架是非常重要的组成部分,所以选择合适的骨软骨支架材料至关重要。考虑骨软骨层不同结构的理化性质、生物化学和生物力学特性,最佳的策略是设计骨软骨一体化双层支架,满足骨和软骨再生不同需求。此外,能保持不同组分相邻但物理分开,而且可以防止骨软骨脱层发生。目前已应用于骨软骨一体化支架的材料包括多种天然的、合成的高分子材料[9-11],如固体多孔支架或纤维支架、水凝胶等,以我们前期研究成果为基础[12],采用脱细胞技术去除小牛真皮的细胞抗原和细胞核物质,但保留其天然细胞外基质成分和生物活性物质,脱细胞真皮基质(acellular dermal matrix,ADM)可以提供细胞生长的天然微环境,具有良好的细胞及生物相容性,是软骨修复适合的支架材料。磷酸三钙的孔径孔隙率和机械强度与正常骨组织无显著差异,是骨修复的理想材料。
本实验拟选用小牛 ADM、生物矿化胶原和磷酸三钙原材料,以 ADM 作为支架上层,生物矿化胶原作支架下层,联合运用自组装技术和冷冻干燥等技术,制备高度仿生性的骨软骨结构一体化双相支架,并对其理化性能及生物相容性进行检测,为后续的动物实验打下基础,给组织工程修复骨软骨缺损构建一种具有一体化结构的复合支架材料。
1 材料和方法
1.1 材料
1.1.1 主要试剂 新鲜的牛跟腱、新鲜牛皮、胃蛋白酶、胰酶、高糖 DMEM、低糖 DMEM 和胎牛血清(FBS)均购自美国 Gibco 公司;MTT、氯化钠、磷酸三钙、无水乙酸、甲醛、I 型胶原酶和 DAPI 染料购自美国 Sigma 公司;CCK8 试剂盒购自东仁化学科技(上海)有限公司。
1.1.2 仪器 CO2细胞培养箱为美国 Shellab 公司产品;SEM-6380LV 型扫描电镜购自日本电子株式会社;往复式真空泵为上海益化真空设备有限公司产品;倒置相差显微镜购自日本 Olympus 公司;SHW200R 型匀浆机购自上海盛海威电气仪表有限公司;冷冻大容量离心机购自湘仪离心机仪器有限公司;荧光显微镜购自德国 Leica 公司;Instron 5565 材料试验机购自美国 Instron 公司。
1.2 方法
1.2.1 生物矿化胶原制备 牛跟腱 5 g,剪碎,置于 0.5 mol/L 乙酸溶液中,并加入 2.5 g胃蛋白酶,匀浆机匀浆。4000 r/min 离心 30 min,取上清,加入 20% NaCl 500 ml。4000 r/min 离心 15 min,弃上清。取沉淀,约 100 ml,加入蒸馏水 400 ml,0.5 mol/L 乙酸 15 ml,置于透析袋,透析 4 d,每日换水。透析结束后,加入 0.5 mol/L 乙酸 10 ml,4 ℃保存,胶原和β-磷酸三钙质量比 3:7 通过匀浆机高速混匀,制备生物矿化胶原悬液。
1.2.2 小牛 ADM 的制备 ①脱细胞处理:取新生小牛背部皮肤,脱毛、清洗,乙酸溶液浸泡溶胀 2 h,使皮肤表皮、真皮和皮下组织各层有相对明显的界线,电动取皮刀切取厚度为 1 ~ 2 mm 的真皮层。流水冲洗乙酸后,室温下用 0.5% SDS 溶液水平振荡脱细胞 2 h,更换新的 SDS 溶液,再继续作用 2 h,流水冲洗过夜。蒸馏水再次冲洗 20 次后,冷冻干燥机中冻干。②结构重塑:脱细胞真皮基质置于 0.5% 胰蛋白酶溶液,室温超声振荡2.5 h,冷冻干燥机中冻干。③交联:结构重塑后,用甲醛作为交联剂室温浸泡 2 h。PBS 冲洗 3 次,流水冲洗过夜,以去除残留的交联剂,再用蒸馏水清洗 20 次后冻干,冷冻干燥,60Co 照射后备用。
1.2.3 一体化支架的制备 生物矿化胶原悬液作为一体化支架下层,ADM 作为一体化支架上层。首先将冷冻干燥 ADM 放入聚丙烯圆筒形模具中(内径5 mm;高5 mm),将制备的生物矿化胶原悬液经脱气后,缓慢注入模具中。为使接触界面紧密,使悬液固化成型,即在–80 ℃冰箱内维持2 h,冷冻样品最终在冷冻干燥机内真空条件下冷冻干燥 48 h,脱模后成功取出支架。另制备 ADM 单相支架和生物矿化胶原单相支架同期对照,最后将制作好的支架用 20 kGy60Co γ 射线辐照灭菌后,4 ℃条件下密封保存备用。
1.2.4 支架的结构特征观察 ①取支架进行大体观察及 Micro-CT 观察:通过Micro-CT 断层扫描成像技术,分析骨软骨一体化双相支架每层孔隙率及孔径大小。②扫描电镜观察:将骨软骨一体化双相支架的每层于水平面和垂直面切开,并固定于铝质底座上,进行离子溅射喷金,在加速电压下进行扫描电镜观察。③骨软骨一体化支架溶胀率测定如下:冷冻干燥支架称重称为干重(Wd),然后在指定时间内浸入 37 ℃的 PBS 缓冲液(pH = 7.4),分别取出支架称重称为湿重(Ws)(n = 3),支架溶胀率计算如下:(Ws – Wd)/ Wd × 100%。
1.2.5 力学测试 将冻干后三种支架制备直径6 mm、高 6 mm 的圆柱体,支架样本处于完全湿润状态,支架在室温下浸泡于去离子水至测试时取出。将样本置于定制的上下两层刚性夹板之间,Instron 5565 材料试验机,最大应变达总应变的 20% 时停止。记录相关测试数据自动输出,根据应力-应变曲线的线性变化部分,并计算相应的压缩模量。弹性模量检测:将三种支架固定于 Instron 5565 材料试验机上下两层夹板间,以 0.01 mm/s 的恒定拉伸速率进行位移控制,以双层界面各自分离为极限拉伸强度,最终测定其弹性模量。
1.2.6 细胞毒性检测 支架浸提液制备:取支架根据表面积体积比,计算出所需的DMEM 培养液量。将计算好的 DMEM 培养液加入无菌装有支架的离心管内,在 37 ℃温箱孵育 24 h 后,取上清液过滤,即为支架浸提液。实验组及 MTT 检测方法:取 L929成纤维细胞培养使其贴壁与生长,24 h 后胰蛋白酶消化计数,每孔 100 μl,细胞浓度 4 × 107个/L 铺板,分 2 组培养,每组 3 孔。将原培养液倒掉,实验组和对照组分别加入骨软骨一体化支架浸提液和正常 DMEM 培养液进行细胞培养。培养 2、4 和 7 d 取 1 块板,弃去培养液,每孔加入 20 μl MTT 液于无菌培养箱内培养;4 h 后每孔加入 150 μl DMSO,振荡均匀后,于 492 nm 处测定吸光度()值。
1.2.7 小鼠关节软骨和成骨细胞 分别取新生小鼠膝关节和颅骨。然后,将样品切成片,采用0.2 % II 型胶原酶和I 型胶原酶分别消化软骨切片和颅骨切片。在完全消化后,分离细胞悬液过滤、离心。然后,将获得软骨和成骨细胞培养到 P3备用,用 PBS 对 ADM 和生物矿化胶原支架进行 3 次洗涤,分别接种软骨细胞和成骨细胞。接种 12 h 后,将支架/细胞复合材料移入另一个空 24 孔板。在不同的时间间隔(1、4 和 7 d)用 CCK8 法检测细胞数增殖情况。
1.2.8 死/活细胞染色 将 P3代的小鼠软骨细胞和成骨细胞分别种植到支架上,种植大约 8 ×106个细胞构建细胞-支架复合体,37 ℃和 5% CO2培养箱孵育 3 d 和 7 d后,将其用刀片切成均匀薄片取出,在避光条件下进行死/活细胞染色,无菌 PBS 溶液清洗 2 次,弃掉反应后的液体,再次用 PBS 液清洗细胞-支架复合物薄片 2 次。加入 DAPI 孵育 5 min,PBS 清洗 2 次,然后进行荧光显微镜观察。
1.3 统计学处理
2 结果
2.1 骨软骨一体化支架的结构特征
采用改良自组装技术和冷冻干燥技术成功制备出新型的 ADM/生物矿化胶原一体化支架,该支架的界面区域均显示出良好的连续性。界面处整合良好,未出现裂隙及分层现象(图 1A 和 1B)。ADM 和生物矿化胶原各自的孔隙结构是显著不同的(图 1C),ADM 内呈纵向平行疏松的孔道(图 1D),生物矿化胶原的结构相对致密(图 1E)。骨软骨一体化支架的横切面呈多孔网状,内部有良好的孔隙(图 1F)。
2.2 骨软骨一体化支架的理化特性
软骨组织工程不仅需要一个相互连接的多孔支架结构,也需要合理的孔径及分布。Micro-CT 测定 ADM、生物矿化胶原和一体化双相支架的结构孔径,ADM 孔径和生物矿化胶原孔径分别为(121.6 ± 8.65)μm 和(98.40 ± 5.56)μm,一体化双相支架平均孔径为(103.2 ± 3.94)μm,有利于细胞培养(图 2A)。采用溶胀平衡测定法,三种支架冻干样品吸收 PBS 缓冲液 30 min 内逐渐达到溶胀平衡。在相同时间内,ADM 溶胀率高于生物矿化胶原的溶胀率,结构一体化支架的综合溶胀率在两者之间,骨软骨一体化支架溶胀率的变化与对应的支架多孔性一致。结果表明,较大的孔径和较高的多孔性使得它有更多的储水空间,导致吸水率增加(图 2B)。
Figure 1 Morphological characterization of osteochondral integrated scaffold (A: The lateral gross morphology observation; B: The vertical gross morphology observation; C: The vertical section; D: The upper structure of scaffold; E: The lower structure of scaffold; F: The lateral section)
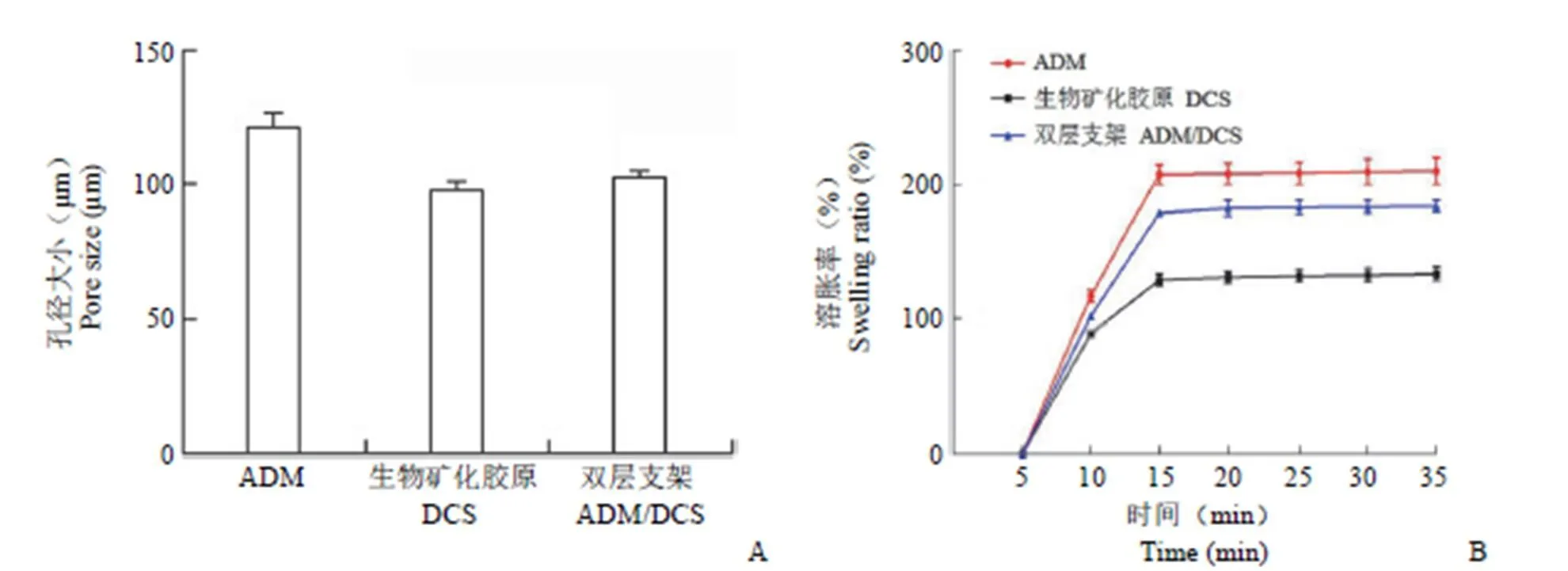
图 2 骨软骨一体化支架的物理化学特性(A:孔径;B:溶胀率)
Figure 2 The physicochemical properties of osteochondral integrated scaffold (A: The pore sizes; B: Swelling abilities)
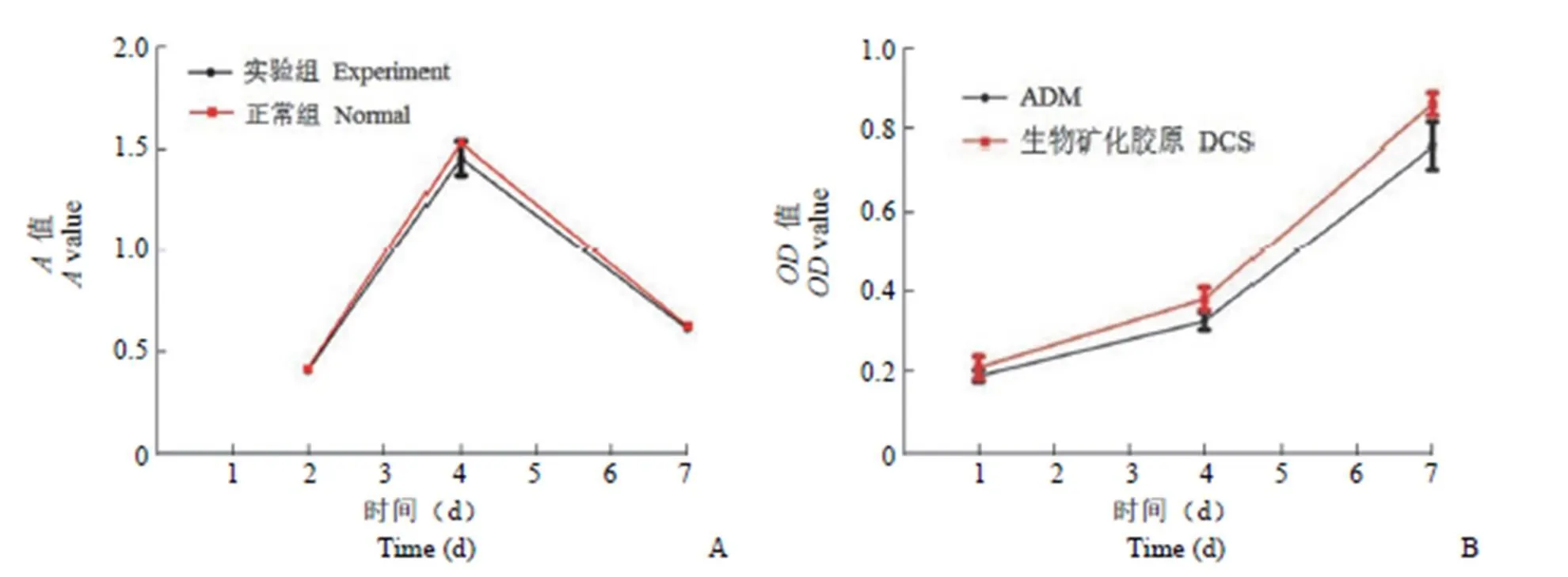
Figure 3 Viability, proliferation and attachment of cells on osteochondral integrated scaffold (A: Cell cytotoxicity detected by MTT assay; B: Cell proliferation on the ADM and biomineralized collagen measured; C: ADM determined by DAPI staining for 3 days;D: ADM determined by DAPI staining for 7 days; E: The biomineralized collagen determined by DAPI staining for 3 days; F: The biomineralized collagen determined by DAPI staining for 7 days)
2.3 骨软骨一体化支架的生物力学性能测定
支架的力学性能是软骨缺损修复的主要因素,其中植入缺陷区域的动态加载起关键作用。力学测试结果表明 ADM、生物矿化胶原和双层支架的压缩模量分别为(41.05 ± 11.69)、(108.0 ±12.71)和(84.98 ± 8.51)kPa。骨软骨一体化双相支架层间结合紧密,其中 ADM 的弹性模量为(17.24 ± 3.93)kPa,生物矿化胶原的弹性模量则为(28.98 ± 3.31)kPa,双层支架的弹性模量为(21.74 ± 2.92)kPa。
2.4 骨软骨一体化支架的体外生物相容性检测
MTT 检测显示,骨软骨一体化支架和正常组均能促进 L929 细胞生长,各时间点实验组与正常组比较值差异无统计学意义(> 0.05)(图 3A),表明支架材料无细胞毒性。其次,软骨细胞和成骨细胞分别种植 ADM 和生物矿化胶原支架上,CCK8 测定支架在不同时间间隔的细胞增殖情况。随着培养时间的增加,7 d 后软骨细胞和成骨细胞在上下层支架上与 1 d 相比,软骨和成骨细胞增殖 3 倍左右且无明显差异(图 3B),这表明骨软骨一体化支架有利于细胞存活。此外,分别在ADM 和生物矿化胶原上培养软骨细胞和成骨细胞,连续培养 3,7 d 后,ADM 和生物矿化胶原中细胞核用 DAPI 染色,荧光显微镜结果表明通过 3 d 和 7 d 培养,ADM 表面发现逐渐增多的紫色荧光的活细胞(图 3C 和 3D),同时在生物矿化胶原表面也发现增多的紫色荧光的活细胞(图 3E 和 F)。实验结果提示骨软骨一体化支架有良好的生物相容性。
3 讨论
由于创伤、运动等原因造成的软骨损伤最终导致骨性关节炎是骨科临床的难点,骨软骨组织工程给人们带来了新的希望。因为骨软骨在解剖结构上紧密相连,单一的软骨修复难以与骨界面整合,而骨软骨复合支架将形成软骨-骨连接面,这样不仅加快了愈合速度,而且可以仿生其生物力学性能。因此,能够固定和保持良好稳定性的一体化组织工程支架成为软骨组织工程研究焦点[13-14]。根据骨软骨结构特点,课题组构建脱细胞真皮基质/生物矿化胶原一体化支架,真皮来源的细胞外基质来源于动物皮肤组织,去除了皮肤表皮和真皮层中的细胞成分,而保留了真皮的胶原和基底膜成分。这种材料在组织工程中有其独特优势,不仅能起到支撑作用,同时可以调节细胞增殖、移行及分化。除此之外,真皮来源的细胞外基质可以通过生长因子和细胞因子等来调节信号转导,具有良好的生物相容性[15],有利于细胞的黏附与生长。β-磷酸三钙与人体骨骼无机成分相似,生物相容性好,易生物降解吸收,具有很好的力学性能和成骨诱导性,是骨软骨一体化多相支架骨层重要组成部分[16]。另外,胶原蛋白具有良好组织相容性及具有较高的生物黏性,可以很好地将β-磷酸三钙粉末连接固定在一起,通过逐层冷冻制备支架,可形成互相交错、渗透、紧密结合的结构,有效防止骨软骨双相支架层与层之间出现脱离,实现交界面紧密无缝连接的一体化设计。本实验通过物理和化学的方法制备脱去真皮的细胞,充分保留了细胞外基质中胶原与多糖等成分,其良好的生物学特性非常有利于种子细胞与周围正常组织细胞的黏附与生长。通过扫描电镜观察支架微观结构可见,软骨层内孔隙间连通性良好,同时骨层有较高的孔隙率与相对较大的孔径,故其有利于组织内细胞间氧气与营养物质的交换,促进细胞的生长与增殖,表现出较好的力学性能。目前已证明 β-磷酸三钙可增强一体化支架力学性能,也可提高来自 MSCs 成骨分化的能力。但是单纯的β-磷酸三钙不具备很好的可塑性,通过β-磷酸三钙与胶原的不同质量比混合,发现其质量比为 7:3 时,冷冻干燥骨层支架的力学性能与吸水能力表现均衡。因此,本研究中一体化双相支架制备过程中,ADM 层、β-磷酸三钙与胶原逐层冷冻,结果显示一体化支架各层间无明显分层现象。此外,MTT 检测、荧光染色和 CCK8 实验结果表明骨软骨一体化双相支架有良好的细胞相容性。
本研究制备新型骨软骨一体化双相支架,并通过体外实验证明其良好的生物相容性和力学特性,进一步探究其修复关节骨软骨缺损的可行性。但本实验作为体外实验的前期研究,难以模拟动物体内关节软骨复杂的动态微环境[17],对将该多相支架植入动物体内的修复再生表现尚不明确。因此,下一步研究应将骨软骨一体化双相支架植入动物体内,观察其对骨软骨缺损的修复再生效果,为临床转化与应用做进一步努力。
[1] Ishijima M, Kaneko H, Okada Y, et al. Cartilage/chondrocyte research and osteoarthritis. Current concept and future perspective for diagnosis and treatment of osteoarthritis of the knee. Clin Calcium, 2018, 28(6):749-759.
[2] Huey DJ, Hu JC, Athanasiou KA. Unlike bone, cartilage regeneration remains elusive. Science, 2012, 338(6109):917-927.
[3] Erggelet C, Vavken P. Microfracture for the treatment of cartilage defects in the knee joint-A golden standard? J Clin Orthop Trauma, 2016, 7(3):145-152.
[4] Emre TY, Atbasi Z, Demircioglu DT, et al. Autologous osteochondral transplantation (mosaicplasty) in articular cartilage defects of the patellofemoral joint: retrospective analysis of 33 cases. Musculoskelet Surg, 2017, 101(2):133-138.
[5] Schroeder JH, Hufeland M, Sch Tz M, et al. Injectable autologous chondrocyte transplantation for full thickness acetabular cartilage defects: early clinical results. Arch Orthop Trauma Surg, 2016, 136(10):1445-1451.
[6] de Windt TS, Vonk LA, Slaper-Cortenbach ICM, et al. Allogeneic MSCs and recycled autologous chondrons mixed in a one-stage cartilage cell transplantion: a first-in-man trial in 35 patients. Stem Cells, 2017, 35(8):1984-1993.
[7] Hung KC, Tseng CS, Dai LG, et al. Water-based polyurethane 3D printed scaffolds with controlled release function for customized cartilage tissue engineering. Biomaterials, 2016, 83:156-168.
[8] Gugjoo MB, Amarpal, Sharma GT, et al. Cartilage tissue engineering: Role of mesenchymal stem cells along with growth factors & scaffolds. Indian J Med Res, 2016, 144(3):339-347.
[9] Levingstone TJ, Matsiko A, Dickson GR, et al. A biomimetic multi-layered collagen-based scaffold for osteochondral repair. Acta Biomater, 2014, 10(5):1996-2004.
[10] Nonoyama T, Wada S, Kiyama R, et al. Double-network hydrogels strongly bondable to bones by spontaneous osteogenesis penetration. Adv Mater, 2016, 28(31):6740-6745.
[11] Choi B, Kim S, Lin B, et al. Cartilaginous extracellular matrix-modified chitosan hydrogels for cartilage tissue engineering. ACS Appl Mater Interfaces, 2014, 6(22):20110-20121.
[12] Shu X, Zheng R, Jie YS, et al. Effect of adipose-derived stem cells combine with acellular dermal matrix in repair of rabbit articular cartilage defects. Chin Med Biotechnol, 2017, 12(2):143-148. (in Chinese)
舒雄, 郑蕊, 杰永生, 等. 脂肪干细胞复合真皮脱细胞基质修复兔关节软骨缺损的实验研究. 中国医药生物技术, 2017, 12(2):143-148.
[13] Qu D, Li J, Li Y, et al. Ectopic osteochondral formation of biomimetic porous PVA-n-HA/PA6 bilayered scaffold and BMSCs construct in rabbit. J Biomed Mater Res B Appl Biomater, 2011, 96(1):9-15.
[14] Panseri S, Russo A, Cunha C, et al. Osteochondral tissue engineering approaches for articular cartilage and subchondral bone regeneration. Knee Surg Sports Traumatol Arthrosc, 2012, 20(6):1182-1191.
[15] Ma A, Jiang L, Song L, et al. Reconstruction of cartilage with clonal mesenchymal stem cell-acellular dermal matrix in cartilage defect model in nonhuman primates. Int Immunopharmacol, 2013, 16(3):399-408.
[16] Zha G, Li X, Niu X, et al. Application of collagen-β-tricalcium phosphate complex for repairing articular cartilage defects. J Biomaterials Tissue Eng, 2017, 7(3):241-247.
[17] Wu JY, Chen H, Yang L. Current status of intra-articular injection of drugs and biological agents in the treatment of osteoarthritis. J Clin Orthop Res, 2019, 4(2):113-119. (in Chinese)
吴江怡, 陈昊, 杨柳. 骨关节炎的关节腔内注射药物及生物制剂治疗现状. 骨科临床与研究杂志, 2019, 4(2):113-119.
Study on preparation and biocompatibility of the acellular dermal matrix/biomineralized collagen diphasic osteochondral integrated scaffold
ZHENG Rui,JIE Yong-sheng, CHEN Lei, JIN Shao-feng, QI Hui, SUN Lei, SHU Xiong
Beijing Jishuitan Hospital, Beijing Institute of Traumatology and Orthopaedics, Beijing 100035, China.
To manufacture an acellular dermal matrix/biomineralized collagen diphasic osteochondral scaffold and then evaluate the physical and chemical properties, biomechanics and biocompatibility of the scaffold to provide theoretical basis for the repair of osteochondral defects.
Bovine acellular dermal matrix was prepared by physical and chemical methods such as acellular, pepsin and cross-linking. Bone-cartilage integrated biphasic scaffolds with acellular dermal matrix (ADM) as cartilage layer and biomineralized collagen (DCS) as bone layer were prepared by mixing tricalcium phosphate and collagen in different proportions and using self-assembly and freeze-drying technology. We constructed the acellular dermal matrix scaffold (ADM), biomineralized collagen scaffold (DCS), and ADM/DCS scaffold (ADM/DCS), respectively, and then the physical and chemical properties and mechanical properties of osteochondral integrated scaffolds were evaluated by gross observation, scanning electron microscopy and biomechanical testing. The primary cultured chondrocytes and osteoblasts cells of mice were implanted into acellular dermal matrix and biomineralized collagen, respectively. The scaffold was observed by cytotoxicity, dead/living cell staining and proliferation experiments.
Gross observation showed that the scaffolds were closely interlaminar, without obvious discontinuity and separation. The pore structures in each layer of the scanning electron microscope were interconnected and multidimensional. The pore sizes of ADM, DCS and biphasic scaffolds were (121.6 ± 8.65), (98.40 ± 5.56) and (103.2 ± 3.94) μm, respectively. At the same time, the compression modulus of the three groups of scaffolds were (41.05 ± 11.69), (108.0 ± 12.71) and (84.98 ± 8.51) kPa, and the elastic modulus were (17.24 ± 3.93), (28.98 ± 3.31) and (21.74 ± 2.92) kPa. The result from MTT assay showed that the osteochondral scaffold had no cytotoxicity. Cells grew evenly on the scaffold, indicating that the scaffolds had good biocompatibility. The data from CCK8 experiments showed that the scaffold possessed excellent biocompatibility.
The physical and chemical properties between the upper and lower layers of the ADM/DCS biphasic scaffolds demonstrate the dual biomimetic structure and mechanics of osteochondral tissue, which lays a foundation for further researchexperiments. Meanwhile, it becomes a new method for osteochondral defect repair.
Acellular dermal matrix; Biomineralized collagen; Diphasic scaffold; Osteochondral
SHU Xiong, Email: shuxiong654321@aliyun.com; SUN Lei, Email:dr_sunlei@263.net
北京市属医学科研院所科技发展项目(PXM2017_026275_ 000004)
舒雄,Email:shuxiong654321@aliyun.com;孙磊,Email:dr_sunlei@263.net
2019-01-17
10.3969/j.issn.1673-713X.2019.02.004

