miR-216a-5p通过JAK2靶向抑制肝癌细胞的增殖和侵袭
周维,谭晓宇,李慧芬,王爽
miR-216a-5p通过JAK2靶向抑制肝癌细胞的增殖和侵袭
周维,谭晓宇,李慧芬,王爽
200137 上海市第七人民医院肿瘤科(周维、王爽);510010 广州军区广州总医院肝胆外科(谭晓宇、李慧芬)
明确 miR-216a-5p 在调控肝细胞癌(HCC)中的生物学作用及其可能机制。
通过实时荧光定量聚合酶链反应(qRT-PCR)方法检测 92 例 HCC 患者的肿瘤组织及对应癌旁组织中 miR-216a-5p 的表达情况。并采用 CCK8 和 Transwell 试验检测 miR-216a-5p 对 HCC 细胞增殖和侵袭能力的影响。采用荧光素酶、蛋白质印迹和 qRT-PCR 检测肝细胞癌中 miR-216a-5p 的表达与 JAK2 表达的相关性。
发现 miR-216a-5p 在 HCC 中的表达显著降低,并与多种临床病理特征(肿瘤多样性、组织学分化、巴塞罗那分期)相关。低表达 miR-216a-5p 的 HCC 患者预后不良。双荧光素报告系统分析证实 JAK2 是miR-216a-5p 的直接下游靶基因。并且过表达 JAK2 抵消了 miR-216a-5p对 HCC 细胞增殖、迁移和侵袭的抑制能力。
miR-216a-5p 可能是一种新的潜在的肝癌治疗靶点。
癌,肝细胞; Janus 激酶2; 细胞增殖; 肿瘤侵润; miR-216a-5p
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内最常见的恶性肿瘤之一[1]。目前,虽然在 HCC 的治疗方面已经取得了很大的成就,但 HCC 患者的预后仍然不令人满意[2-3]。以往的研究报道表明肿瘤抑制因子的失活和信号路径的异常调控与 HCC 的发病机制密切相关,但是其背后的机制作用仍有待阐明。
microRNAs(miRNAs)是一类高度保守的小分子 RNAs,在基因表达的转录后调控中发挥着重要作用。miRNA 通过结合靶向 mRNA 序列的 3' 非编码区域(UTRs)来对其进行翻译抑制,从而参与多种病理过程[4]。研究表明,多种 miRNAs 作为癌基因或肿瘤抑制因子参与了细胞的癌变并发挥重要作用[5]。例如:miR-233 通过mTOR 信号路径抑制 HCC 的形成、促进 HCC 凋亡[6];miR-487a 通过结合 PIK3R1 和 SPRED2 促进 HCC 的增殖和转移[7]。然而,miR-216a-5p 在 HCC 中的生物学作用和分子机制还需进一步明确。在本研究中,我们发现 miR-216a-5p 异常低表达与 HCC 患者的临床病理特征和预后显著相关。miR-216a-5p 可通过直接结合 Janus 激酶 2(JAK2)调控 HCC 细胞的增殖、迁移和侵袭。
1 材料与方法
1.1 材料
1.1.1 细胞系 人肝癌细胞系 HepG2(货号:CBP60199)、Hep3B(货号:CBP60197)、MHCC-LM3(货号:CBP60654)、SMMC7721(货号:CBP60210)及人肝癌癌旁细胞系 QSG-7701(货号:CBP61056)和 HEK-293T(货号:CBP60439)细胞均购自中国上海科学院细胞库。
1.1.2 患者及肝癌组织样本 在广州军区广州总医院进行肝切除术的 HCC 患者中获得了共计 92 对匹配的新鲜 HCC 组织标本和相邻的癌旁组织样本。所有患者术前均未接受过放疗或化疗。所有患者均知情同意且本研究得到广州军区广州总医院伦理道德委员会的批准。
1.2 方法
1.2.1 细胞培养 所有的细胞用含有 10% 胎牛血清、1% 双抗的 DMEM 培养基培养。在37 ℃、CO2体积分数为 5% 的温箱中培养,每 2 ~ 3 天更换一次培养液。
1.2.2 RNA 的提取及实时定量 PCR(qRT-PCR) 具体实验操作过程依照参考文献[8],GAPDH 和 U6 分别作为 mRNA 和 miRNA 的内参,U6 为内参基因。引物如下:JAK2:5' GGG AGGTGGTCGCTGTAAAA 3'(上游),5' ACCAGC ACTGTAGCACACTC 3'(下游);GAPDH:5' TGTG GGCATCAATGGATTTGG 3'(上游);5' ACACCA TGTATTCCGGGTCAAT 3'(下游)。用 2-∆∆Ct方法计算目的基因的相对表达水平。
1.2.3 慢病毒和细胞转染 过表达 miR-216a-5p 的慢病毒及对照物,过表达 JAK2 慢病毒和对照物均购自上海吉玛制药技术有限公司。具体实验操作过程依照参考文献[8]。
1.2.4 细胞增殖实验 通过 CCK8 实验评估细胞增殖能力。以每孔 103个细胞的密度将细胞接种于 96 孔板中孵育 1、2、3、4、5 d。具体实验操作过程依照参考文献[8],该实验重复 3 次。
1.2.5 细胞迁移和侵袭试验 具体实验操作过程依照参考文献[8],每室选取 5 个随机观察视野进行分析。
1.2.6 蛋白印迹试验 具体实验操作过程依照参考文献[8],文中所用抗体 JAK2(ab32060)、STAT3 p-STAT3(ab32539)和 GAPDH(ab8245)。
1.2.7 荧光素酶试验 具体实验操作过程依照参考文献[8]和试剂说明书进行,文中报告基因购自上海吉马生物制药有限公司。
1.3 统计学处理
采用 SPSS 17.0 统计学软件分析,计量资料两组或两组以上采用 Student检测或 One-way ANOVA 分析;肝细胞癌组织中 miRNA 的表达与临床参数关系的比较采用2检验和 Fisher's exact test 分析;Kaplan-Meier 生存曲线采用 Log-rank 检验,分析 miRNA 与肝癌患者的临床预后。< 0.05 为差异有统计学意义。
2 结果
2.1 miR-216a-5p 在 HCC 组织和细胞系中下调表达
通过 qRT-PCR 对 92 对 HCC 和匹配的癌旁组织中 miR-216a-5p 的表达水平进行了检测。HCC 以 U6 为内参基因,miR-216a-5p 在 HCC 组织中的相对表达为 1.108 ± 0.061,匹配的癌旁组织中表达为 1.349 ± 0.081,对应的癌旁组织 miR-216a-5p 的表达显著降低(图 1A,= 0.018)。表 1 中显示了 92 例 HCC 患者中 miR-216a-5p 表达量与临床病理特征之间的关系,以 miR-216a-5p 在92 例肝癌组织中的相对表达量的中位数为界,将患者分为低表达组(n = 45)、高表达(n = 47)两组,低表达的 miR-216a-5p 的表达水平与肿瘤的数目(< 0.001),组织分化(= 0.002)及巴塞罗那分期(BCLC)(< 0.001)显著相关。根据病理组织分化程度将患者分为低分化和中/高分化两组,低分化组的 miR-216a-5p 相对表达为 0.970 ± 0.090,中/高分化组的 miR-216a-5p 相对表达为1.234 ± 0.080,结果提示低分化组的 miR-216a-5p 的相对表达低于中/高分化组的 miR-216a-5p 相对表达(图 1B,= 0.031)。同时发现,BCLC 0/A 分期患者肿瘤组织中 miR-216a-5p 相对表达为 1.219 ± 0.074,BCLC B 分期患者的 miR-216a-5p 相对表达为 0.950 ± 0.103,以上结果提示与 BCLC 0/A 分期患者相比,BCLC B 分期患者水平肿瘤组织 miR-216a-5p 表达相对较低(图 1C,= 0.030)。接下来,我们检测 miR-216a-5p 在 4 株 HCC 细胞系(HepG2、Hep3B、MHCC-LM3 和 SMMC7721)和 1 株人肝癌癌旁细胞系 QSG7701 中的 miR-216a-5p 表达水平,依次为 0.481 ± 0.032、0.356 ± 0.033、0.273 ± 0.034、0.161 ± 0.024 和 1.000 ± 0.023。该结果提示与组织样本的表达趋势一致,miR-216a-5p 在所有 4 株 HCC 细胞系中的表达水平均有所下降(图 1D,< 0.001)。
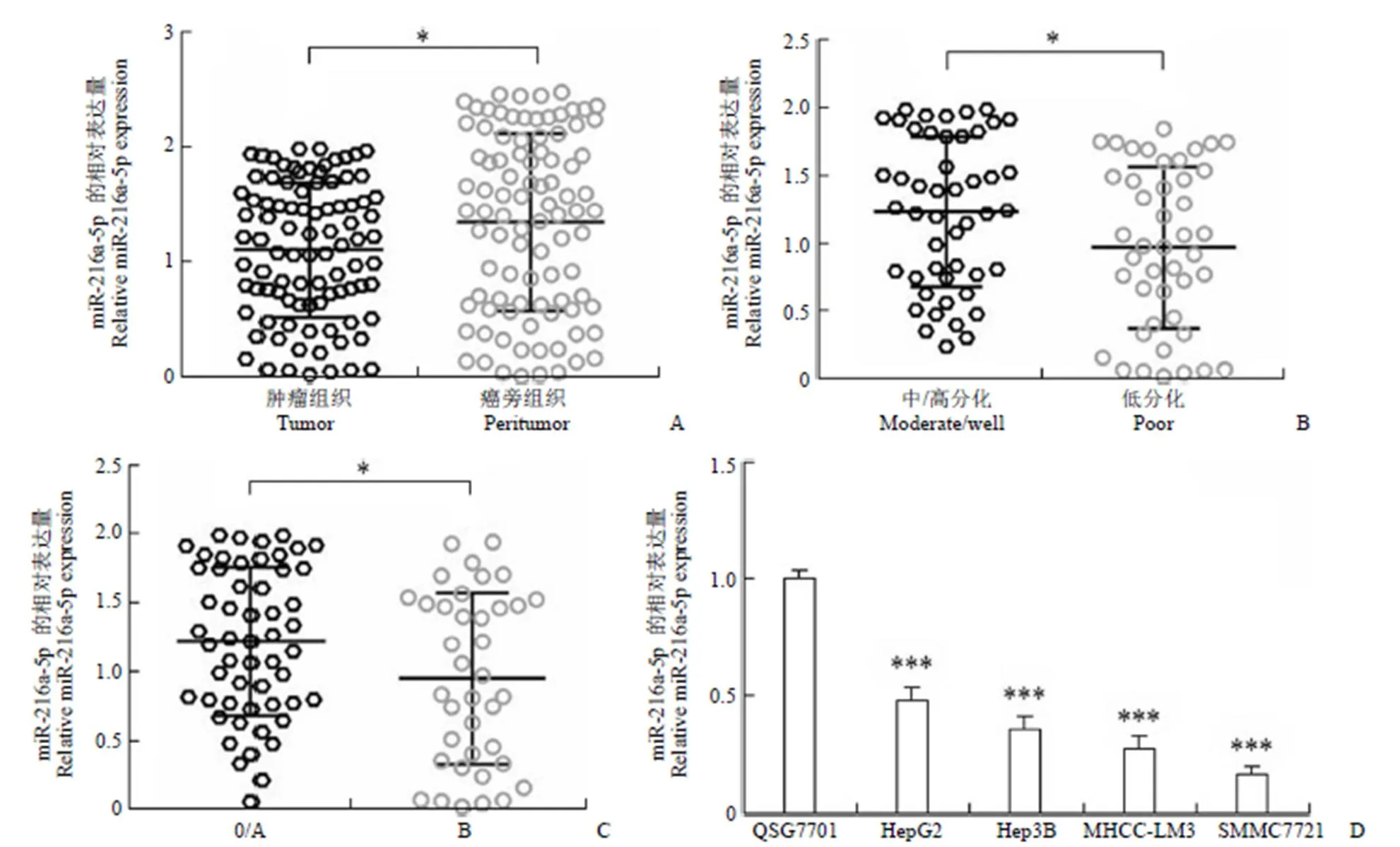
图 1 miR-216a-5p 在 HCC 组织和细胞系中下调表达(A:qRT-PCR 检测了 92 对 HCC 组织和癌旁组织中 miR-216a-5p 的表达;B:在组织学分化较差的患者中,miR-216a-5p 表达水平较低;C:BCLC B 分期组 miR-216a-5p 的表达低于 BCLC 0/A 分期组;D:qRT-PCR 检测 HCC 细胞系和肝癌癌旁细胞系中 miR-216a-5p 的表达;*P < 0.05,***P < 0.001)
Figure 1 The expression of miR-216a-5p was significantly decreased in hepatocellular carcinoma (HCC) tissues and HCC cell lines (A: The expression of miR-216a-5p in 92 pairs of HCC and peritumor tissues was examined by qRT-PCR; B: A lower expression level of miR-216a-5p was observed in patients with poor histological differentiation; C: The level of miR-216a-5p was lower in the BCLC B stage group than in the BCLC 0/A stage group; D: The level of miR-216a-5p in HCC cell lines and normal liver cell line was investigated;*< 0.05,***< 0.001)
2.2 miR-216a-5p 的低表达预示患者预后不良
进一步评估了 miR-216a-5p 异常表达对 HCC 患者预后的影响,发现低表达的miR-216a-5p 患者总体存活率低于高表达的 miR-216a-5p 患者(图 2A,< 0.001)。此外,miR-216a-5p 表达降低也有较高的复发概率(图 2B,< 0.001)。这些结果表明,miR-216a-5p 异常降低可能在肝癌的发生和发展中发挥着重要作用。
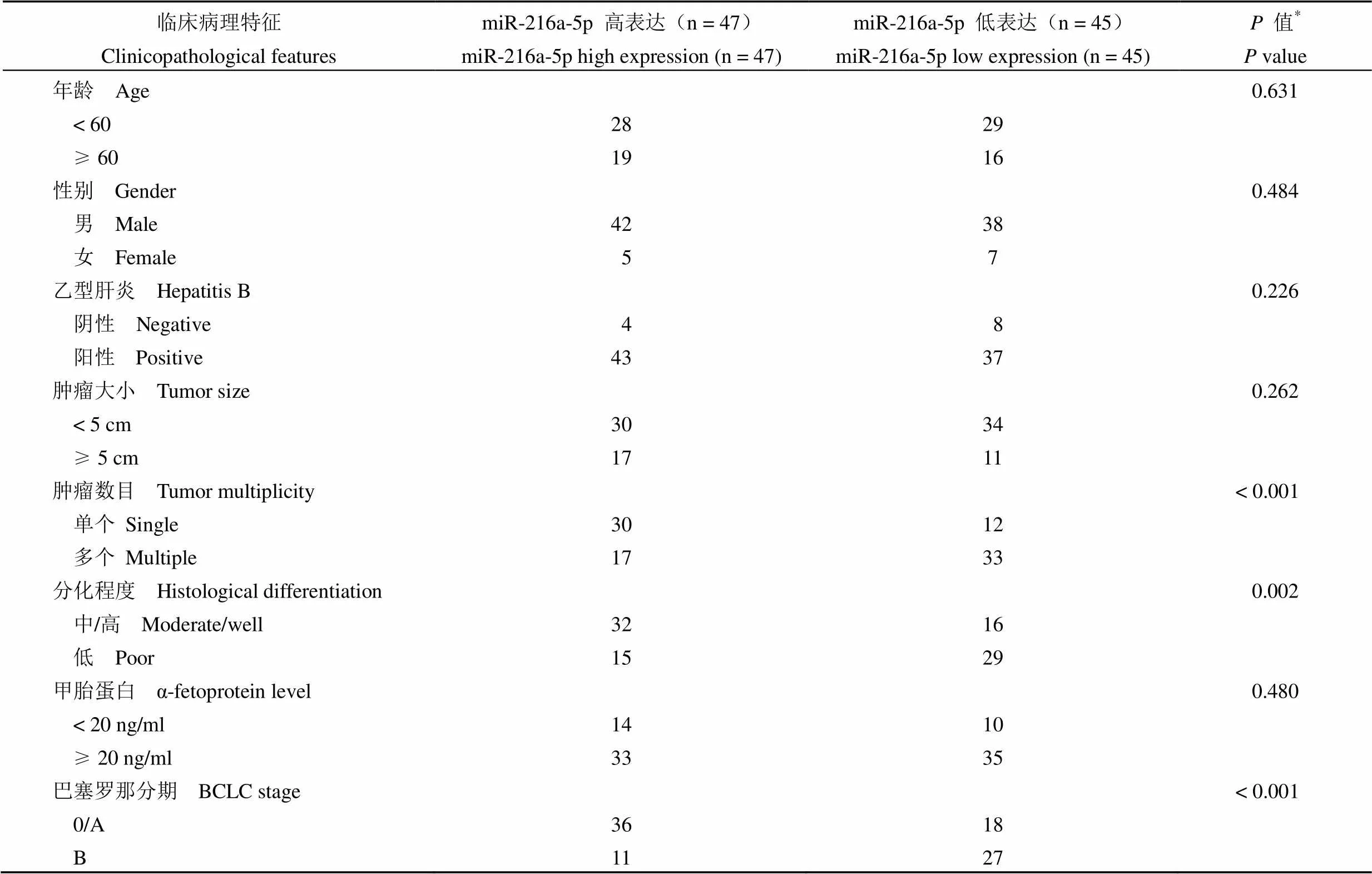
表 1 miR-216a-5p 表达水平与 HCC 临床病理特征的相关性
注:*< 0.05 认为有统计学意义。
Note:*< 0.05 was considered to be statistically significance.
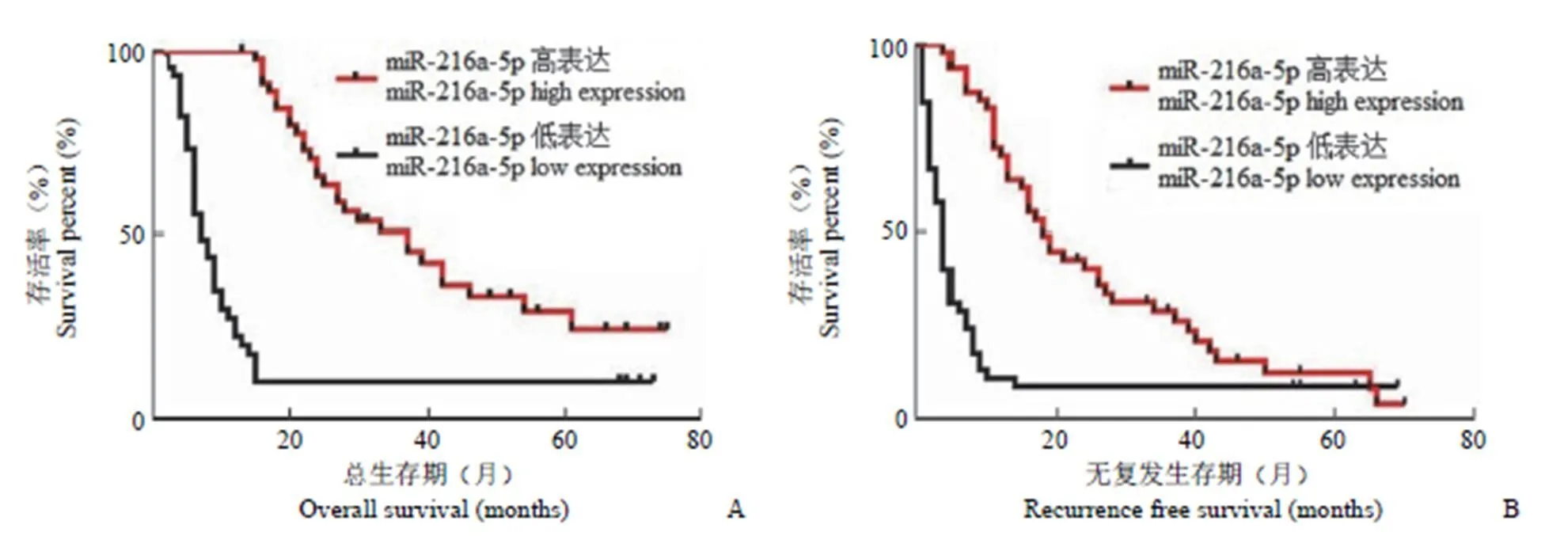
图 2 Kaplan-Meier 分析 miR-216a-5p 表达与 HCC 患者预后的关系(P < 0.001)
Figure 2 Kaplan-Meier analysis of the relationship between miR-216a-5p expression and HCC prognosis (< 0.001)
2.3 过表达 miR-216a-5p 抑制 HCC 细胞的增殖、迁移和侵袭
为了评估 miR-216a-5p 在 HCC 细胞中的生物学功能,将构建好的 miR-216a-5p 模拟物转染至 MHCC-LM3 和 SMMC7721 细胞中。如图 3A,qRT-PCR 结果证实 miR-216a-5p 的表达水平在 MHCC-LM3-miR-216a-5p 组是 MHCC-LM3 对照组的 5.936 倍(< 0.001);SMMC7721-miR- 216a-5p 组是 SMMC7721 对照组的 6.143 倍(< 0.001);miR-216a-5p 组中 miR-216a-5p 的表达水平高于对照组,且差异有统计学意义。结果证明 miR-216a-5p 模拟物转染成功。
CCK8 检测结果显示,MHCC-LM3-miR- 216a-5p 组细胞的增殖能力从第 2 天开始明显低于MHCC-LM3 对照组(图 3B,< 0.05);SMMC7721-miR-216a-5p 组细胞的增殖能力从第 3 天开始明显低于 SMMC7721 对照组(图 3C,< 0.05)。
接下来我们用 Transwell 实验研究了 miR- 216a-5p 对 HCC 细胞迁移和侵袭能力的影响。在迁移实验中,MHCC-LM3 对照组与 MHCC-LM3- miR-216a-5p 组穿过小室细胞数量比值为 2.881,SMMC7721 对照组与 SMMC7721-miR-216a-5p 组穿过小室细胞数量比值为 2.596。结果显示与MHCC-LM3 和 SMMC7721 的对照组相比,在 MHCC-LM3 和 SMMC7721 的 miR-216a-5p 组穿过小室细胞数量显著降低,差异有统计学意义(图 3D,< 0.001)。在侵袭实验中,MHCC-LM3 对照组与 MHCC-LM3-miR-216a-5p 组穿过小室细胞数量比值为 2.674,SMMC7721 对照组与 SMMC7721-miR-216a-5p 组穿过小室细胞数量比值为 2.208。结果显示与 MHCC-LM3 和 SMMC7721 的对照组相比,在 MHCC-LM3 和 SMMC7721 的 miR-216a-5p 组穿过小室细胞数量显著降低,差异有统计学意义(图 3D,< 0.001)。这些结果表明,miR-216a-5p 可以显著抑制 HCC 细胞的增殖、迁移和侵袭能力。
2.4 JAK2 是 miR-216a-5p 的直接靶基因
为了探讨 miR-216a-5p 对 HCC 细胞增殖、迁移和侵袭影响的潜在机制,我们采用了在线预测软件(http://www.targetscan.org/vert_72/)。预测结果提示 miR-216a-5p 可以与 JAK2 的 3'-UTR 结合(图 4A)。JAK2 参与了癌症的发展过程[9],之前有报道称它是多种 miRNAs 的直接靶点[10-12]。为了研究 JAK2 是否是 miR-216a-5p 的直接靶点,我们进行了荧光素酶报告试验。在 HEK293T 细胞中将 miR-216a-5p 模拟物和 JAK2 3'-UTR 荧光素酶质粒共转染,结果显示在对照组细胞中 JAK2 3'-UTR 荧光素酶相对活性为 1.000 ± 0.087,在 miR-216a-5p 组细胞中 JAK2 3'-UTR 荧光素酶相对活性 0.317 ± 0.018,证实过表达 miR-216a-5p 显著降低了 JAK2 3'-UTR 荧光素酶活性(图 4B,< 0.01);在对照组细胞中JAK2 3'-UTR-mut 荧光素酶相对活性为 1.000 ± 0.052,在 miR-216a-5p 组细胞中 JAK2 3'-UTR-mut 荧光素酶相对活性 1.127 ± 0.044,证实过表达 miR-216a-5p 对 JAK2 3'-UTR-mut 荧光素酶活性没有影响(图 4B,> 0.05)。qRT-PCR 结果证实 JAK2 的 mRNA 表达水平在 MHCC-LM3 对照组是MHCC-LM3-miR- 216a-5p 组的 3.816 倍(图 4C,< 0.01);SMMC7721 对照组是SMMC7721-miR-216a-5p 组的 3.315 倍(图 4C,< 0.01);miR-216a-5p 组中 JAK2 的 mRNA 表达水平低于对照组,且差异有统计学意义。考虑到JAK2 是 JAK2/STAT3 信号通路中重要的调控因子,我们接下来检测了这个信号通路是否参与了 miR-216a-5p 相关的 HCC 进展。Western blot 结果显示过表达 miR-216a-5p 的 MHCC-LM3 和 SMMC7721 细胞中 JAK2 和p-STAT3 蛋白水平呈降低趋势(图 4D)。以上结果表明 JAK2 是 miR-216a-5p 的直接靶基因。

图 3 过表达 miR-216a-5p 抑制 HCC 细胞的增殖、迁移和侵袭(A:细胞转染 miR-216a-5p 模拟物后 qRT-PCR 检测 miR-216a-5p 的表达水平;B:CCK8 试验检测 MHCC-LM3 细胞的增殖能力;C:CCK8 试验检测SMMC7721 细胞的增殖能力;D:Transwell 试验检测各组细胞的迁移和侵袭能力;*P < 0.05,***P < 0.001)
Figure 3 Overexpression of miR-216a-5p inhibited HCC cells proliferation, migration, and invasion (A: The transfection of lentivirus- overexpressing miR-216a-5p increased the expression of miR-216a-5p in HCC cells by qRT-PCR; B and C: CCK8 assays were performed to measure the HCC cell viability; D: The HCC cells migration and invasion, as detected by Transwell assays;*< 0.05,***< 0.001)
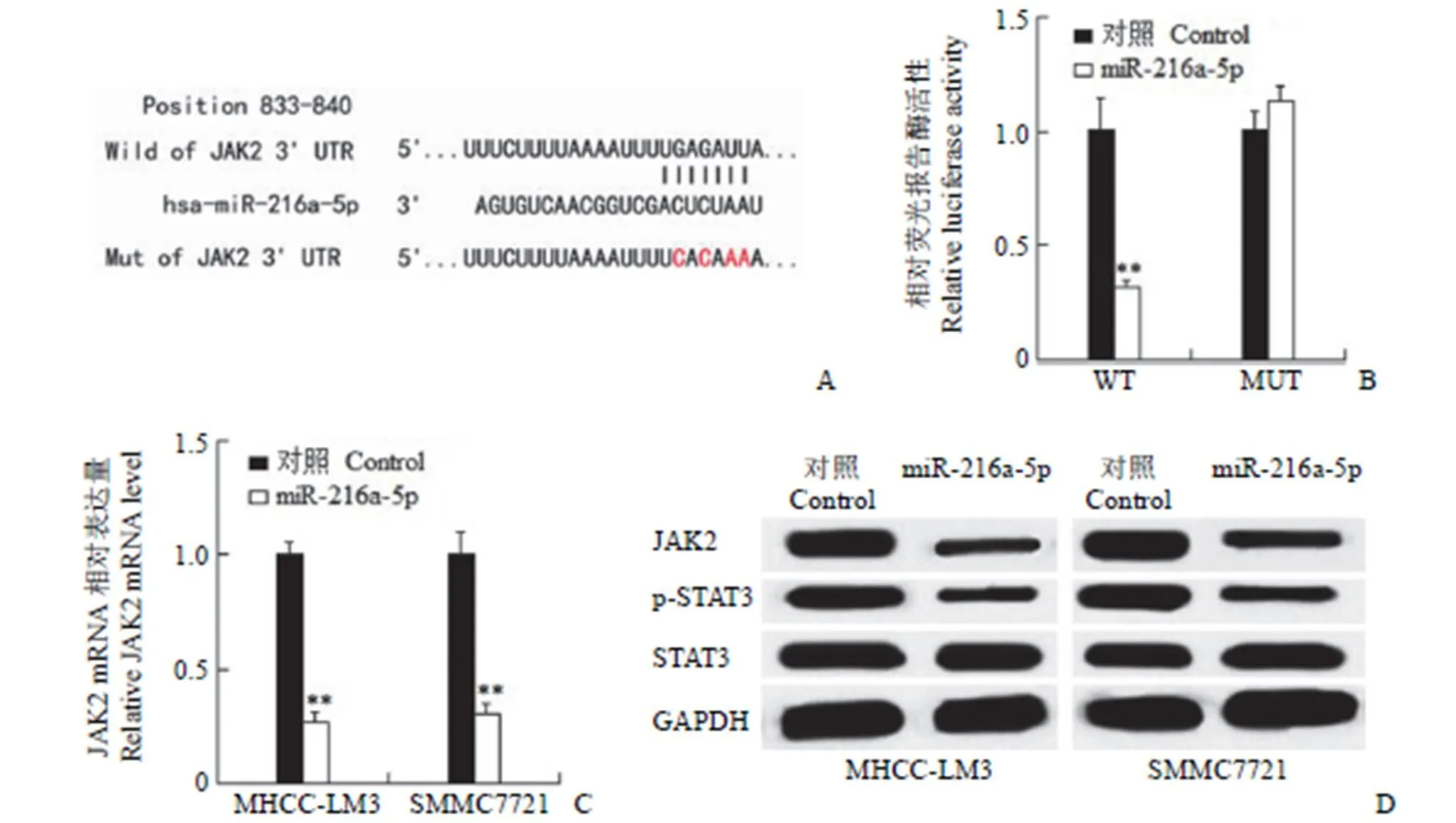
图 4 JAK2 为 miR-216a-5p 直接靶点(A:miR-216a-5p 与 JAK2 的 3'-UTR 中的结合序列;B:双荧光素酶报告实验检测 miR-216a-5p 与 JAK2 的 3'-UTR 结合情况;C:qRT-PCR 分析各组细胞中 JAK2 的 mRNA 表达;D:Western blot 检测各组细胞中 JAK2 和 p-STAT3 的蛋白表达;**P < 0.01)
Figure 4 JAK2 was a direct target gene of miR-216a-5p (A: The putative binding sequence of miR-216a-5p in the 3'-UTR of JAK2; B: The dual luciferase reporter assay showed that miR-216a-5p bound to the 3'-UTR of JAK2; C: qRT-PCR analysis of JAK2 mRNA expression in HCC cells; D: The protein level of JAK2 and p-STAT3 in HCC cells was analysis by Western blot;**< 0.01)
2.5 miR-216a-5p 通过调控 JAK2 表达抑制 HCC 增殖、迁移和侵袭
接下来,我们研究 miR-216a-5p 是否通过调控 JAK2 表达来抑制 HCC 增殖、迁移和侵袭。用过表达 JAK2 的慢病毒转染至上调 miR-216a-5p 的 SMMC7721 细胞中。通过 Western blot 检测 JAK2 的表达情况。JAK2 上调可导致过表达 miR-216a-5p 的 SMMC7721 细胞中 p-STAT3 水平升高(图 5A)。CCK8 实验和 Transwell 实验结果表明,JAK2 升高抵消了 miR-216a-5p 对 SMMC7721 细胞的增殖、迁移和侵袭抑制的能力(图 5B 和 C)。以上这些研究结果证实,JAK2 在 miR-216a-5p 抑制 HCC 增殖、迁移和侵袭中发挥着重要作用。
3 讨论
研究证据表明,多种 miRNAs 参与了 HCC 的发展过程[8, 13]。在本研究中,我们对 miR-216a-5p 异常表达与 HCC 的关系进行阐明。研究结果显示,HCC 组织中 miR-216a-5p 的表达明显低于癌旁组织。在 5 株 HCC 细胞系中,miR-216a-5p 表达下调。提示异常表达的 miR-216a-5p 可能在肝癌中发挥着抑癌基因的作用。接下来临床数据分析提示 miR-216a-5p 低表达与肿瘤数目、组织学分化和 BCLC 分期有显著的相关性。miR-216a-5p 表达水平的降低预示了肝癌患者的不良预后。以上结果提示 miR-216a-5p 可能与肝癌细胞的增殖、迁移和转移能力相关。为了证明这一点,我们将 miR-216a-5p 模拟物转染至 MHCC-LM3 和 SMMC7721 细胞系后检测其增殖、迁移和转移能力,结果证实过表达 miR-216a-5p 能明显抑制 MHCC-LM3 和 SMMC7721 细胞系的增殖、迁移和侵袭能力。本研究首先从临床分析中得到 miR-216a-5p 低表达与多种临床恶性指标相关,并且体外实验证实其具有抑制增殖、迁移和转移作用。提示 miR-216a-5p 在 HCC 中作为肿瘤抑制因子的重要作用。
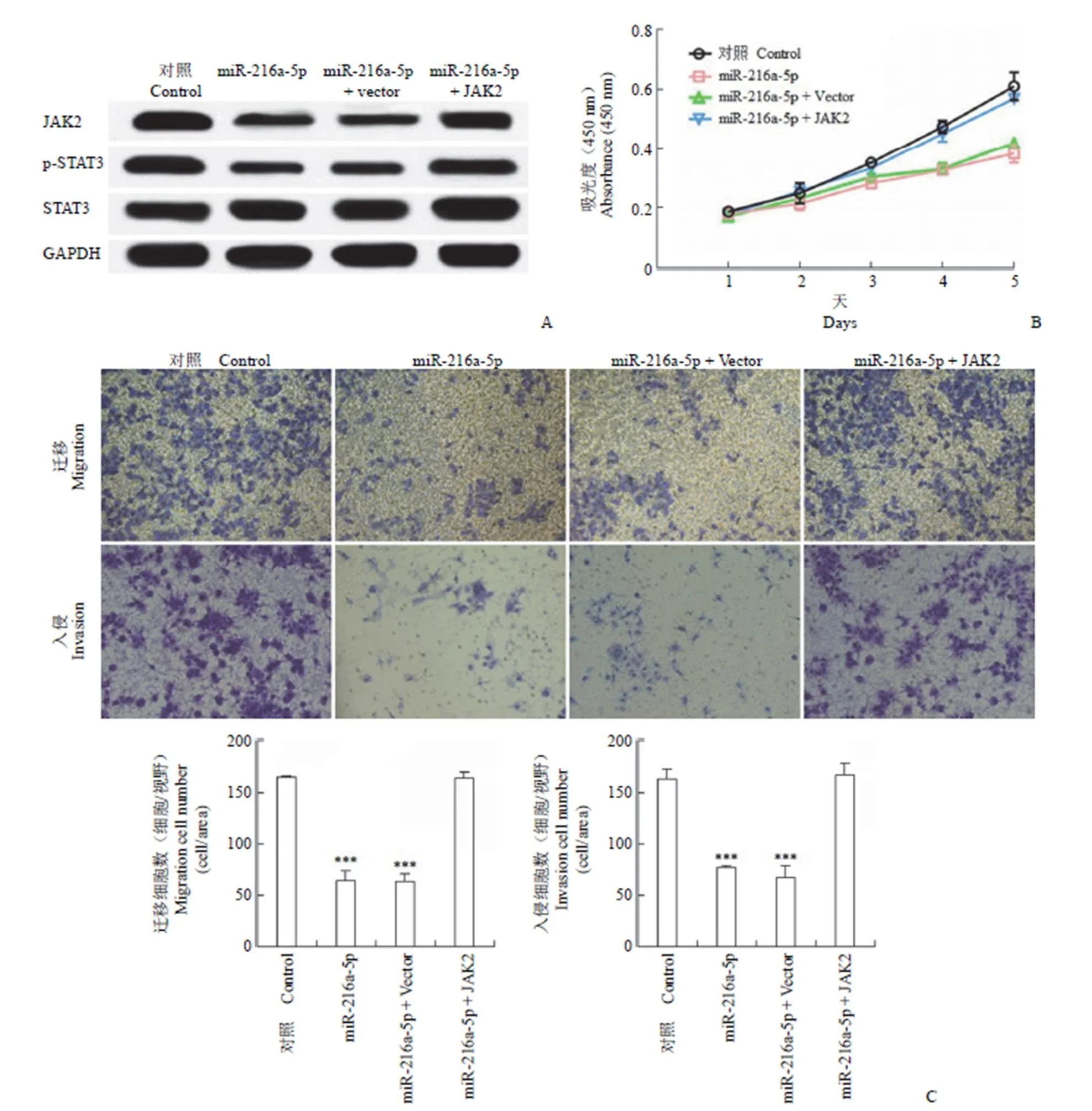
图 5 miR-216a-5p 通过调控 JAK2 表达抑制 HCC 增殖、迁移和侵袭(A:使用 Western blot 检测了在过表达 miR-216a-5p 的SMMC7721 细胞中 JAK2 和 p-STAT3 的表达水平;B:采用 CCK8 试验评估 JAK2 表达上调对过表达 miR-216a-5p 的 SMMC7721 细胞增殖的影响;C:采用 Transwell 方法检测了 JAK2 上调时对过表达 miR-216a-5p 的 SMMC7721 细胞迁移和侵袭的影响;所得数据以 的形式显示,***P < 0.001)
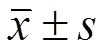
为了阐明 miR-216a-5p 在 HCC 进展中的分子机制,我们进行了生物信息学分析,发现miR-216a-5p 可以靶向 JAK2 中的 3'UTR。双荧光素酶检测证实 JAK2 是 miR-216a-5p 的直接下游靶点。此外,过表达 JAK2 可抵消 miR-216a-5p 抑制细胞增殖和侵袭的能力,也进一步提示 miR-216a-5p 通过 JAK2 抑制 HCC 的发展。JAK2 是 Janus 家族的非受体蛋白酪氨酸激酶成员,通过诱导细胞质信号路径调控多个细胞的演变进程[14]。JAK2 可作为一种致癌基因参与肿瘤细胞的增殖、侵袭和药物耐受。在骨髓增生性白血病中,JAK2 可在正常和病理条件下调节巨核细胞的增殖和分化[15]。STAT3 磷酸化与 p53 突变和患者存活率息息相关。p53 功能的丧失可激活 JAK2 信号,促进肿瘤生长,诱导胰腺癌对吉西他滨的耐药性[16]。在本研究中,JAK2 被证实是 HCC 中miR-216a-5p 的直接靶点。此外,我们还发现 miR-216a-5p 与 HCC 中 JAK2/STAT3 信号路径的失调有关。JAK2/STAT3 信号通路在肿瘤进展、迁移和血管生成中起着重要的作用。其中 JAK2/STAT3 通过细胞外生长因子和细胞因子将信号从细胞膜传递到细胞核。Wang 等[17]的研究表明,lnc-BM 和 JAK2 通过激活 lnc-BM/JAK2/STAT3 通路促进乳腺癌细胞转移。在结直肠癌中,结直肠癌来源的间充质干细胞通过 IL-6/JAK2/STAT3 信号通路增加癌细胞的迁移和侵袭能力[18]。我们的研究结果显示 JAK2/STAT3 信号通路在 HCC 进展中受到 miR-216a-5p 的调控。
综上所述,本研究证实在 HCC 中 miR-216a-5p 下调,且通过 JAK2/STAT3 信号通路抑制了 HCC 细胞的增殖、迁移和侵袭。低表达水平的 miR-216a-5p 预示了不良预后。以上发现可能为 HCC 治疗提供新的治疗思路。
[1] El-Serag HB. Hepatocellular carcinoma: an epidemiologic view. J Clin Gastroenterol, 2002, 35(5 Suppl 2):S72-S78.
[2] Gao L, Wang X, Tang Y, et al. FGF19/FGFR4 signaling contributes to the resistance of hepatocellular carcinoma to sorafenib. J Exp Clin Cancer Res, 2017, 36(1):8.
[3] Muaddi H, Al-Adra DP, Beecroft R, et al. Liver transplantation is equally effective as a salvage therapy for patients with hepatocellular carcinoma recurrence following radiofrequency ablation or liver resection with curative intent. Ann Surg Oncol, 2018, 25(4):991-999.
[4] Yates LA, Norbury CJ, Gilbert RJ. The long and short of microRNA. Cell, 2013, 53(3):516-519.
[5] Wong CM, Tsang FH, Ng IO. Non-coding RNAs in hepatocellular carcinoma: molecular functions and pathological implications. Nat Rev Gastroenterol Hepatol, 2018, 15(3):137-151.
[6] Dong Z, Qi R, Guo X, et al. MiR-223 modulates hepatocellular carcinoma cell proliferation through promoting apoptosis via the Rab1-mediated mTOR activation. Biochem Biophys Res Commun, 2017, 483(1):630-637.
[7] Chang RM, Xiao S, Lei X, et al. miRNA-487a promotes proliferation and metastasis in hepatocellular carcinoma. Clin Cancer Res, 2017, 23(10):2593-2604.
[8] Zhao G, Han C, Zhang Z, et al. Increased expression of microRNA-31-5p inhibits cell proliferation, migration, and invasion via regulating Sp1 transcription factor in HepG2 hepatocellular carcinoma cell line. Biochem Biophys Res Commun, 2017, 490(2): 371-377.
[9] Pasquier F, Cabagnols X, Secardin L, et al. Myeloproliferative neoplasms: JAK2 signaling pathway as a central target for therapy. Clin Lymphoma Myeloma Leuk, 2014, 14 Suppl:S23-S35.
[10] Hou BH, Jian ZX, Cui P, et al. miR-216a may inhibit pancreatic tumor growth by targeting JAK2. FEBS Lett, 2015, 589(17):2224-2232.
[11] Ding L, Xu Y, Zhang W, et al. MiR-375 frequently downregulated in gastric cancer inhibits cell proliferation by targeting JAK2. Cell Res, 2010, 20(7):784-793.
[12] Wang J, Zeng H, Li H, et al. MicroRNA-101 inhibits growth, proliferation and migration and induces apoptosis of breast cancer cells by targeting sex-determining region Y-box 2. Cell Physiol Biochem, 2017, 43(2):717-732.
[13] Kabir TD, Ganda C, Brown RM, et al. A microRNA-7/growth arrest specific 6/TYRO3 axis regulates the growth and invasiveness of sorafenib-resistant cells in human hepatocellular carcinoma. Hepatology, 2018, 67(1):216-231.
[14] Neradugomma NK, Subramaniam D, Tawfik OW, et al. Prolactin signaling enhances colon cancer stemness by modulating Notch signaling in a Jak2-STAT3/ERK manner. Carcinogenesis, 2014, 35(4): 795-806.
[15] Besancenot R, Roos-Weil D, Tonetti C, et al. JAK2 and MPL protein levels determine TPO-induced megakaryocyte proliferation vs differentiation. Blood, 2014, 124(13):2104-2115.
[16] Wörmann SM, Song L, Ai J, et al. Loss of P53 function activates JAK2-STAT3 signaling to promote pancreatic tumor growth, stroma modification, and gemcitabine resistance in mice and is associated with patient survival. Gastroenterology, 2016, 151(1):180-193, e12.
[17] Wang S, Liang K, Hu Q, et al. JAK2-binding long noncoding RNA promotes breast cancer brain metastasis. J Clin Invest, 2017, 127(12): 4498-4515.
[18] Zhang X, Hu F, Li G, et al. Human colorectal cancer-derived mesenchymal stem cells promote colorectal cancer progression through IL-6/JAK2/STAT3 signaling. Cell Death Dis, 2018, 9(2):25.
miR-216a-5p suppresses the proliferation and invasion of hepatocellular carcinoma cells through targeting JAK2
ZHOU Wei, TAN Xiao-yu, LI Hui-fen, WANG Shuang
Department of Oncology, The Shanghai Seventh People’s Hospital, Shanghai 200137, China (ZHOU Wei, WANG Shuang); Department of Hepatobiliary Surgery, General Hospital of Guangzhou Military Command of PLA, Guangdong 510010, China (TAN Xiao-yu, LI Hui-fen)
Accumulating evidences have indicated that microRNA (miRNA) dysregulation contributes to hepatocellular carcinoma (HCC) progression. In this study, we investigated the potential function of miR-216a-5p in HCC.
Expression of miR-216a-5p in 92 cases of HCC tissues and adjacent normal tissues was determined by using quantitative real-time PCR (qRT-PCR) analyses. In vitro, cell proliferation and invasion capacity were evaluated by CCK8 assay and Transwell invasion assay, respectively. Luciferase reporter assay, Western blot and qRT-PCR were used to detect the association between miR-216a-5p expression and Janus kinase 2 (JAK2) in HCC.
In this study, we showed that the expression level of miR-216a-5p was significantly decreased in HCC, and was associated with several clinicopathological characteristics, including tumor multiplicity, histological differentiation, and Barcelona clinic liver cancer stage. Low expression level of miR-216a-5p was associated with poor survival outcomes in HCC patients. Upregulation of miR-216a-5p suppressed cell proliferation, migration, and invasion of HCC. Dual luciferase assay demonstrated that JAK2 was a direct downstream target of miR-216a-5p. JAK2 reintroduction restored the inhibited proliferation, migration, and invasion of miR-216a-5p-overexpressed HCC cells. miR-216a-5p functioned as a tumor suppressor to modulate the JAK2/STAT3 signaling pathway.
The present findings indicate that miR-216a-5p could be used as a prognostic predictor and therapeutic candidate for HCC.
Carcinoma, hepatocellular; Janus kinase 2; Cell proliferation; Neoplasm invasiveness; miR-216a-5p
WANG Shuang,Email: xiaowangshuanggege@163.com
上海市卫生和计划生育委员会青年基金(20164Y0055)
王爽,Email:xiaowangshuanggege@163.com
2018-11-09
10.3969/j.issn.1673-713X.2019.02.009

