NR2B与钩藤碱抑制甲基苯丙胺依赖斑马鱼CPP的关系研究
朱 晨,刘 伟,罗超华,陈志杰,周玉婷,霍楚莹,李 璟,莫志贤*
1南方医科大学中医药学院;2南方医科大学中心实验室,广州 510515
钩藤为茜草科常绿木质藤本钩藤Uncariarhynchophylla(Miq.)Jacks.、大叶钩藤UncariamacrophyllaWall.、毛钩藤UncariahirsuteHavil.、华钩藤Uacariasinensis(Oliv.)Havil.或无柄果钩藤UacariasessilifructusRoxb.的干燥带钩茎枝。味甘性微寒、味甘苦、入心包经,具有清热平肝,息风定惊的作用。钩藤碱为钩藤主要成分活性,具有降血压、镇静、抗惊厥、抗癫痫、抗炎等药理作用[1]。本团队前期研究表明,钩藤碱(60 mg/kg)可以抑制苯丙胺引起的大鼠产生条件性位置偏爱(condition place preference,CPP)并且调节其脑内氨基酸类神经递质的含量[2];钩藤碱(80 mg/kg)具有抑制甲基苯丙胺(Methamphetamine,METH)诱导的小鼠CPP的作用[3]。
NMDA受体主要由两类亚基组成:NMDA受体1(NR1)和NMDA受体2(NR2)。NR2受体由四个亚单位组成(NR2A-D)。NR2B主要存在于脑部,是决定NR2生理性功能的重要亚基[4]。NMDA受体主要参与了学习与记忆的过程,脑内NR2B-NMDARs激活后,M2环处阳离子通道开放,细胞膜外钙离子内流,使细胞膜内钙离子浓度升高,最终引起基因转录,蛋白表达和突触后膜功能改变,从而建立长时程增强,有助于促进学习、记忆和认知功能的形成[5]。静脉给予孕期大鼠氯胺酮后发现,其子代鼠海马区内NR2B蛋白表达下降,且子代鼠的学习、空间记忆能力损伤[6]。
斑马鱼是一种常用的模式生物,与人类基因高度同源。斑马鱼神经系统简单但能够支配复杂的活动,可用于进行运动、学习、记忆等行为学评价。此外,斑马鱼表现出的学习、睡觉、药物成瘾和神经保护表型均与人类相似[7]。目前国内外常用于药物成瘾研究的实验动物主要是大、小鼠,但单纯的啮齿类动物模型对药物依赖研究存在明显的局限性,特别对当前层出不穷的各种新型毒品,单一物种的动物模型不能全面准确地复制出不同毒品品系的特征和成瘾症状,而苯丙胺类和氯胺酮类物质,以精神依赖为主要表现,传统的动物模型无法观察到这些新型毒品成瘾的所有特征和表现。与啮齿类动物相比,斑马鱼成鱼器官与系统的简单性和复杂性之间具有良好的平衡特点,能更准确地反映药物对动物行为的影响。斑马鱼体积小,重量轻,用药量少,能明显减少实验用成瘾性物质,节约药物资源;斑马鱼繁殖能力强,周期短,能明显缩短实验周期。因此,斑马鱼药物依赖模型的建立和应用将为毒瘾医学领域的研究增加新的模式生物资源。目前国外对阿片类和可卡因这些传统毒品的斑马鱼模型的研究报道较多,但对新型毒品的斑马鱼模型报道较少。本文采用课题组前期建立的甲基苯丙胺诱导的斑马鱼CPP模型,探索钩藤碱对METH诱导的斑马鱼CPP的作用,应用蛋白免疫印迹和免疫组化法检测NR2B的表达,进一步阐明钩藤碱对METH依赖斑马鱼CPP的分子作用机制。
1 材料与方法
1.1 材料
1.1.1 药品与试剂
盐酸甲基苯丙胺,购自国家麻醉品实验室,批号:1212-9802;钩藤碱(纯度:≥98%),购自日本MATSUURA YKUGYO 公司;盐酸氯胺酮注射液(规格:2 mL:0.1 g),购自江苏恒瑞医药股份有限公司;三卡因甲磺酸盐(MS222),购自Sigma公司;抗NR2B抗体(AB1557P),购自Millipore公司;鱼用生理盐水,自配,NaCl浓度为100 mmol/L。
1.1.2 仪器
Noldus EthoVision XT 8.5软件(荷兰Noldus公司);ChemiImager 550凝胶成像仪(美国Alpha Innotech公司)。
1.1.3 实验动物
斑马鱼(野生型,AB系,10~12个月),雌雄各半,由南方医科大学斑马鱼实验中心提供。养鱼系统为北京爱生公司净水系统(T=28.5~29.5 ℃);生理盐水浓度为0.03%~0.04%;pH值为7.2~7.6;光照条件为14 h光照(8∶30 am~10∶30 pm),10 h黑夜(10∶30 pm~8∶30 am)。
1.2 方法
1.2.1 CPP箱的制作
CPP箱长16 cm,宽9 cm,高9 cm。CPP箱分为两个等体积的箱体组成,一箱涂成黑色,一箱为透明,两箱体间由一个透明的活动挡板隔开。
1.2.2 斑马鱼基线测定
实验前将斑马鱼放入CPP箱中适应性喂养2天。第三天记录15 min内斑马鱼在黑白箱中的停留时间(以斑马鱼头部为准)。实验结果显示,在自然状态下,>90%的斑马鱼偏爱黑箱,因此将黑箱选为偏爱箱,白箱选为伴药箱。斑马鱼筛选要求以其在黑箱中的活动时间≥8 min为合格[8]。
1.2.3 CPP模型复制与给药
选符合基线测定的斑马鱼50条,随机分为5组:空白组,模型组(40 mg/kg),钩藤碱低剂量组(40 mg/kg),钩藤碱高剂量组(80 mg/kg),氯胺酮组(150 mg/kg)。实验前记录15 min内斑马鱼在伴药箱中的停留时间及运动路线。d1、d3、d5上午8:00腹腔注射甲基苯丙胺(40 mg/kg),放入伴药箱中训练40 min(空白组则给予同体积的生理盐水);d2、d4、d6同一时间腹腔注射生理盐水后放入偏爱箱中训练40 min。d2~d6晚上8:00腹腔注射相应的药物,对照组和模型组则注射生理盐水。末次给药24 h后,记录斑马鱼在伴药箱中的停留时间及运动路线。
1.2.4 免疫组化法检测斑马鱼脑区NR2B的表达
斑马鱼行为学测定结束后,将斑马鱼冷冻处死,迅速取下斑马鱼头部,于4%多聚甲醛固定24 h。斑马鱼头部进行常规脱水,包埋。切片机进行切片,厚度约为5 (m,用防脱载玻片捞起,进行常规脱蜡与水化。按常规免疫组化法进行NR2B免疫组化染色,一抗为NR2B(1∶100),二抗为辣根过氧化物酶标记的山羊抗兔IgG(1∶200),阴性对照则用PBS液代替一抗。结果判定阳性表达为胞膜和(或)胞质内呈现棕黄色颗粒染色,若无棕黄色颗粒则为阴性。
1.2.5 Western blotting法检测斑马鱼脑区NR2B的表达
斑马鱼行为学测定结束后,显微镜下取斑马鱼脑组织。加入RIPA裂解液和PMSF(50∶1),进行超声匀浆提取组织蛋白,用BCA法检测蛋白浓度,参考之前的文献进行Western blot实验。一抗为NR2B(1∶1 000),以β-actin为内标;二抗为辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000)。用ChemiImager 550凝胶成像仪采集图像,并用Image-Pro Plus 6.0软件分析每个条带的积分光密度(IOD)值。
1.2.6 统计学处理

2 结果
2.1 斑马鱼训练前后在伴药箱的活动变化
用Noldus EthoVision XT 8.5软件,分析训练前后斑马鱼在伴药箱中的停留时间和运动轨迹,比较训练前后各组斑马鱼在伴药箱中活动时间的差值(斑马鱼训练后在伴药箱中的活动时间-斑马鱼训练前在伴药箱中的活动时间)。由图1可见,与空白组相比,注射METH 40 mg/kg后,模型组斑马鱼在伴药箱中停留时间明显增加(P<0.01);与模型组相比,钩藤碱高剂量组(80 mg/kg)斑马鱼在伴药箱中的停留时间明显减少(P<0.01)。各组斑马鱼造模前后在CPP箱的运动路线图见图2。
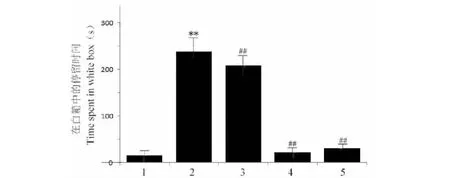
图1 在白箱中的停留时间Fig.1 Time spent in white box 注:1:空白组;2:模型组;3:钩藤碱低剂量组;4:钩藤碱高剂量组;5:氯胺酮组。与空白组比较,**P<0.01;与模型组比较,##P<0.01。Note:1:Control group;2:Model group;3:Rhynchophylline low-dose (40 mg/kg) group;4:Rhynchophylline high-dose (80 mg/kg);5:Ketamine group.Compared with control group,**P<0.01; compared with model group, ##P<0.01.

图2 斑马鱼在CPP箱中的线路图Fig.2 Road maps of zebrafish in CPP compartment注:A:空白组(造模前);B:模型组(造模前);C:钩藤碱低剂量组(造模前);D:钩藤碱高剂量组(造模前);E:氯胺酮组(造模前);F:空白组(造模后);G:模型组(造模后);H:钩藤碱低剂量组(造模后);I:钩藤碱高剂量组(造模后);J:氯胺酮组(造模后)。Note:A:Control group before modeling;B:Model group before modeling;C:Rhynchophylline low-dose (40 mg/kg) group before modeling;D:Rhynchophylline high-dose (80 mg/kg) group before modeling;E:Ketamine group before modeling;F:Control group after modeling;G:Model group after modeling;H:Rhynchophylline low-dose (40 mg/kg) group after modeling;I:Rhynchophylline high-dose (80 mg/kg) group after modeling;J:Ketamine group after modeling.
2.2 NR2B蛋白免疫组化结果
采用Image-Pro Plus 6.0图像分析软件,测定阳性细胞的IOD值,取其平均值作为该组各项指标的相对含量。如图3所示,与空白组相比,经过CPP训练后,模型组斑马鱼脑区中NR2B阳性细胞数明显增加(P<0.01);与模型组相比,给予钩藤碱干预后,斑马鱼脑区NR2B阳性细胞数明显下降,(P<0.01)。
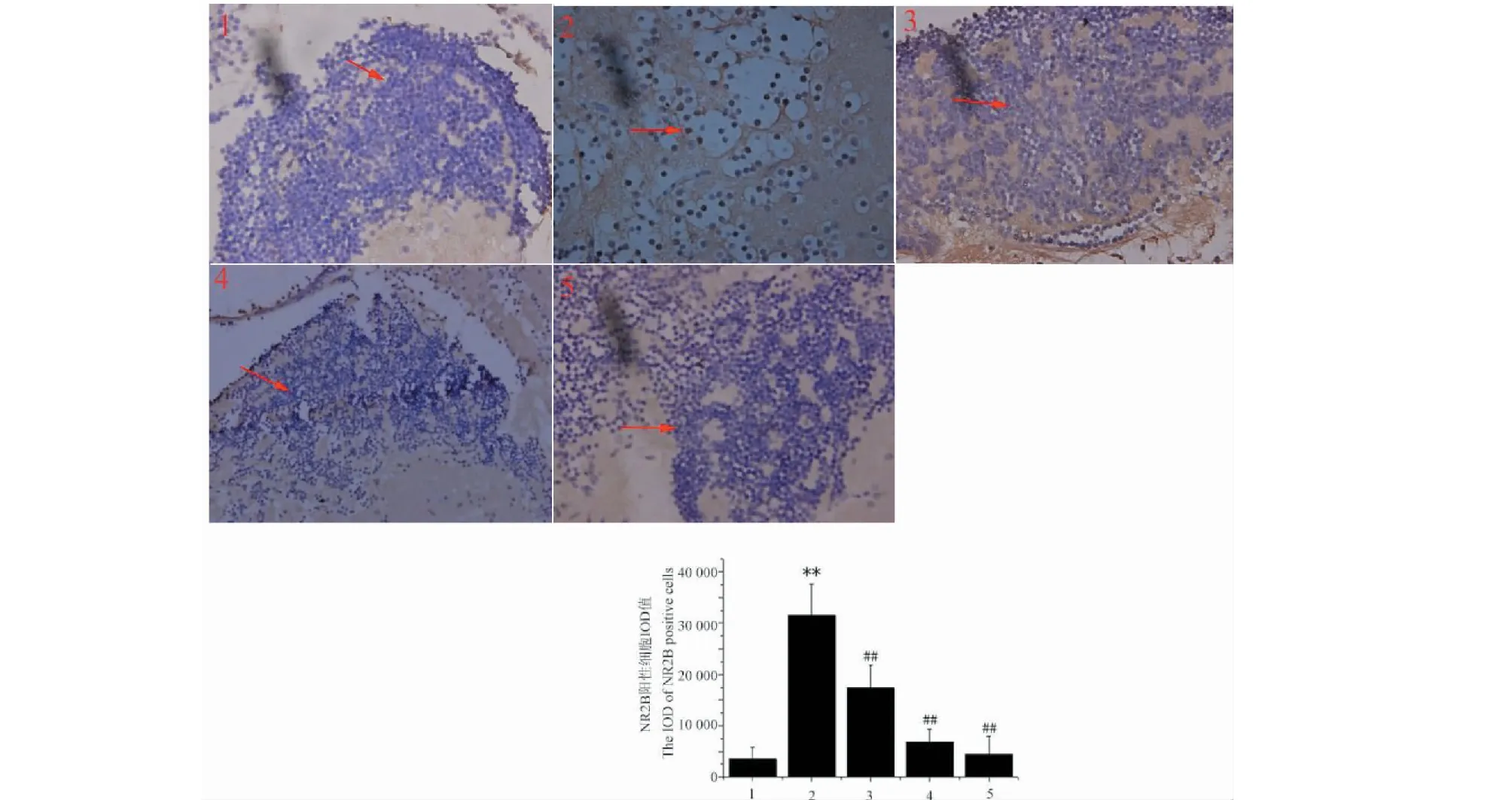
图3 各组斑马鱼中脑区NR2B阳性细胞的积分光密度Fig.3 The IOD of NR2B positive cells in area of midbrain of zebrafish in each group )注:1:空白组;2:模型组;3:钩藤碱(40 mg/kg)组;4:钩藤碱(80 mg/kg)组;5:氯胺酮组。与空白组比较,**P<0.01;与模型组比较,##P<0.01。Note:1:Control group;2:Model group;3:Rhynchophylline low-dose (40 mg/kg) group;4:Rhynchophylline high-dose(80 mg/kg) group;5:Ketamine group.Compared with control group,**P<0.01;compared with model group,##P<0.01.
2.3 NR2B蛋白的Western blot分析结果
如图4所示,斑马鱼脑内的NR2B表达IOD值存在统计学差异。与空白组相比,模型组斑马鱼脑内的NR2B表达增加(P<0.01);与模型组相比,钩藤碱高剂量组(80 mg/kg)斑马鱼脑内的NR2B表达明显减少(P<0.01)。
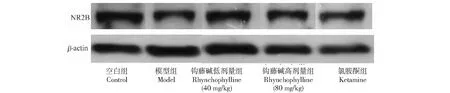
图4 斑马鱼脑内NR2B蛋白的表达Fig.4 The protein expression of NR2B in zebrafish brain 注:1:空白组;2:模型组;3:钩藤碱低剂量组;4:钩藤碱高剂量组;5:氯胺酮组。与空白组比较,**P<0.01;与模型组比较,##P<0.01。Note:1:Control group;2:Model group;3:Rhynchophylline low-dose (40 mg/kg) group;4:Rhynchophylline high-dose (80 mg/kg) group;5:Ketamine group.Compared with control group,**P<0.01;compared with model group,##P<0.01.
3 结果
METH俗称“冰毒”,是一种被严重滥用的新型毒品,具有成瘾性极强,复吸率极高等特点,长期以来一直是一个困扰医学和公众健康的棘手问题。CPP实验人为的将药物与动物先天非偏爱侧关联,对比动物训练前后在非偏爱侧的停留时间来判断其依赖程度,是公认的用于研究药物依赖、精神依赖的模型[9]。
本次实验结果显示,与空白组相比,腹腔注射METH(40 mg/kg)后,斑马鱼在伴药箱中的停留时间明显增加,表明斑马鱼METH依赖CPP模型构建成功;而在给予钩藤碱(80 mg/kg)治疗后,斑马鱼在伴药箱中的停留时间明显减少,表明钩藤碱可以抑制METH引导的CPP行为。
NMDA受体是中枢神经系统中主要的兴奋性氨基酸受体之一。NR2B是其发挥生理作用的重要亚基,具有增强学习和记忆能力的作用,在药物依赖发生发展过程中起着重要作用[10]。大鼠连续4天腹腔注射METH(10 mg/kg),大鼠脑内NR2B表达显著上调[11,12];减少大鼠脑内NR2B亚基,可阻止吗啡引导大鼠产生奖赏行为[13];吗啡诱导大鼠形成条件性位置偏爱之后,艾芬地尔(NR2B拮抗剂)可以剂量依赖性地拮抗吗啡诱导的CPP[14]。
本实验研究发现,与空白组比较,给予METH 40 mg/kg后,METH依赖斑马鱼脑内NR2B阳性细胞数及NR2B蛋白的表达明显增加;给予钩藤碱(80 mg/kg)干预后,斑马鱼脑内NR2B阳性细胞数和NR2B蛋白表达明显减少,表明NR2B与钩藤碱抑制METH引起的CPP效应有关,是动物行为学改变的神经生物学机制之一。
钩藤碱是中药钩藤的主要活性成分,本团队前期研究发现,钩藤碱可以抑制METH诱导小鼠和斑马鱼产生CPP效应,并且抑制其脑内TH蛋白的表达[8]。钩藤碱能抑制苯丙胺依赖大鼠产生CPP效应,并减少其脑内伏核和杏仁核中NR2B蛋白及NR2BmRNA的表达[15,16]。钩藤碱可抑制METH引起的大鼠伏隔核内GluR2/3亚基蛋白表达上调,以及下丘脑内GluR2/3亚基蛋白表达下调[17]。钩藤碱(60 mg/kg)可抑制METH依赖大鼠海马CA1区和纹状体中p-CREB、c-Fos阳性细胞数明显增加的趋势,使p-CREB及c-Fos阳性细胞数恢复正常[18]。
本研究表明,钩藤碱(80 mg/kg)具有抑制METH依赖斑马鱼CPP的作用,这种作用可能与降低斑马鱼脑内NR2B蛋白的表达有关。由于药物成瘾的发生与发展极其复杂,关于钩藤碱调控NR2B的机制仍需进一步深入研究。

